20 bài tập về tính toán tốc độ phản ứng có lời giải
Làm đề thiCâu hỏi 1 :
Cho phương trình hóa học của phản ứng: X + 3Y → 2Z + T. Ở thời điểm ban đầu nồng độ của chất X là 0,01 mol/l. Sau 20 giây, nồng độ của chất X là 0,008 mol/l. Tốc độ phản ứng trung bình của chất Y trong khoảng thời gian trên là
- A 2,0.10-3 mol/(l.s).
- B 8,0.10-4 mol/(l.s).
- C 3,0.10-4 mol/(l.s).
- D 1,0.10-4 mol/(l.s).
Đáp án: C
Phương pháp giải:
Dựa vào công thức tính tốc độ trung bình: \(\overline v = \frac{{{C_2} - {C_1}}}{{\Delta t}}\)
Lời giải chi tiết:
Tốc độ trung bình của chất X: \(\overline v_X = \frac{{{C_2} - {C_1}}}{{\Delta t}} = {10^{ - 4}}(mol/l.s)\)
Do lượng Y giảm gấp 3 lần lượng X => \(\overline v_Y = 3 \overline v_X = {3.10^{ - 4}}(mol/l.s)\)
Đáp án C
Câu hỏi 2 :
Cho phản ứng Br2 + HCOOH → 2HBr + CO2
Nồng độ ban đầu của Br2 là a mol/ lít, sau 50 giây nồng độ Br2 còn lại là 0,01 mol/ lít. Tốc độ trung bình của phản ứng trên tính theo Br2 là 4.10-5 mol/ (l.s). Giá trị của a là
- A 0,016
- B 0,014
- C 0,018
- D 0,012
Đáp án: D
Phương pháp giải:
Áp dụng công thức tính tốc độ phản ứng: v = -(C2 – C1)/Δt
Lời giải chi tiết:
Tốc độ v = -(C2 – C1)/Δt
=> C1 = 0,012 mol/lit
Đáp án D
Câu hỏi 3 :
Thực hiện phản ứng sau trong bình kín có dung tích không đổi 2 lít.
X2(k) + Y2(k) → 2 Z(k)
Lúc đầu số mol của khí X2 là 0,6 mol, sau 10 phút số mol của khí X2 còn lại 0,12 mol. Tốc độ trung bình của phản ứng tính theo X2 trong khoảng thời gian trên là:
- A 4.10-4 mol/(l.s)
- B 2,4 mol/(l.s)
- C 4,6 mol/(l.s)
- D 8.10-4 mol/(l.s)
Đáp án: A
Phương pháp giải:
Tốc độ v = (C1 – C2)/Δt
Lời giải chi tiết:
Chú ý: Thể tích của bình là 2 lít nên cần phải tính lại nồng độ.
Ta có: \(v = \frac{{\frac{{0,6}}{2} - \frac{{0,12}}{2}}}{{10.60}} = {4.10^{ - 4}}mol/(l.s)\)
Đáp án A
Câu hỏi 4 :
Khi bắt đầu phản ứng, nồng độ một chất là 0,024 mol/l. Sau 10 giây xảy ra phản ứng, nồng độ của chất đó là 0,022 mol/l. Tốc độ phản ứng trong trường hợp này là
- A 0,0003 mol/l.s.
- B 0,00025 mol/l.s.
- C 0,00015 mol/l.s.
- D 0,0002 mol/l.s.
Đáp án: D
Phương pháp giải:
Áp dụng công thức tính tốc độ của phản ứng:
v = ∆C/∆t
Lời giải chi tiết:
v = ∆C/∆t => v = ( 0,024 – 0,022)/10 = 0,0002 mol/l.s.
Đáp án D
Câu hỏi 5 :
(B-2009) Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 3,36 ml khí O2 (ở đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là
- A 2,5.10-4 mol/(l.s)
- B 5,0.10-4 mol/(l.s)
- C 1,0.10-3 mol/(l.s)
- D 5,0.10-5 mol/(l.s)
Đáp án: D
Phương pháp giải:
Dựa vào công thức tính tốc độ phản ứng: v = ∆C/∆t
Lời giải chi tiết:
![]()
nO2 = 1,5.10-4 mol
=> nH2O2 phản ứng= 3.10-4 mol
=> ∆CH2O2 = n/V = 3.10-4/0,1 = 3.10-3 M
=> v = ∆C/∆t = 3.10-3 / 60 = 5.10-5 mol/(l.s)
Đáp án D
Câu hỏi 6 :
Cho phương trình hóa học của phản ứng tổng hợp amoniac
N2 (k) + 3H2 (k) \(\overset {{t^o},xt,p} \leftrightarrows \) 2NH3 (k)
Khi tăng nồng độ của hiđro lên 2 lần, tốc độ phản ứng thuận
- A tăng lên 8 lẩn.
- B giảm đi 2 lần .
- C tăng lên 6 lần.
- D tăng lên 2 lần.
Đáp án: A
Phương pháp giải:
Dựa vào công thức tính tốc độ của phản ứng: aA + bB → cC + dD
v = k.[A]a.[B]b
Lời giải chi tiết:
v = k.[N2]2.[H2]3
=> Khi tăng nồng độ của hiđro lên 2 lần => v tăng 23= 8 lần
Đáp án A
Câu hỏi 7 :
Cho phản ứng: Br2 + HCOOH → 2HBr + CO2.Nồng độ ban đầu của Br2 là a mol/lít, sau 50 giây nồng độ Br2 còn lại là 0,01 mol/lít. Tốc độ trung bình của phản ứng trên tính theo Br2 là 4.10-5 mol/(l.s). Giá trị của a là
- A 0,018.
- B 0,016.
- C 0,012.
- D 0,014.
Đáp án: C
Phương pháp giải:
Dựa vào công thức tính tốc độ phản ứng: v = ∆C/∆t
Lời giải chi tiết:
∆CBr2 = a-0,01 = v.t = 50.4.10-5 => a = 0,012 mol/lít
Đáp án C
Câu hỏi 8 :
(B-2013) Cho phương trình hóa học của phản ứng: X + 2Y Z + T. Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/l. Sau 20 giây, nồng độ của chất X là 0,008 mol/l. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là
- A 4,0.10−4 mol/(l.s)
- B 1,0.10−4 mol/(l.s).
- C 7,5.10−4 mol/(l.s).
- D 5,0.10−4 mol/(l.s).
Đáp án: B
Phương pháp giải:
Dựa vào công thức tính tốc độ phản ứng: v = ∆C/∆t
Lời giải chi tiết:
=> v = ∆C/∆t = (0,01 – 0,008) / 20 = 1.10-4 mol/(l.s)
Đáp án B
Câu hỏi 9 :
(B-2014) Thực hiện phản ứng sau trong bình kín: H2 (k) + Br2 (k) → 2HBr (k).
Lúc đầu nồng độ hơi Br2 là 0,072 mol/l. Sau 2 phút, nồng độ hơi Br2 còn lại là 0,048 mol/l. Tốc độ
trung bình của phản ứng tính theo Br2 trong khoảng thời gian trên là
- A 8.10-4 mol/(l.s).
- B 2.10-4 mol/(l.s).
- C 6.10-4 mol/(l.s).
- D 4.10-4 mol/(l.s).
Đáp án: B
Phương pháp giải:
Dựa vào công thức tính tốc độ phản ứng: v = ∆C/∆t
Lời giải chi tiết:
=> v = ∆C/∆t = (0,072 – 0,048) /1 20 = 2.10-4 mol/(l.s)
Đáp án B
Câu hỏi 10 :
Cho 3 mẫu đá vôi (100% CaCO3) có cùng khối lượng: Mẫu 1 dạng khối, mẫu 2 dạng viên nhỏ, mẫu 3 dạng bột mịn vào 3 cốc đựng có cùng thể tích dung dịch HCl (dư, cùng nồng độ, ở điều kiện thường). Thời gian để đá vôi tan hết trong 3 cốc tương ứng là t1, t2 ,t3 giây. So sánh nào sau đây đúng?
- A t1< t2< t3
- B t1= t2= t3
- C t3< t2< t1
- D t2< t1< t3
Đáp án: C
Phương pháp giải:
Dựa vào ảnh hưởng của diện tích tiếp xúc tới tốc độ của phản ứng: diện tích tiếp xúc càng lớn thì tốc độ phản ứng càng nhanh => thời gian phản ứng càng ngắn
Lời giải chi tiết:
Diện tích tiếp xúc càng lớn thì phản ứng diễn ra càng nhanh => thời gian phản ứng càng ngắn
Đáp án C
Câu hỏi 11 :
Cho phản ứng A + 2B → C
Nồng độ ban đầu của A là 1M, B là 3M, hằng số tốc độ k = 0,5. Vận tốc của phản ứng khi đã có 20% chất A tham gia phản ứng là:
- A 0,016
- B 2,304
- C 2.704
- D 2.016
Đáp án: C
Phương pháp giải:
Biểu thức tính vận tốc của phản ứng là V = k. [A] . [B]2
Lời giải chi tiết:
V = k. [A] . [B]2
20 % chất A tham gia phản ứng => có : 1. 20 : 100 = 0,2 M đã tham gia phản ứng
A + 2B → C
0,2 => 0,4
=> Nồng độ A còn : 1- 0,2 = 0,8
=> Nồng độ B còn : 3- 0,4 = 2,6
V = 0,5 . 0,8 . 2,62 = 2,704
Đáp án C
Câu hỏi 12 :
Cho phương trình hoá học của phản ứng tổng hợp amoniac:
\({{\text{N}}_{\text{2}}}{\text{(k) + 3}}{{\text{H}}_{\text{2}}}(k)\overset {{t^o},p,xt} \leftrightarrows {\text{2N}}{{\text{H}}_{\text{3}}}{\text{(k)}}\)
Khi tăng nồng độ của H2 lên 2 lần, tốc độ phản ứng thuận:
- A
tăng lên 8 lần.
- B
giảm đi 2 lần.
- C tăng lên 6 lần.
- D tăng lên 2 lần.
Đáp án: A
Phương pháp giải:
Viết biểu thức tính tốc độ của phản ứng: V = k. [N2 ] . [H2]3
Dựa vào biểu thức để suy ra tốc độ của phản ứng thay đổi như nào khi nồng độ H2 tăng 2 lần.
Lời giải chi tiết:
V = k. [N2 ] . [H2]3
Khi tăng nồng độ H2 lên 2 lần thì Vận tốc tăng lên 23 = 8 lần
Đáp án A
Câu hỏi 13 :
Cho phương trình hoá học của phản ứng tổng hợp amoniac:
\({{\text{N}}_{\text{2}}}{\text{(k) + 3}}{{\text{H}}_{\text{2}}}{\text{(k)}}\overset {{t^o},xt,p} \leftrightarrows {\text{2N}}{{\text{H}}_{\text{3}}}{\text{(k)}}\)
Khi tăng nồng độ của H2 lên 3 lần, tốc độ phản ứng thuận:
- A
. tăng lên 8 lần.
- B
giảm đi 3lần.
- C tăng lên 27 lần.
- D . tăng lên 3 lần.
Đáp án: C
Phương pháp giải:
Biểu thức tính tốc độ của phản ứng: V = k . [N2]. [H2]3
Lời giải chi tiết:
V = k . [N2]. [H2]3
Khi tăng nồng độ của H2 lên 3 lần => V sẽ tăng lên 33 = 27 lần
Đáp án C
Câu hỏi 14 :
Hai nhóm học sinh làm thí nghiệm: nghiên cứu tốc độ phản ứng kẽm tan trong dung dịch axit clohydric:
*Nhóm thứ nhất: Cân miếng sắt 1g và thả vào cốc đựng 100ml dung dịch axit HCl 2M.
*Nhóm thứ hai: Cân 1g bột sắt và thả vào cốc đựng 150ml dung dịch axit HCl 2M.
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do:
- A Diện tích bề mặt bột sắt lớn hơn.
- B Nồng độ sắt bột lớn hơn.
- C Nhóm thứ hai dùng axit nhiều hơn.
- D Cả ba nguyên nhân đều sai.
Đáp án: A
Phương pháp giải:
Các yếu tố ảnh hưởng đến tốc độ phản ứng gồm nồng độ, nhiệt độ, áp suất, diện tích tiếp xúc và chất xúc tác. Từ đó xét xem trong thí nghiệm, yếu tố nào ảnh hưởng đến tốc độ phản ứng.
Lời giải chi tiết:
Diện tích bề mặt bột sắt ở nhóm 2 lớn hơn nhóm 1 nên bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn.
Khối lượng sắt trong 2 thí nghiệm là bằng nhau. Nên yếu tố nồng độ bột sắt không ảnh hường.
Thể tích dung dịch không ảnh hưởng đến tốc độ phản ứng.
Đáp án A
Câu hỏi 15 :
Cho phương trình hóa học của phản ứng: X + 2Y → Z + T. Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/l. Sau 20 giây, nồng độ của chất X là 0,008 mol/l. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là:
- A 4,0.10-4 mol/(l.s)
- B 1,0.10-4 mol/(l.s)
- C 7,5. 10-4 mol/(l.s)
- D 5,0.10-4 mol/(l.s)
Đáp án: B
Phương pháp giải:
Dùng công thức tính tốc độ trung bình của phản ứng:
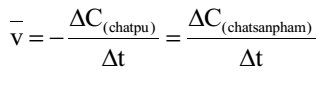
Lời giải chi tiết:
Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là:
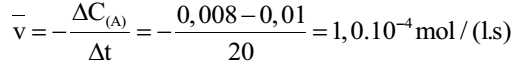
Đáp án B
Câu hỏi 16 :
Cho phản ứng Br2 + HCOOH → 2HBr + CO2
Ban đầu nồng độ Br2 là 0,025 mol/l, sau 60s, nồng độ Br2 là 0,012 mol/l. Tính tốc độ trung bình của phản ứng theo nồng độ của Br2
- A 3,8.10-8 mol/l.s
- B 2,17.10-7 mol/l.s
- C 3,8.10-7 mol/l.s
- D 2,17.10-4 mol/l.s
Đáp án: D
Phương pháp giải:
Áp dụng công thức: \(\overline v = \frac{{{{{\rm{[}}B{r_2}{\rm{]}}}_{{\rm{truoc}}}}{\rm{ - [}}B{r_2}{{\rm{]}}_{{\rm{sau}}}}}}{t} = ?\)
Lời giải chi tiết:
Áp dụng công thức tính tốc độ trung bình của phản ứng ta có:
\({v_t} = \frac{{{\rm{[}}B{r_2}]bd - {\rm{[}}B{r_2}]sau}}{t} = \frac{{0,025 - 0,012}}{{60}} = 2,{17.10^{ - 4}}\,(mol/l.s)\)
Đáp án D
Câu hỏi 17 :
Cho phản ứng hóa học: A + B → C
Nồng độ ban đầu của A là 1 mol/l, của B là 0,8 mol/l. Sau 10 phút, nồng độ của B chỉ còn 20% nồng độ ban đầu. Tốc độ trung bình của phản ứng là
- A 0,16 mol/l.phút
- B 0,016 mol/l.phút
- C 1,6 mol/l.phút
- D 0,064 mol/l.phút
Đáp án: D
Phương pháp giải:
áp dụng công thức tính tốc độ trung bình: \(\overline v = \frac{{\Delta {C_B}}}{t} = \frac{{{C_B}{\,_{dau}} - {C_B}{\,_{sau}}}}{t}\)
Lời giải chi tiết:
Sau 10 phút nồng độ của B còn lại là: CB sau = \(\frac{{20\% }}{{100\% }}.0,8 = 0,16\,(M)\)
Tốc độ trung bình của phản ứng là: \(\overline v = \frac{{\Delta {C_B}}}{t} = \frac{{{C_B}{\,_{dau}} - {C_B}{\,_{sau}}}}{t} = \frac{{0,8 - 0,16}}{{10}} = 0,064\,mol/l.phut\)
Đáp án D
Câu hỏi 18 :
Một phản ứng đơn giản xảy ra trong bình kín: 2NO (k) + O2 (k) \( \rightleftarrows \) 2NO2 (k). Giữ nguyên nhiệt độ, nén hỗn hợp phản ứng xuống còn 1/3 thể tích. Kết luận nào sau đây không đúng ?
- A Tốc độ phản ứng thuận tăng 27 lần.
- B Tốc độ phản ứng nghịch tăng 9 lần.
- C Cân bằng dịch chuyển theo chiều thuận.
- D Hằng số cân bằng tăng lên.
Đáp án: D
Phương pháp giải:
Thể tích giảm dẫn đến áp suất tăng → cân bằng sẽ chuyển dịch theo chiều chống lại sự tăng áp suất từ đó suy luận các đáp án để kết luận tính đúng, sai.
Lời giải chi tiết:
Thể tích giảm dẫn đến áp suất tăng → cân bằng sẽ chuyển dịch theo chiều chống lại sự tăng áp suất → cân bằng chuyển dịch theo chiều thuận (chiều thuận giảm số phân tử khí)→ C đúng
Giả sử ban đầu khi ở trạng thái cân bằng: [NO] = a(M); [O2] = b (M); [NO2] = c (M)
→ Tốc độ chiều thuận: Vt = k[NO]2.[O2] = k.a2.b
→ Tốc độ chiều nghịch: Vn = k’[NO2]2 = k’c
Khi giảm thể tích xuống 3 lần thì nồng độ các chất tăng lên 3 lần
Vthuận sau = k[3NO]2.[3O2] = 32.3 k[NO]2.[O2] = 27 k.a2.b = 27Vt → Tốc độ phản ứng thuận tăng 27 lần → A đúng
Vnghịch sau = k’[3NO2]2 = 32 k’[NO2]2 = 9 k’c = 9Vn → Tốc độ phản ứng nghịch tăng 9 lần → B đúng
Đáp án D
Câu hỏi 19 :
Cho phương trình A(k) + 2B(k) → C (k) + D (k)
Tốc độ phản ứng được tính bằng công thức v = k[A].[B]2. Nếu nồng độ của B tăng lên 3 lần, nồng độ của A không đổi thì tốc độ phản ứng tăng lên bao nhiêu lần?
- A tăng 9 lần.
- B tăng 3 lần.
- C Tăng 27 lần.
- D Không thay đổi
Đáp án: A
Phương pháp giải:
[B’] = [3B] → v’ = k[A].[B’]2
So sánh biểu thức v’ với v để rút ra kết luận
Lời giải chi tiết:
Tăng nồng độ B lên 3 lần thì [B’] = [3B] → v’ = k[A].[B’]2 = 32 k[A].[B] = 9v
Vậy tốc độ phản ứng 9 lần
Đáp án A
Câu hỏi 20 :
(Phần chung)
Trong các cặp phản ứng sau, phản ứng nào có tốc độ lớn hơn? Giải thích.
a) Phản ứng 1: CaCO3 (bột) + dung dịch HCl 2M và phản ứng 2: CaCO3 (viên) + dung dịch HCl 2M (ở cùng nhiệt độ, khối lượng CaCO3 ở 2 phản ứng như nhau).
b) Phản ứng 1 xảy ra ở 300C: dung dịch Ba(OH)2 1,5M + dung dịch H2SO4 1,5M và phản ứng 2 xảy ra ở 500C: dung dịch Ba(OH)2 2,5M + dung dịch H2SO4 1,5M.
Phương pháp giải:
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng để xác định phản ứng có tốc độ lớn hơn.
Lời giải chi tiết:
a) Vì CaCO3 dạng bột có tổng diện tích tiếp xúc lớn hơn CaCO3 dạng viên nên tốc độ phản ứng 1 lớn hơn tốc độ phản ứng 2.
b) Phản ứng 2 thực hiện ở nhiệt độ cao hơn và nồng độ chất tham gia phản ứng Ba(OH)2 lớn hơn nên tốc độ phản ứng ở thí nghiệm 2 lớn hơn tốc độ phản ứng ở thí nghiệm 1.
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải









