Đề thi thử THPT QG môn Hóa trường THPT chuyên Đại học Sư phạm Hà Nội lần 3
Đề bài
Dung dịch nào sau đây phản ứng với dung dịch HCl dư tạo ra chất khí ?
-
A.
Ba(OH)2.
-
B.
Na2CO3.
-
C.
K2SO4.
-
D.
Ca(NO3)2.
Đốt cháy hoàn toàn m gam rượu no, đơn chức, mạch hở, sau phản ứng thu được 13,2 gam CO2 và 8,1 gam nước. Công thức của rượu no, đơn chức là
-
A.
C3H7OH.
-
B.
C4H8OH.
-
C.
C2H5OH.
-
D.
CH3OH.
Thủy phân 324g tinh bột với hiệu suất phản ứng là 75%. Khối lượng glucozơ thu được là:
-
A.
360g
-
B.
480g
-
C.
270g
-
D.
300g
Phát biểu nào sau đây sai?
-
A.
Fructozơ có nhiều trong mật ong.
-
B.
Metyl acrylat, tripanmitin và tristearin đều là este.
-
C.
Ở điều kiện thường, chất béo (C17H33COO)3C3H5 ở trạng thái rắn.
-
D.
Thủy phân hoàn toàn chất béo luôn thu được glixerol.
Cho 1,37 gam kim loại kiềm thổ M phản ứng với nước (dư), thu được 0,01 mol khí H2. Kim loại M là
-
A.
Ba.
-
B.
Sr.
-
C.
Mg.
-
D.
Ca.
Phương trình hóa học nào sau đây sai?
-
A.
2Cr + 3H2SO4(loãng) → Cr2(SO4)3 + 3H2.
-
B.
2Cr + 3Cl2 → 2CrCl3.
-
C.
Cr(OH)3 + 3HCl → CrCl3 + 3H2O.
-
D.
Cr2O3 + 2NaOH (đặc) → 2NaCrO2 + H2O
Nung 21,4 gam Fe(OH)3 ở nhiệt độ cao đến khối lượng không đổi, thu được m gam một oxit. Giá trị của m là
-
A.
8
-
B.
12
-
C.
14
-
D.
16
Cho Cu và dung dịch H2SO4 loãng tác dụng với chất X (một loại phân bón hóa học), thấy thoát ra khí không màu, hóa nâu trong không khí. Mặt khác, khi X tác dụng với dung dịch NaOH thì có mùi khai thoát ra. Chất X là
-
A.
amophot.
-
B.
ure.
-
C.
natri nitrat.
-
D.
amoni nitrat.
Cho 2,0 gam hỗn hợp X gồm metylamin, đimetylamin phản ứng vừa đủ với 0,05 mol HCl, thu được m gam muối. Giá trị của m là
-
A.
3,425.
-
B.
2,550.
-
C.
2,550.
-
D.
3,825.
Tên gọi của polime có công thức (-CH2-CH2-)n là
-
A.
poli vinyl clorua.
-
B.
poli etilen.
-
C.
poli metyl metacrylat.
-
D.
poli stiren.
Saccarozơ và glucozơ đều có
-
A.
phản ứng thủy phân trong môi trường axit.
-
B.
phản ứng với Cu(OH)2 ở nhiệt độ thường tạo thành dung dịch xanh lam.
-
C.
phản ứng với dung dịch NaCl.
-
D.
phản ứng với AgNO3 trong dung dịch NH3, đun nóng.
Cho dãy các chất: C2H5NH2, CH3NH2, NH3, C6H5NH2 (alilin). Chất trong dãy có lực bazo yếu nhất là
-
A.
C2H5NH2.
-
B.
NH3.
-
C.
CH3NH2.
-
D.
C6H5NH2.
Khử hoàn toàn 32 gam CuO bằng khí CO dư, thu được m gam kim loại. Giá trị của m là
-
A.
25,6.
-
B.
19,2.
-
C.
56,4.
-
D.
12,8.
Trong dung dịch X chứa đồng thời các ion: Na+ (0,2 mol); Mg2+ (0,15 mol) và SO42-( x mol). Giá trị của x là
-
A.
0,25 mol.
-
B.
0,35 mol.
-
C.
0,3 mol.
-
D.
0,2 mol.
Cho 8,8 gam CH3COOC2H5 phản ứng hết với dung dịch NaOH(dư), đun nóng. Khối lượng muối CH3COONa thu được là
-
A.
4,1 gam.
-
B.
12,3 gam.
-
C.
8,2 gam.
-
D.
16,4 gam.
Polime thiên nhiên X được sinh ra trong quá trình quang hợp của cây xanh. Ở nhiệt độ thường, X tạo với dung dịch iot hợp chất có màu xanh tím. Polime X là
-
A.
tinh bột.
-
B.
xenlulozơ.
-
C.
glixcogen.
-
D.
saccarozơ.
Thủy phân hoàn toàn 1 mol peptit mạch hở X chỉ thu được 3 mol Gly và 1 mol Ala.Số liên kết peptit trong phân tử X là
-
A.
2.
-
B.
1
-
C.
3.
-
D.
4
Để bảo quản natri, người ta phải ngâm natri trong
-
A.
phenol lỏng.
-
B.
dầu hỏa.
-
C.
nước.
-
D.
rượu etylic.
Trong công nghiệp, Mg được điều chế bằng cách nào dưới đây?
-
A.
Điện phân dung dịch MgSO4.
-
B.
Điện phân nóng chảy MgCl2.
-
C.
Cho kim loại K vào dung dịch Mg(NO3)2.
-
D.
Cho kim loại Fe vào dung dịch MgCl2.
Polime nào sau đây được điều chế bằng phản ứng trùng ngưng?
-
A.
Poli (etylen terephatalat).
-
B.
Poli (metyl metacrylat).
-
C.
Poli stiren.
-
D.
Poli acrilo nitrin.
Nước cứng là nước có chứa nhiều các ion
-
A.
HCO3-, Cl-;
-
B.
Na+, K+.
-
C.
SO42-, Cl-.
-
D.
Ca2+, Mg2+.
Cho hỗn hợp Cu và Fe2O3 vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch X và một lượng chất rắn không tan. Muối trong dung dịch X là
-
A.
FeCl3.
-
B.
CuCl2, FeCl2.
-
C.
FeCl2, FeCl3.
-
D.
FeCl2.
Trong công nghiệp, kim loại nào sau đây chỉ được điều chế bằng phương pháp điện phân nóng chảy
-
A.
Fe.
-
B.
Ag.
-
C.
Cu.
-
D.
Mg.
Nung hỗn hợp X gồm 2,7 gam Al và 10,8 gam FeO, sau một thời gian thu được hỗn hợp Y. Để hòa tan hoàn toàn Y cần vừa đủ V ml dung dịch H2SO4 1M. Giá trị của V là
-
A.
375.
-
B.
600.
-
C.
300
-
D.
400
Este hai chức, mạch hở X có công thức phân tử C6H8O4 và không tham gia phản ứng tráng bạc. X được tạo thành từ ancol Y và axit cacboxylic Z. Y không phản ứng với Cu(OH)2 ở điều kiện thường; khi đun Y với H2SO4 đặc ở 1700C không tạo ra anken. Nhận xét nào sau đây đúng?
-
A.
Trong X có ba nhóm -CH3.
-
B.
Phân tử chất Z có số nguyên tử cacbon bằng số nguyên tử oxi.
-
C.
Chất Y là ancol etylic.
-
D.
Chất Z không làm mất màu dung dịch nước brom.
Chất X tác dụng vừa đủ với dung dịch NaOH, thu được hai chất Y và Z. Cho Z tác dụng với dung dịch AgNO3 trong NH3 thu được chất hữu cơ T. Cho T tác dụng với dung dịch NaOH lại thu được Y. Chất X là
-
A.
HCOOCH=CH2.
-
B.
CH3COOCH=CH-CH3.
-
C.
HCOOCH3.
-
D.
CH3COOCH=CH2.
Đốt cháy a mol X là trieste của glixerol với axit đơn chức mạch hở thu được b mol CO2 và c mol H2O, biết b - c = 4a. Hiđro hóa m gam X cần 6,72 lít H2 (đktc) thu được 39 gam một sản phẩm Y. Nếu đun m gam X với dung dịch chứa 0,7 mol NaOH đến phản ứng hoàn toàn, cô cạn dung dịch sau phản ứng thu được chất rắn khan có khối lượng là
-
A.
57,2 gam
-
B.
52,6 gam
-
C.
61,48 gam
-
D.
53,2 gam
Cho 1 mol triglixerit X tác dụng với dung dịch NaOH dư, thu được 1 mol glixerol, 1 mol natri panmitin và 2 mol natri oleat. Phát biểu nào sau đây sai?
-
A.
Phân tử X có 5 liên kết π.
-
B.
Có 2 đồng phân cấu tạo thỏa mãn tính chất của X.
-
C.
Công thức phân tử chất X là C52H96O6.
-
D.
1 mol X làm mất màu tối đa 2 mol Br2 trong dung dịch.
Nhỏ từ từ 62,5 ml dung dịch hỗn hợp Na2CO3 0,08M và KHCO3 0,12M vào 125 ml dung dịch HCl 0,1M và khuấy đều. Sau các phản ứng, thu được V ml khí CO2(đktc). Giá trị của V là
-
A.
200.
-
B.
224.
-
C.
280.
-
D.
168
Điện phân (với điện cực trơ, cường độ dòng điện không đổi) dung dịch muối nitrat của một kim loại M (có hóa trị không đổi). Sau thời gian t giây, khối lượng dung dịch giảm 6,96 gam và tại catot chỉ thu được (a) gam kim loại M. Sau thời gian 2t giây, khối lượng dung dịch giảm 11,78 gam và tại catot thoát ra 0,224 lít khí (đktc). Giá trị của (a) là
-
A.
8,64.
-
B.
8,64.
-
C.
6,48.
-
D.
5,60.
Cho các chất: Fe, CrO3, Fe(NO3)2, FeSO4, Cr(OH)3, Na2Cr2O7. Số chất phản ứng được với dung dịch NaOH là
-
A.
4
-
B.
5
-
C.
3
-
D.
6
Sục từ từ khí CO2 đến dư vào dung dịch gồm (a) mol NaOH và (b) mol Ca(OH)2. Sự phụ thuộc của số mol kết tủa CaCO3 vào số mol CO2 được biểu diễn theo đồ thị sau:
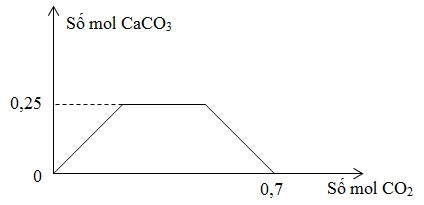
Tỉ lệ (a : b) tương ứng là
-
A.
4 : 5
-
B.
2 : 5
-
C.
5 : 4
-
D.
5 : 2
Cho các phát biểu sau:
(a) Các kim loại Na, K, Ba đều phản ứng mạnh với nước.
(b) Kim loại Cu tác dụng với dung dịch hỗn hợp NaNO3 và H2SO4 (loãng).
(c) Crom bền trong không khí và nước do có màng oxit bảo vệ.
(d) Cho bột Cu vào lượng dư dung dịch FeCl3, thu được dung dịch chứa 3 muối.
(e) Hỗn hợp Al và BaO (tỉ lệ mol tương ứng là 1 : 1) tan hoàn toàn trong nước dư.
(g) Lưu huỳnh, photpho, ancol etylic đều bốc cháy khi tiếp xúc với CrO3.
Số phát biểu đúng là
-
A.
4
-
B.
5
-
C.
3
-
D.
6
Cho (a) mol este X (C9H10O2) tác dụng vừa đủ với (2a) mol NaOH, thu được dung dịch không có phản ứng tráng bạc. Số công thức cấu tạo phù hợp của X là
-
A.
2
-
B.
4
-
C.
3
-
D.
6
Cho các phát biểu sau:
(a) Tất cả các peptit đều có phản ứng màu biure.
(b) Muối phenylamoni clorua không tan trong nước.
(c) Ở điều kiện thường, metylamin và đimetylamin là những chất khí.
(d) Trong phân tử peptit mạch hở Gly-Ala-Gly có 4 nguyên tử oxi.
(e) Ở điều kiện thường, amino axit là những chất lỏng.
Số phát biểu đúng là:
-
A.
3
-
B.
4
-
C.
5
-
D.
2
Cho hỗn hợp gồm Na2O, CaO, Al2O3 và MgO vào lượng nước dư, thu được dung dịch X và chất rắn Y. Sục khí CO2 đến dư vào X, thu được kết tủa là
-
A.
Al(OH)3.
-
B.
Mg(OH)2.
-
C.
MgCO3.
-
D.
CaCO3.
Hòa tan hết 28,16 gam hỗn hợp rắn X gồm Mg, Fe3O4 và FeCO3 vào dung dịch chứa H2SO4 và NaNO3, thu được 4,48 lít (đktc) hỗn hợp khí Y (gồm CO2, NO, N2, H2) có khối lượng 5,14 gam và dung dịch Z chỉ chứa các muối trung hòa. Dung dịch Z phản ứng tối đa với 1,285 mol NaOH, thu được 43,34 gam kết tủa và 0,56 lít khí (đktc). Mặt khác, cho dung dịch Z tác dụng với lượng dư dung dịch BaCl2 thu được 166,595 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Mg trong X là
-
A.
34,09%.
-
B.
25,57%.
-
C.
38,35%.
-
D.
29,83%.
Hỗn hợp E gồm 3 chất: X (là este của amino axit); Y và Z là hai peptit mạch hở, hơn kém nhau 1 nguyên tử nitơ (đều chứa ít nhất hai loại gốc amino axit, MY < MZ). Cho 36 gam E tác dụng vừa đủ với 0,44 mol NaOH, thu được 7,36 gam ancol no, đơn chức, mạch hở và 45,34 gam ba muối của glyxin, thu được CO2, N2 và 1,38 mol H2O. Phần trăm khối lượng của Y trong E là
-
A.
43,33%.
-
B.
20,72%.
-
C.
27,58%.
-
D.
18,39%.
Tiến hành các thí nghiệm sau:
(a) Điện phân NaCl nóng chảy.
(b) Điện phân dung dịch CuSO4 (điện cực trơ).
(c) Cho mẩu K vào dung dịch AlCl3.
(d) Cho Fe vào dung dịch CuSO4.
(e) Cho Ag vào dung dịch HCl.
(g) Cho Cu vào dung dịch hỗn hợp Cu(NO3)2 và NaHSO4.
Số thí nghiệm thu được chất khí là
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Este X hai chức, mạch hở, tạo bởi một ancol no với hai axit cacboxylic no, đơn chức. Este Y ba chức, mạch hở, tạo bởi glixerol với một axit cacboxylic không no, đơn chức (phân tử có hai liên kết π). Đốt cháy hoàn toàn m gam hỗn hợp E gồm X và Y cần vừa đủ 0,5 mol O2 thu được 0,45 mol CO2. Mặt khác, thủy phân hoàn toàn 0,16 mol E cần vừa đủ 210 ml dung dịch NaOH 2M, thu được hai ancol (có cùng số nguyên tử cacbon trong phân tử) và hỗn hợp ba muối, trong đó tổng khối lượng muối của hai axit no là (a) gam. Giá trị của (a) là
-
A.
10,68.
-
B.
20,60.
-
C.
12,36.
-
D.
13,20.
Lời giải và đáp án
Dung dịch nào sau đây phản ứng với dung dịch HCl dư tạo ra chất khí ?
-
A.
Ba(OH)2.
-
B.
Na2CO3.
-
C.
K2SO4.
-
D.
Ca(NO3)2.
Đáp án : B
Dựa vào tính chất hóa học của HCl: làm quỳ tím chuyển sang màu đỏ, tác dụng với oxit bazo, bazo, tác dụng với kim loại đứng trước H, tác dụng với muối (điều kiện tạo ra chất kết tủa hoặc bay hơi)
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
Đốt cháy hoàn toàn m gam rượu no, đơn chức, mạch hở, sau phản ứng thu được 13,2 gam CO2 và 8,1 gam nước. Công thức của rượu no, đơn chức là
-
A.
C3H7OH.
-
B.
C4H8OH.
-
C.
C2H5OH.
-
D.
CH3OH.
Đáp án : C
Đặt công thức của rượu no, đơn chức, mạch hở là: CnH2n+1OH
Ta có: nCnH2n+1OH = nH2O - nCO2 = 0,15 (mol)
=> n = nCO2/n rượu =? => Công thức của rượu
nCO2 = 13,2: 44 = 0,3 (mol)
nH2O = 8,1 : 18 = 0,45 (mol)
Đặt công thức của rượu no, đơn chức, mạch hở là: CnH2n+1OH
CnH2n+1OH → nCO2 + (n+1)H2O
Ta có: nCnH2n+1OH = nH2O - nCO2 = 0,15 (mol)
=> n = nCO2/n rượu = 0,3/0,15= 2
=> Công thức của rượu là: C2H5OH
Thủy phân 324g tinh bột với hiệu suất phản ứng là 75%. Khối lượng glucozơ thu được là:
-
A.
360g
-
B.
480g
-
C.
270g
-
D.
300g
Đáp án : C
(C6H10O5)n\(\xrightarrow{{{H}_{1}}%}\) nC6H12O6
\({{n}_{{{C}_{6}}{{H}_{12}}{{O}_{6}}}}=n.{{n}_{{{\left( {{C}_{6}}{{H}_{10}}{{O}_{5}} \right)}_{n}}}}\)
\(H\% = \dfrac{{{m_{thuc{\kern 1pt} te}}}}{{{m_{ly{\kern 1pt} thuyet}}}}.100\% = > {m_{thuc{\kern 1pt} te}} = {m_{ly{\kern 1pt} thuyet}}.H\% \)
$ {n_{tb}} = \frac{{324}}{{162n}} = \frac{2}{n}\,mol$
${({C_6}{H_{10}}{O_5})_n}+n{{H}_{2}}O \to n{C_6}{H_{12}}{O_6}$
${n_{{C_6}{H_{12}}{O_6}}} = n.{n_{{{\left( {{C_6}{H_{10}}{O_5}} \right)}_n}}} = 2mol$
=> mglu = nglu . Mglu . H% = 2 . 180 . 75% = 270g
Học sinh quên tính H => m = 360g => Đáp án A
Phát biểu nào sau đây sai?
-
A.
Fructozơ có nhiều trong mật ong.
-
B.
Metyl acrylat, tripanmitin và tristearin đều là este.
-
C.
Ở điều kiện thường, chất béo (C17H33COO)3C3H5 ở trạng thái rắn.
-
D.
Thủy phân hoàn toàn chất béo luôn thu được glixerol.
Đáp án : C
Dựa vào kiến thức cacbohidrat, este - lipit
A,B,D đúng
C sai vì chất béo (C17H33COO)3C3H5 ở trạng thái lỏng ở điều kiện thường
Cho 1,37 gam kim loại kiềm thổ M phản ứng với nước (dư), thu được 0,01 mol khí H2. Kim loại M là
-
A.
Ba.
-
B.
Sr.
-
C.
Mg.
-
D.
Ca.
Đáp án : A
PTHH: M + H2O → M(OH)2 + H2↑
Tính mol M theo mol H2, sau đó có khối lượng M rồi sẽ suy ra được phân tử khối của M
PTHH: M + H2O → M(OH)2 + H2↑
0,01 ← 0,01 (mol)
=> MM = 1,37 : 0,01 = 137
=> M là nguyên tố Bari (Ba)
Phương trình hóa học nào sau đây sai?
-
A.
2Cr + 3H2SO4(loãng) → Cr2(SO4)3 + 3H2.
-
B.
2Cr + 3Cl2 → 2CrCl3.
-
C.
Cr(OH)3 + 3HCl → CrCl3 + 3H2O.
-
D.
Cr2O3 + 2NaOH (đặc) → 2NaCrO2 + H2O
Đáp án : A
Dựa vào tính chất hóa học của Crom và hợp chất của nó
A sai vì Cr tác dụng với H2SO4 loãng chỉ tạo ra muối Cr hóa trị (II)
PTHH viết lại: Cr + H2SO4(loãng) → CrSO4 + H2.
Nung 21,4 gam Fe(OH)3 ở nhiệt độ cao đến khối lượng không đổi, thu được m gam một oxit. Giá trị của m là
-
A.
8
-
B.
12
-
C.
14
-
D.
16
Đáp án : D
Nung Fe(OH)3 thu được chất rắn là Fe2O3, bảo toàn nguyên tố Fe: nFe2O3 = 1/2 nFe(OH)3 = ? → m = ?
nFe(OH)3 = 21,4: 107 = 0,2 (mol)
PTHH: 2Fe(OH)3 \(\buildrel {{t^0}} \over\longrightarrow \)Fe2O3 + 3H2O
0,2 → 0,1 (mol)
=> Khối lượng Fe2O3 thu được là: 0,1.160 = 16 (g)
Cho Cu và dung dịch H2SO4 loãng tác dụng với chất X (một loại phân bón hóa học), thấy thoát ra khí không màu, hóa nâu trong không khí. Mặt khác, khi X tác dụng với dung dịch NaOH thì có mùi khai thoát ra. Chất X là
-
A.
amophot.
-
B.
ure.
-
C.
natri nitrat.
-
D.
amoni nitrat.
Đáp án : D
Khí X không màu là NO, khí mùi khai là NH3. Từ sản phẩm thu được suy ngược lại thành phần của X
Cu và H2SO4 tác dụng với chất X có khí không màu, hóa nâu trong không khí là NO => Trong X có nhóm NO3-
Khi X tác dụng với dd NaOH → khí mùi khai → khí đó là NH3
Vậy công thức của X là NH4NO3: amoni nitrat
PTHH: Cu + 4H2SO4 + 8NH4NO3 → 4(NH4)2SO4 + 3Cu(NO3)2 + 4H2O + 2NO↑
NaOH + NH4NO3 → NaNO3 + NH3↑(mùi khai) + H2O
Cho 2,0 gam hỗn hợp X gồm metylamin, đimetylamin phản ứng vừa đủ với 0,05 mol HCl, thu được m gam muối. Giá trị của m là
-
A.
3,425.
-
B.
2,550.
-
C.
2,550.
-
D.
3,825.
Đáp án : D
Bảo toàn khối lượng ta có: mmuối = mamin + mHCl = ?
Amin + HCl → Muối
Bảo toàn khối lượng ta có: mmuối = mamin + mHCl = 2 + 0,05.36,5 = 3,825 (g)
Tên gọi của polime có công thức (-CH2-CH2-)n là
-
A.
poli vinyl clorua.
-
B.
poli etilen.
-
C.
poli metyl metacrylat.
-
D.
poli stiren.
Đáp án : B
Dựa vào kiến thức được học về polime sgk hóa 12
Tên gọi của polime có công thức (-CH2-CH2-)n là poli etilen.
Saccarozơ và glucozơ đều có
-
A.
phản ứng thủy phân trong môi trường axit.
-
B.
phản ứng với Cu(OH)2 ở nhiệt độ thường tạo thành dung dịch xanh lam.
-
C.
phản ứng với dung dịch NaCl.
-
D.
phản ứng với AgNO3 trong dung dịch NH3, đun nóng.
Đáp án : B
Dựa vào kiến thức được học về cacbohidrat
A. Sai vì glucozo không có phản ứng thủy phân.
B. đúng
C. sai, cả 2 chất đều không có phản ứng
D. sai vì chỉ có glucozo có phản ứng, còn saccarozo thì không có phản ứng.
Cho dãy các chất: C2H5NH2, CH3NH2, NH3, C6H5NH2 (alilin). Chất trong dãy có lực bazo yếu nhất là
-
A.
C2H5NH2.
-
B.
NH3.
-
C.
CH3NH2.
-
D.
C6H5NH2.
Đáp án : D
Lấy NH3 làm chuẩn, khi thay thế H trong NH3 bằng các gốc R ta có:
+ các nhóm đẩy e, tức R no thì tính bazo RNH2> NH3
+ các nhóm hút e, tức R không no, hoặc có vòng thơm thì tính bazo RNH2 < NH3
+ Tính bazo của các amin no: amin bậc 3 ≈ amin bậc 1 < amin bậc 2
+ Tính bazo của các amin thơm thì: amin bậc 3 < amin bậc 2 < amin bậc 1
Tính bazo sắp xếp theo thứ tự: C6H5NH2 < NH3 < CH3NH2 < C2H5NH2
=> C6H5NH2 có lực bazo yếu nhất
Khử hoàn toàn 32 gam CuO bằng khí CO dư, thu được m gam kim loại. Giá trị của m là
-
A.
25,6.
-
B.
19,2.
-
C.
56,4.
-
D.
12,8.
Đáp án : A
nCu = nCuO =? → mCu = ?
nCuO = 32 : 80 = 0,4 (mol)
PTHH: CuO + CO \(\buildrel {{t^0}} \over\longrightarrow \) Cu + CO2
0,4 → 0,4 (mol)
=> mCu = 0,4.64 = 25,6 (g)
Trong dung dịch X chứa đồng thời các ion: Na+ (0,2 mol); Mg2+ (0,15 mol) và SO42-( x mol). Giá trị của x là
-
A.
0,25 mol.
-
B.
0,35 mol.
-
C.
0,3 mol.
-
D.
0,2 mol.
Đáp án : A
Bảo toàn điện tích ta tính được mol SO42-
Bảo toàn điện tích ta có:
1.nNa+ + 2nMg2+ = 2nSO42-
=> 1.0,2 + 2.0,15 = 2x
=> x = 0,25 (mol)
Cho 8,8 gam CH3COOC2H5 phản ứng hết với dung dịch NaOH(dư), đun nóng. Khối lượng muối CH3COONa thu được là
-
A.
4,1 gam.
-
B.
12,3 gam.
-
C.
8,2 gam.
-
D.
16,4 gam.
Đáp án : C
mol muối CH3COONa = mol CH3COOC2H5 → mmuối = ?
nCH3COOC2H5 = 8,8:88 = 0,1 (mol)
PTHH: CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
0,1 → 0,1 (mol)
=> mCH3COONa = 0,1.82 = 8,2 (g)
Polime thiên nhiên X được sinh ra trong quá trình quang hợp của cây xanh. Ở nhiệt độ thường, X tạo với dung dịch iot hợp chất có màu xanh tím. Polime X là
-
A.
tinh bột.
-
B.
xenlulozơ.
-
C.
glixcogen.
-
D.
saccarozơ.
Đáp án : A
Dựa vào tính chất đặc trưng của chất tạo màu xanh tím với iot → X ?
Tinh bột tạo hợp chất màu xanh tím với iot => Polime thiên nhiên X là tinh bột
Thủy phân hoàn toàn 1 mol peptit mạch hở X chỉ thu được 3 mol Gly và 1 mol Ala.Số liên kết peptit trong phân tử X là
-
A.
2.
-
B.
1
-
C.
3.
-
D.
4
Đáp án : C
Công thức: số liên kết peptit = số mắt xích - 1
peptit X có 4 mắt xích (tạo bởi 3 Gly và 1 Ala) => số liên kết peptit = 4 -1 = 3
Để bảo quản natri, người ta phải ngâm natri trong
-
A.
phenol lỏng.
-
B.
dầu hỏa.
-
C.
nước.
-
D.
rượu etylic.
Đáp án : B
Dựa vào kiến thức bảo quản kim loại kiềm
Đáp án B
Natri rất dễ phản ứng với nước ở nhiệt độ thường, do vậy để bảo quản natri, người ta phải ngâm chúng trong dầu hỏa.
Đáp án B
Trong công nghiệp, Mg được điều chế bằng cách nào dưới đây?
-
A.
Điện phân dung dịch MgSO4.
-
B.
Điện phân nóng chảy MgCl2.
-
C.
Cho kim loại K vào dung dịch Mg(NO3)2.
-
D.
Cho kim loại Fe vào dung dịch MgCl2.
Đáp án : B
Dựa vào kiến thức điều chế kim loại được học trong bài đại cương về kim loại sgk hóa 12
Trong công nghiệp, Mg được điều chế bằng cách điện phân nóng chảy MgCl2.
MgCl2 \(\buildrel {DPNC} \over\longrightarrow \) Mg + Cl2
Polime nào sau đây được điều chế bằng phản ứng trùng ngưng?
-
A.
Poli (etylen terephatalat).
-
B.
Poli (metyl metacrylat).
-
C.
Poli stiren.
-
D.
Poli acrilo nitrin.
Đáp án : A
Phản ứng trùng ngưng là quá trình tổng hợp polymer dựa vào phản ứng của các mmnomer có chứa những nhóm chất, tạo thành những liên kết mới trong mạch polymer và đồng thời sinh ra hợp chất phụ như H2O...

Nước cứng là nước có chứa nhiều các ion
-
A.
HCO3-, Cl-;
-
B.
Na+, K+.
-
C.
SO42-, Cl-.
-
D.
Ca2+, Mg2+.
Đáp án : D
Dựa vào kiến thức học về nước cứng trong bài kim loại kiềm thổ sgk hóa 12
Nước cứng là nước có chứa nhiều các ion Ca2+, Mg2+.
Cho hỗn hợp Cu và Fe2O3 vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch X và một lượng chất rắn không tan. Muối trong dung dịch X là
-
A.
FeCl3.
-
B.
CuCl2, FeCl2.
-
C.
FeCl2, FeCl3.
-
D.
FeCl2.
Đáp án : B
Cu và Fe2O3 tác dụng với HCl có phản ứng
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (1)
Cu + 2FeCl3 → CuCl2 + 2FeCl2 (2)
Vì còn một lượng chất rắn không tan là Cu nên phương trình (2) FeCl3 phản ứng hết.
Vậy muối trong dung dịch X gồm CuCl2 và FeCl2
Cu không có phản ứng với HCl nhưng có phản ứng với muối Fe3+
Trong công nghiệp, kim loại nào sau đây chỉ được điều chế bằng phương pháp điện phân nóng chảy
-
A.
Fe.
-
B.
Ag.
-
C.
Cu.
-
D.
Mg.
Đáp án : D
Dựa vào kiến thức về điều chế kim loại học trong bài đại cương về kim loại sgk hóa 12
Mg chỉ điều chế bằng phương pháp điện phân nóng chảy
Nung hỗn hợp X gồm 2,7 gam Al và 10,8 gam FeO, sau một thời gian thu được hỗn hợp Y. Để hòa tan hoàn toàn Y cần vừa đủ V ml dung dịch H2SO4 1M. Giá trị của V là
-
A.
375.
-
B.
600.
-
C.
300
-
D.
400
Đáp án : C
Bỏ qua giai đoạn trung gian tạo Y coi như Al và FeO phản ứng với trực tiếp với H2SO4. Tính tổng mol H2SO4 pư theo 2 PTHH sau:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
FeO + H2SO4 → FeSO4 + H2O
nAl = 2,7:27 = 0,1 (mol) ; nFeO = 10,8 : 72 = 0,15 (mol)
Bỏ qua giai đoạn trung gian tạo Y coi như Al và FeO phản ứng với trực tiếp với H2SO4
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
0,1 → 0,15 (mol)
FeO + H2SO4 → FeSO4 + H2O
0,15 → 0,15 (mol)
=> ∑nH2SO4 = 0,15 + 0,15 =0,3 (mol)
=> VH2SO4 = n: CM = 0,3 : 1 = 0,3 (lít) = 300 (ml)
Este hai chức, mạch hở X có công thức phân tử C6H8O4 và không tham gia phản ứng tráng bạc. X được tạo thành từ ancol Y và axit cacboxylic Z. Y không phản ứng với Cu(OH)2 ở điều kiện thường; khi đun Y với H2SO4 đặc ở 1700C không tạo ra anken. Nhận xét nào sau đây đúng?
-
A.
Trong X có ba nhóm -CH3.
-
B.
Phân tử chất Z có số nguyên tử cacbon bằng số nguyên tử oxi.
-
C.
Chất Y là ancol etylic.
-
D.
Chất Z không làm mất màu dung dịch nước brom.
Đáp án : B
C6H8O4 có độ bất bão hòa k = (6.2+ 2-8)/2 = 3
X không tham gia phản ứng tráng bạc => X không tạo bởi axit HCOOH
ancol Y không có phản ứng với Cu(OH)2 => Y không có cấu tạo các nhóm -OH kề nhau, đun Y với H2SO4 đặc ở 1700C không tạo ra anken => Y là ancol CH3OH
=> CTCT của X ?
Từ đó nhận định được các kết luận nào đúng sai
C6H8O4 có độ bất bão hòa k = (6.2+ 2-8)/2 = 3
X không tham gia phản ứng tráng bạc => X không tạo bởi axit HCOOH
ancol Y không có phản ứng với Cu(OH)2 => Y không có cấu tạo các nhóm -OH kề nhau, đun Y với H2SO4 đặc ở 1700C không tạo ra anken => Y là ancol CH3OH
=> CTCT của X là: CH3OOC-CH=CH-COOCH3
=> Z là HOOC-CH=CH-COOH
A. sai, trong phân tử X chỉ có 2 nhóm -CH3
B. đúng, trong Z chỉ số cacbon bằng với oxi và bằng 4
C. Sai, Y là ancol metylic CH3OH
D. Sai, chất Z có liên kết đôi C=C trong phân tử nên làm mất màu dd nước brom
Chất X tác dụng vừa đủ với dung dịch NaOH, thu được hai chất Y và Z. Cho Z tác dụng với dung dịch AgNO3 trong NH3 thu được chất hữu cơ T. Cho T tác dụng với dung dịch NaOH lại thu được Y. Chất X là
-
A.
HCOOCH=CH2.
-
B.
CH3COOCH=CH-CH3.
-
C.
HCOOCH3.
-
D.
CH3COOCH=CH2.
Đáp án : D
X + NaOH → Y + Z
Z + AgNO3/NH3 → T
T + NaOH → Y
=> Y, Z, T có số cacbon bằng nhau
=> Y là muối Na, Z là anđehit => Dựa vào đáp án suy ra được CTCT của X
X + NaOH → Y + Z
Z + AgNO3/NH3 → T
T + NaOH → Y
=> Y, Z, T có số cacbon bằng nhau
=> Y là muối Na, Z là anđehit
=> CTCT của X thỏa mãn chỉ có đáp án D là: CH3COOCH=CH2.
CH3COOCH=CH2 + NaOH → CH3COONa (Y) + CH3CHO(Z)
CH3CHO + 2AgNO3 + 3NH3 + H2O CH3COONH4(T) + 2Ag↓ + 2NH4NO3
CH3COONH4(T) + NaOH → CH3COONa(Y) + NH3↑ + H2O
Đốt cháy a mol X là trieste của glixerol với axit đơn chức mạch hở thu được b mol CO2 và c mol H2O, biết b - c = 4a. Hiđro hóa m gam X cần 6,72 lít H2 (đktc) thu được 39 gam một sản phẩm Y. Nếu đun m gam X với dung dịch chứa 0,7 mol NaOH đến phản ứng hoàn toàn, cô cạn dung dịch sau phản ứng thu được chất rắn khan có khối lượng là
-
A.
57,2 gam
-
B.
52,6 gam
-
C.
61,48 gam
-
D.
53,2 gam
Đáp án : B
Bước 1: Tính số liên kết pi trong X
Áp dụng công thức khi đốt cháy hợp chất hữu cơ bất kì ta luôn có:
Với kX là số liên kết pi + vòng trong X => kX
Bước 2: Xác định khối lượng của X.
=>${m_X} = {m_Y} - {m_{{H_2}}}$
Bước 3: Tính nX, nglixerol
$\begin{gathered}X{\text{ }} + {\text{ }}2{H_2} \to Y \hfill \\= > {n_X} = {\text{ }}{n_Y} = {\text{ }}\dfrac{{{n_{{H_2}}}}}{2} \hfill \\{n_{{C_3}{H_5}{{\left( {OH} \right)}_3}}} = {n_X} \hfill \\ \end{gathered} $
Bước 4: Tính khối lượng chất rắn
${m_{c.ran}} = {m_X} + {m_{NaOH}} - {m_{{C_3}{H_5}{{(OH)}_3}}}$
$- {n_X} = \dfrac{{{n_{C{O_2}}}{\text{ }} - {\text{ }}{n_{{H_2}O}}}}{4} = > k = 5$
$ - BTKL:{m_X}{\text{ + }}{m_{{H_2}}} = {\text{ }}{m_Y}{\text{ => }}{m_X} = {m_Y} - {\text{ }}{m_{{H_2}}}{\text{ }} = {\text{ }}38,4$
- Do X là trieste nên số liên kết pi trong gốc hidrocacbon = 2
$\begin{gathered}X{\text{ }} + {\text{ }}2{H_2} \to Y \hfill \\= > {n_X} = {\text{ }}{n_Y} = {\text{ }}\dfrac{{{n_{{H_2}}}}}{2}{\text{ }} = {\text{ }}0,15 = > {n_{{C_3}{H_5}{{\left( {OH} \right)}_3}}} = {n_X} = 0,15mol \hfill \\ \end{gathered} $
$\begin{gathered}- BTKL:{m_X}{\text{ }} + {\text{ }}{m_{NaOH}}{\text{ }} = {\text{ }}{m_{ran}}{\text{ }} + {\text{ }}{m_{{C_3}{H_5}{{\left( {OH} \right)}_3}}} \hfill \\= > {m_{ran}} = 52,6g \hfill \\ \end{gathered} $
Cho 1 mol triglixerit X tác dụng với dung dịch NaOH dư, thu được 1 mol glixerol, 1 mol natri panmitin và 2 mol natri oleat. Phát biểu nào sau đây sai?
-
A.
Phân tử X có 5 liên kết π.
-
B.
Có 2 đồng phân cấu tạo thỏa mãn tính chất của X.
-
C.
Công thức phân tử chất X là C52H96O6.
-
D.
1 mol X làm mất màu tối đa 2 mol Br2 trong dung dịch.
Đáp án : C
Từ dữ kiện thu được số mol muối natri panmitin và natri oleat → công thức của triglixerit ban đầu tạo bởi 2 gốc axit olein và 1 gốc axit panmitin với glixerol
Từ đó kết luận được các nhận định đề cho là đúng hay sai
=> CTCT của X là:
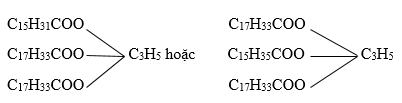
A. đúng, phân tử X có 5 liên kết π với 3 liên kết π trong nhóm -COO- và 2 liên kết π C=C trong nhóm C17H33-
B. đúng
C. sai, công thức phân tử của X là C55H102O6
D. đúng, vì X có 2 liên kết π C=C trong nhóm C17H33-
Nhỏ từ từ 62,5 ml dung dịch hỗn hợp Na2CO3 0,08M và KHCO3 0,12M vào 125 ml dung dịch HCl 0,1M và khuấy đều. Sau các phản ứng, thu được V ml khí CO2(đktc). Giá trị của V là
-
A.
200.
-
B.
224.
-
C.
280.
-
D.
168
Đáp án : A
Khi cho từ từ dd hỗn hợp Na2CO3 và NaHCO3 vào dd HCl thì phản ứng xảy ra theo đúng tỉ lệ Na2CO3 và NaHCO3 ban đầu
So sánh mol nH+ với 2nCO32- + nHCO3- để biết H+ phản ứng hết hay CO32-; HCO32- pư hết.
Tính toán theo PTHH
PTHH: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
NaHCO3 + HCl → NaCl + CO2↑ + H2O
nNa2CO3 = 0,0625.0,08=0,005 (mol) ; nKHCO3 = 0,0625.0,12 = 0,0075 (mol)
nHCl = 0,125.0,1 = 0,0125 (mol)
Ta có:\({{{n_{N{a_2}C{O_3}}}} \over {{n_{KHC{O_3}}}}} = {{0,005} \over {0,0075}} = {2 \over 3}\)
Khi cho từ từ dd hỗn hợp Na2CO3 và NaHCO3 vào dd HCl thì phản ứng xảy ra theo đúng tỉ lệ Na2CO3 và NaHCO3 ban đầu là 2:3
Ta thấy: nH+ = 0,0125 < 2nCO32- + nHCO3- = 0,0175 nên lượng H+ thiếu
Đặt nNa2CO3 = 2a (mol); nNaHCO3 = 3a (mol)
PTHH: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
2a → 4a → 2a (mol)
NaHCO3 + HCl → NaCl + CO2↑ + H2O
3a → 3a → 3a (mol)
→ ∑ nHCl = 7a = 0,0125 => a = 1/560 (mol)
→ VCO2(đktc) = 5a.22,4 = 5.1/560.22,4 = 0,2 (lít) = 200 (ml)
Điện phân (với điện cực trơ, cường độ dòng điện không đổi) dung dịch muối nitrat của một kim loại M (có hóa trị không đổi). Sau thời gian t giây, khối lượng dung dịch giảm 6,96 gam và tại catot chỉ thu được (a) gam kim loại M. Sau thời gian 2t giây, khối lượng dung dịch giảm 11,78 gam và tại catot thoát ra 0,224 lít khí (đktc). Giá trị của (a) là
-
A.
8,64.
-
B.
8,64.
-
C.
6,48.
-
D.
5,60.
Đáp án : C
Giải theo phương pháp đặt ẩn phụ
Đặt hóa trị của kim loại M hóa trị x . Đặt \({x \over M}\)= k
Trong t giây số mol e trao đổi ta: ne trao đổi = \(x.{a \over M}\) = ka => nO2 = ka/4
Khối lượng dd giảm = mM + mO2 là 6,96 gam → a + 32ka/4 = 6,96 (1)
Trong 2t giây thì số mol e trao đổi ở mối điện cực là 2ka
→ Khối lượng dd giảm = mM + mH2 + mO2
\( \to {{2ka - 0,02} \over x}.M + 0,01.2 + 0,5ka.32 = 11,78\,(2)\)
biến đổi rút gọn nhất biểu thức (1) và (2), sau đó thế (1) vào (2) ta sẽ ra được k
Từ đó tìm được x, M và a
Đặt hóa trị của kim loại M hóa trị x . Đặt \({x \over M}\) = k
Trong t giây quá trình xảy ra tại các điện cực
Số mol e trao đổi ta: ne trao đổi = \(x.{a \over M}\) = ka => nO2 = ka/4
Khối lượng dd giảm là 6,96 gam
→ a + 32ka/4 = 6,96
→ a + 8ka = 6,96 (1)
Trong 2t giây thì số mol e trao đổi ở mối điện cực là 2ka
Tại catot: nH2 = 0,01 => nM = (2ka – 0,02)/x
Tại anot: nO2 = 2ka/4 = 0,5ka (mol)
→ Khối lượng dd giảm = mM + mH2 + mO2
\(\eqalign{
& \to {{2ka - 0,02} \over x}.M + 0,01.2 + 0,5ka.32 = 11,78 \cr
& \to {{2ka - 0,02} \over k} + 16ka = 11,76 \cr
& \to a - {{0,01} \over k} + 8ka = 5,88(2) \cr} \)
Thế (1) vào (2) \(6,96 - {{0,01} \over k} = 5,88 \to k = {1 \over {108}}\)
Ta có:\(k = {x \over M} \to {x \over M} = {1 \over {108}}\)
→ Chọn x = 1 và M = 108 (Ag) thỏa mãn
Thế \(k = {1 \over {108}}\) vào (1) →\(a + 8.{1 \over {108}}a = 6,96 \to a = 6,48\,(g)\)
Cho các chất: Fe, CrO3, Fe(NO3)2, FeSO4, Cr(OH)3, Na2Cr2O7. Số chất phản ứng được với dung dịch NaOH là
-
A.
4
-
B.
5
-
C.
3
-
D.
6
Đáp án : B
Dựa vào tính chất hóa học của các chất để xác định những chất có thể phản ứng với dung dịch NaOH.
Có 5 chất phản ứng được với NaOH gồm: CrO3, Fe(NO3)2, FeSO4, Fe(OH)3, Na2Cr2O7.
PTHH:
CrO3 + H2O → H2CrO4; H2CrO4 + 2NaOH → Na2CrO4 + 2H2O
Fe(NO3)2 + 2NaOH → Fe(OH)2 + 2NaNO3
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4
Cr(OH)3 + NaOH → NaCrO2 + 2H2O
Na2Cr2O7 + 2NaOH → 2Na2CrO4 + H2O
Sục từ từ khí CO2 đến dư vào dung dịch gồm (a) mol NaOH và (b) mol Ca(OH)2. Sự phụ thuộc của số mol kết tủa CaCO3 vào số mol CO2 được biểu diễn theo đồ thị sau:

Tỉ lệ (a : b) tương ứng là
-
A.
4 : 5
-
B.
2 : 5
-
C.
5 : 4
-
D.
5 : 2
Đáp án : A
+ nCaCO3 max = nCa(OH)2 = b = ?
+ Tại nCO2 = 0,7 mol: Phản ứng tạo Ca(HCO3)2 và NaHCO3
BTNT "Ca": nCa(HCO3)2 = nCa(OH)2 = ?
BTNT "C": nCO2 = 2nCa(HCO3)2 + nNaHCO3 => nNaHCO3 = ?
BTNT "Na": nNaOH = nNaHCO3 = a = ?
Từ đó xác định được tỉ lệ a : b
+ nCaCO3 max = nCa(OH)2 = b = 0,25 mol
+ Tại nCO2 = 0,7 mol: Phản ứng tạo Ca(HCO3)2 và NaHCO3
BTNT "Ca": nCa(HCO3)2 = nCa(OH)2 = 0,25 mol
BTNT "C": nCO2 = 2nCa(HCO3)2 + nNaHCO3 => 0,7 = 2.0,25 + nNaHCO3 => nNaHCO3 = 0,2 mol
BTNT "Na": nNaOH = nNaHCO3 = a = 0,2 mol
=> a : b = 0,2 : 0,25 = 4 : 5
Cho các phát biểu sau:
(a) Các kim loại Na, K, Ba đều phản ứng mạnh với nước.
(b) Kim loại Cu tác dụng với dung dịch hỗn hợp NaNO3 và H2SO4 (loãng).
(c) Crom bền trong không khí và nước do có màng oxit bảo vệ.
(d) Cho bột Cu vào lượng dư dung dịch FeCl3, thu được dung dịch chứa 3 muối.
(e) Hỗn hợp Al và BaO (tỉ lệ mol tương ứng là 1 : 1) tan hoàn toàn trong nước dư.
(g) Lưu huỳnh, photpho, ancol etylic đều bốc cháy khi tiếp xúc với CrO3.
Số phát biểu đúng là
-
A.
4
-
B.
5
-
C.
3
-
D.
6
Đáp án : D
Xem lại lý thuyết về kim loại kiềm và kiềm thổ, nhôm, crom và đồng
(a) đúng
(b) đúng, PTHH: 3Cu + 2NO3- + 8H+ → 3Cu2+ + 2NO + 4H2O
(c) đúng
(d) đúng, PTHH: Cu + 2FeCl3 → CuCl2 + 2FeCl2
(Vậy dung dịch muối thu được gồm 3 muối: CuCl2, FeCl2, FeCl3 dư)
(e) đúng. Giải thích:
BaO + H2O → Ba(OH)2
1 mol → 1 mol
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2
1 → 0,5dư 0,5 => Al tan hết
(g) đúng vì CrO3 có tính oxi hóa rất mạnh nên lưu huỳnh, photpho, ancol etylic bốc cháy khi gặp CrO3.
Vậy có tất cả 6 phát biểu đúng
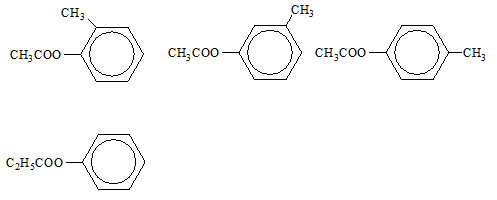
Cho (a) mol este X (C9H10O2) tác dụng vừa đủ với (2a) mol NaOH, thu được dung dịch không có phản ứng tráng bạc. Số công thức cấu tạo phù hợp của X là
-
A.
2
-
B.
4
-
C.
3
-
D.
6
Đáp án : B
X là este đơn chức, phản ứng với NaOH theo tỉ lệ mol 1:2 nên X là este của phenol.
Do X không có phản ứng tráng bạc nên X không có dạng HCOOR'.
Từ đó HS viết các CTCT phù hợp với X.
X là este đơn chức, phản ứng với NaOH theo tỉ lệ mol 1:2 nên X là este của phenol.
Do X không có phản ứng tráng bạc nên X không có dạng HCOOR'.
Vậy có 4 CTCT phù hợp của X là:
Cho các phát biểu sau:
(a) Tất cả các peptit đều có phản ứng màu biure.
(b) Muối phenylamoni clorua không tan trong nước.
(c) Ở điều kiện thường, metylamin và đimetylamin là những chất khí.
(d) Trong phân tử peptit mạch hở Gly-Ala-Gly có 4 nguyên tử oxi.
(e) Ở điều kiện thường, amino axit là những chất lỏng.
Số phát biểu đúng là:
-
A.
3
-
B.
4
-
C.
5
-
D.
2
Đáp án : D
Xem lại lý thuyết về amin, aminoaxit, peptit
(a) sai, đipeptit không có phản ứng màu biure.
(b) sai, muối phenylamoni clorua tan được trong nước.
(c) đúng. HS ghi nhớ 4 amin là chất khí ở điều kiện thường: metylamin, đimetylamin, trimetylamin, etylamin.
(d) đúng, CTCT: H2N-CH2-CONH-CH(CH3)-CONH-CH2-COOH có 4 nguyên tử O
(e) sai, ở điều kiện thường amino axit là những chất rắn kết tinh
Vậy có tất cả 2 phát biểu đúng
Cho hỗn hợp gồm Na2O, CaO, Al2O3 và MgO vào lượng nước dư, thu được dung dịch X và chất rắn Y. Sục khí CO2 đến dư vào X, thu được kết tủa là
-
A.
Al(OH)3.
-
B.
Mg(OH)2.
-
C.
MgCO3.
-
D.
CaCO3.
Đáp án : A
Viết các PTHH xảy ra từ đó xác định được thành phần dung dịch X và suy ra kết tủa thu được khi sục CO2 dư vào dung dịch X.
Na2O + H2O → 2Na+ + 2OH-
CaO + H2O → Ca2+ + 2OH-
Al2O3 + 2OH- →2AlO2- + H2O
Vậy dung dịch X có chứa Na+, Ca2+, AlO2-, OH- (có thể dư)
Khi sục CO2 dư vào dd X:
CO2 + OH- → HCO3-
CO2 + AlO2- + H2O → Al(OH)3↓ + HCO3-
Vậy kết tủa thu được sau phản ứng là Al(OH)3
Hòa tan hết 28,16 gam hỗn hợp rắn X gồm Mg, Fe3O4 và FeCO3 vào dung dịch chứa H2SO4 và NaNO3, thu được 4,48 lít (đktc) hỗn hợp khí Y (gồm CO2, NO, N2, H2) có khối lượng 5,14 gam và dung dịch Z chỉ chứa các muối trung hòa. Dung dịch Z phản ứng tối đa với 1,285 mol NaOH, thu được 43,34 gam kết tủa và 0,56 lít khí (đktc). Mặt khác, cho dung dịch Z tác dụng với lượng dư dung dịch BaCl2 thu được 166,595 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Mg trong X là
-
A.
34,09%.
-
B.
25,57%.
-
C.
38,35%.
-
D.
29,83%.
Đáp án : A
Bảo toàn khối lượng, bảo toàn nguyên tố, bảo toàn điện tích.
Khi cho dung dịch Z tác dụng với BaCl2 dư thì kết tủa thu được là BaSO4
\( \to {n_{BaS{O_4}}} = \dfrac{{166,595}}{{233}} = 0,715\,\,mol\)
Bảo toàn gốc \(SO_4^{2 - } \to {n_{{H_2}S{O_4}}} = 0,715\,\,mol\)
Khi cho Z tác dụng với NaOH vừa đủ thu được khí là NH3
\({n_{N{H_3}}} = \dfrac{{0,56}}{{22,4}} = 0,025\,\,mol \to {n_{NH_4^ + }} = 0,025\,\,mol\)
Bảo toàn điện tích cho dung dịch Z: \(2{n_{M{g^{2 + }}}} + 2{n_{F{e^{2 + }}}} + 3{n_{F{e^{3 + }}}} + {n_{NH_4^ + }} + {n_{N{a^ + }}} = 2{n_{SO_4^{2 - }}}\)
Mà \({n_{NaOH}} = 2{n_{M{g^{2 + }}}} + 2{n_{F{e^{2 + }}}} + 3{n_{F{e^{3 + }}}} + {n_{NH_4^ + }} = 1,285\,\,mol\)
\( \to 1,285 + {n_{N{a^ + }}} = 2.0,715 \to {n_{N{a^ + }}} = 0,145\,\,mol\)
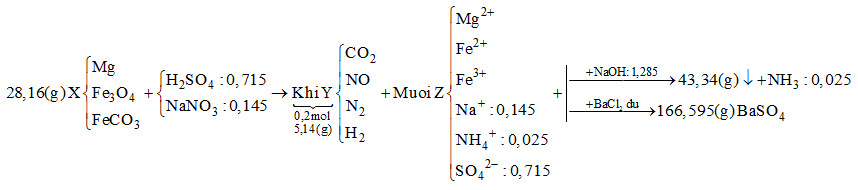
Ta có: \({n_{O{H^ - }\,\,(trong\,\,hidroxit)}} + {n_{NH_4^ + }} = {n_{NaOH}} \to {n_{O{H^ - }\,\,(trong\,\,hidroxit)}} = 1,285 - 0,025 = 1,26\,\,mol\)
Bảo toàn khối lượng: \({m_{Fe}} + {m_{Mg}} + {m_{O{H^ - }\,\,(trong\,\,hidroxit)}} = 43,34 \to {m_{Fe}} + {m_{Mg}} + 1,26.17 = 43,34\)
\( \to {m_{Fe}} + {m_{Mg}} = 21,92g\)
Bảo toàn khối lượng cho dung dịch Z: \({m_{Mg}} + {m_{Fe}} + {m_{Na}} + {m_{NH_4^ + }} + {m_{SO_4^{2 - }}} = 21,92 + 0,145.23 + 0,025.18 + 0,715.96 = 94,345g\)
Bảo toàn khối lượng cho phản ứng: \({m_X} + {m_{{H_2}S{O_4}}} + {m_{NaN{O_3}}} = {m_Z} + {m_Y} + {m_{{H_2}O}}\)
\( \to 28,16 + 0,715.98 + 0,145.85 = 94,345 + 5,14 + {m_{{H_2}O}}\)
\( \to \) \({m_{{H_2}O}} = 14,07g \to {n_{{H_2}O}} = 0,615\,\,mol\)
Bảo toàn nguyên tố H : \(2{n_{{H_2}S{O_4}}} = 2{n_{{H_2}}} + 4{n_{NH_4^ + }} + 2{n_{{H_2}O}}\)
\( \to 2.0,715 = 2{n_{{H_2}}} + 4.0,025 + 2.0,615 \to {n_{{H_2}}} = 0,05\,\,mol\)
Đặt số mol của CO2, NO và N2 lần lượt là x, y, z
\( \to x + y + z + 0,05 = 0,2 \to x + y + z = 0,15\) (*)
Tổng khối lượng Y là 5,14 \( \to 44x + 30y + 28z + 0,05.2 = 5,14\)
\( \to 44x + 30y + 28z = 5,04\) (**)
Bảo toàn nguyên tố N : \({n_{NaN{O_3}}} = {n_{NO}} + 2{n_{{N_2}}} + {n_{NH_4^ + }} \to 0,145 = y + 2z + 0,025\)
\( \to y + 2z = 0,12\) (***)
Từ (*), (**) và (***) \( \to \) x = 0,04; y = 0,01; z = 0,04
\( \to {n_{FeC{O_3}}} = 0,04\,\,mol\)
Gọi số mol của Mg và Fe3O4 lần lượt là a và b
\( \to 24a + 232b + 116.0,04 = 28,16 \to 24a + 232b = 23,52\) (1)
Vì tổng khối lượng của Mg và Fe trong hỗn hợp X là 21,92g
\( \to 24a + 56.(3b + 0,04) = 21,92 \to 24a + 168b = 19,68\) (2)
Từ (1) và (2) \( \to \) a = 0,4; b = 0,06
\( \to \% {m_{Mg}} = \dfrac{{0.4.24}}{{28,16}}.100\% = 34,09\% \)
Hỗn hợp E gồm 3 chất: X (là este của amino axit); Y và Z là hai peptit mạch hở, hơn kém nhau 1 nguyên tử nitơ (đều chứa ít nhất hai loại gốc amino axit, MY < MZ). Cho 36 gam E tác dụng vừa đủ với 0,44 mol NaOH, thu được 7,36 gam ancol no, đơn chức, mạch hở và 45,34 gam ba muối của glyxin, thu được CO2, N2 và 1,38 mol H2O. Phần trăm khối lượng của Y trong E là
-
A.
43,33%.
-
B.
20,72%.
-
C.
27,58%.
-
D.
18,39%.
Đáp án : D
Bảo toàn khối lượng, bảo toàn nguyên tố, quy đổi peptit và biện luận.
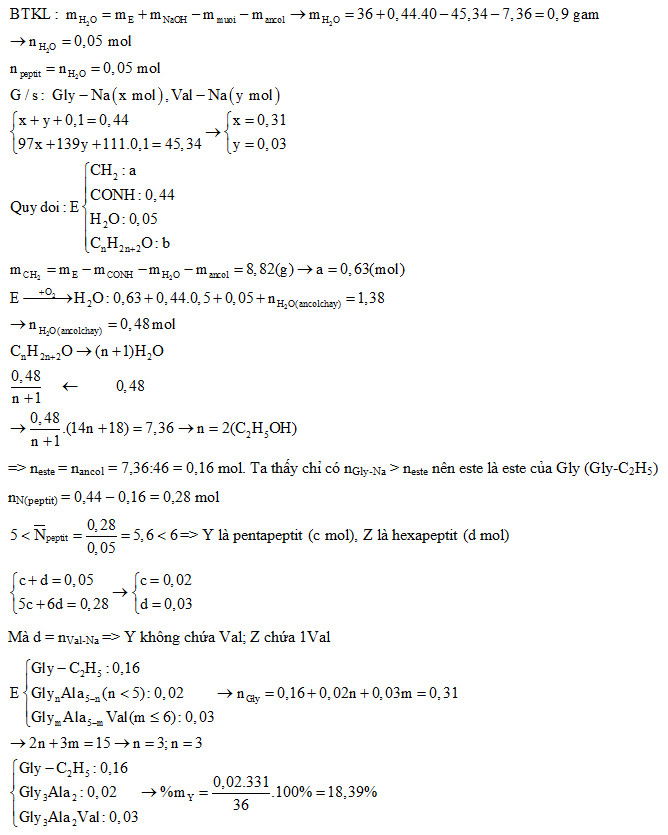
Tiến hành các thí nghiệm sau:
(a) Điện phân NaCl nóng chảy.
(b) Điện phân dung dịch CuSO4 (điện cực trơ).
(c) Cho mẩu K vào dung dịch AlCl3.
(d) Cho Fe vào dung dịch CuSO4.
(e) Cho Ag vào dung dịch HCl.
(g) Cho Cu vào dung dịch hỗn hợp Cu(NO3)2 và NaHSO4.
Số thí nghiệm thu được chất khí là
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Đáp án : C
Viết PTHH từ đó suy ra các thí nghiệm thu được chất khí.
(a) NaCl \(\xrightarrow{{dpnc}}\) Na + Cl2 => thu được khí Cl2
(b) 2CuSO4 + 2H2O \(\xrightarrow{{dp{\text{dd}}}}\) 2Cu + O2 + 2H2SO4 => thu được khí O2
(c) 2K + 2H2O → 2KOH + H2 => thu được khí H2
AlCl3 + 3KOH → Al(OH)3 + 3KCl
Al(OH)3 + KOH → KAlO2 + 2H2O
(d) Fe + CuSO4 → FeSO4 + Cu => không thu được khí
(e) Ag không phản ứng với HCl
(g) 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O => thu được khí NO
Vậy có tất cả 4 thí nghiệm thu được khí sau phản ứng
Este X hai chức, mạch hở, tạo bởi một ancol no với hai axit cacboxylic no, đơn chức. Este Y ba chức, mạch hở, tạo bởi glixerol với một axit cacboxylic không no, đơn chức (phân tử có hai liên kết π). Đốt cháy hoàn toàn m gam hỗn hợp E gồm X và Y cần vừa đủ 0,5 mol O2 thu được 0,45 mol CO2. Mặt khác, thủy phân hoàn toàn 0,16 mol E cần vừa đủ 210 ml dung dịch NaOH 2M, thu được hai ancol (có cùng số nguyên tử cacbon trong phân tử) và hỗn hợp ba muối, trong đó tổng khối lượng muối của hai axit no là (a) gam. Giá trị của (a) là
-
A.
10,68.
-
B.
20,60.
-
C.
12,36.
-
D.
13,20.
Đáp án : C
Tính được trong E : nX : nY = 3: 5
Trong m gam E chứa X ( 3e mol) và Y ( 5e mol).
X = C3H6(OH)2 + 2HCOOH +?CH2 – 2H2O
Y = C3H5(OH)3 + 3HCOOH + ?CH2 – 3H2O -3H2
Quy đổi m gam E thành:
C3H6(OH)2: 3e
C3H5(OH)3: 5e
HCOOH: 21e
CH2: u
H2: -15e
H2O: -21e
Bảo toàn O2, CO2 => e, u = ? (mol)
n muối no = 6e = ? (mol)
n muối không no = 15e = ? (mol)
Muối no và muối không no có tương ứng k và g nhóm CH2.
Bảo toàn số mol CH2 => mối quan hệ k, g
Biện luận tìm k, g. Từ đó tìm được muối no.
Trong 0,16 mol E chứa x mol X và y mol Y
nE = x + y = 0,16
nNaOH = 2x + 3y= 0,42
=> x = 0,06 và y = 0,1 (mol)
=> nX : nY = 3: 5
Trong m gam E chứa X ( 3e mol) và Y ( 5e mol).
X = C3H6(OH)2 + 2HCOOH +?CH2 – 2H2O
Y = C3H5(OH)3 + 3HCOOH + ?CH2 – 3H2O -3H2
Quy đổi m gam E thành:
C3H6(OH)2: 3e
C3H5(OH)3: 5e
HCOOH: 21e
CH2: u
H2: -15e
H2O: -21e
nO2 = 4.3e + 3,5.5e + 0,5.21e + 1,5u – 0,5.1,5e = 0,5
nCO2 = 3.3e + 3.5e + 21e + u = 0,45
=> e = 0,005 và u = 0,225
n muối no = 6e = 0,03 (mol)
n muối không no = 15e = 0,075 (mol)
Muối no và muối không no có tương ứng k và g nhóm CH2.
nCH2 = 0,03k + 0,075g = 0,225
=> 2k + 5g = 15
Do k > 1 và g ≥ 2 nên k = 2,5 và g = 2 là nghiệm duy nhất.
Vậy muối no gồm HCOONa: 0,03 (mol) ; CH2: 0,03k = 0,075 (mol)
=> m muối no = 3,09
Tỉ lệ: 8e mol E → 3,09 gam muối no
=> 0,16 mol E → a gam muối no
=> a = 12,36 (g)
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |










Danh sách bình luận