30 câu hỏi về bài tập Oxi - Ozon có lời giải
Làm đề thiCâu hỏi 1 :
Khi cho 20 lít khí oxi đi qua máy tạo ozon, có 9% thể tích oxi chuyển thành ozon. Hỏi thể tích khí bị giảm bao nhiêu lít? (các điều kiện khác không thay đổi)
- A 2 lít
- B 0,9 lít
- C 0,18 lít
- D 0,6 lít
Đáp án: D
Phương pháp giải:
PTHH: 3O2 → 2O3
=> VO2 phản ứng => VO3 => V giảm = V O2 phản ứng – VO3
Lời giải chi tiết:
PTHH: 3O2 → 2O3
=> VO2 phản ứng = 20.9/100 = 1,8 lít
=> VO3 = 2/3.VO2 phản ứng = 1,2 lít
=> V giảm = VO2 phản ứng – VO3 = 1,8 - 1,2 = 0,6 lít
Đáp án D
Câu hỏi 2 :
Cho nổ hỗn hợp gồm 2ml hiđro và 6ml oxi trong bình kín. Hỏi sau khi nổ, đưa bình về nhiệt độ phòng, nếu giữ nguyên áp suất ban đầu, trong bình còn khí nào với thể tích bằng bao nhiêu?
- A 4ml O2
- B 2ml O2
- C 1ml H2
- D 5ml O2
Đáp án: D
Phương pháp giải:
Tính theo PTHH: 2H2 + O2 2H2O
Lời giải chi tiết:
PTHH: 2H2 + O2 2H2O
Bđ: 2 6
Pư: 2 → 1 → 2
Sau: 0 5
=> VO2 dư = 5 ml
Đáp án D
Câu hỏi 3 :
Hai bình cầu có thể tích bằng nhau. Nạp oxi vào bình thứ nhất. Nạp oxi đã được ozon hóa vào bình thứ hai. Nhiệt độ và áp suất ở hai bình như nhau. Đặt hai bình trên hai đĩa cân thấy khối lượng của hai bình khác nhau 0,21 gam. Số gam ozon có trong bình oxi đã được ozon hóa là
- A 0,63
- B 0,65
- C 0,67
- D 0,69
Đáp án: A
Phương pháp giải:
Khối lượng 2 bình khác nhau chính là chênh lệch khối lượng giữa x mol O3 bình 2 và x mol O2 ở bình 1
Lời giải chi tiết:
Khối lượng 2 bình khác nhau chính là chênh lệch khối lượng giữa x mol O3 bình 2 và x mol O2 ở bình 1
=> 0,21 = 48x – 32x => x = 0,013125 mol => số gam O3 = 0,63g
Đáp án A
Câu hỏi 4 :
Sau khi ozon hoá một thể tích oxi thì thấy thể tích giảm đi 5,00ml. Tính thể tích ozon đã được tạo thành và thể tích của oxi đã tham gia phản ứng để tạo thành ozon? Biết các thể tích nói trên đều đo ở cùng điều kiện .
- A 10; 15
- B 15; 10
- C 5; 15
- D 15; 5
Đáp án: A
Phương pháp giải:
Tăng giảm thể tích (tương tự như tăng giảm số mol)
Lời giải chi tiết:
3O2 → 2O3
3 2 giảm 1 ml
x y 5 ml
=> x=15 ml; y=10ml
=> VO3=10ml; VO2=15ml
Đáp án A
Câu hỏi 5 :
Hỗn hợp khí A gồm O2 và O3, tỷ khối của hỗn hợp A đối với H2 là 19,2. Hỗn hợp khí B gồm H2 và CO, tỷ khối của hỗn hợp khí B đối với H2 là 3,6. Một mol hỗn hợp khí A có thể đốt cháy bao nhiêu mol khí B(ở cùng điều kiện)
- A 2
- B 1,2
- C 2,4
- D 1
Đáp án: C
Phương pháp giải:
Giả sử A có công thức trung bình là On
Từ tỉ khối của A suy ra n.
Ta có nA = 1 mol => nO
PT đốt cháy: CO + [O] CO2
Lời giải chi tiết:
MA = 38,4 => Giả sử A có công thức trung bình là On => 16n = 38,4 => n = 2,4
A có công thức trung bình là O2,4
Ta có nA = 1 mol => nO = 2,4 mol
PT đốt cháy: CO + [O] CO2
2,4 mol 2,4 mol
Đáp án C
Câu hỏi 6 :
Để thu được 6,72 lít O2 (đktc), cần phải nhiệt phân hoàn toàn bao nhiêu gam tinh thể KClO3.5H2O (khi có MnO2 xúc tác)?
- A 21,25 gam
- B 42,50 gam
- C 63,75 gam
- D 85,00 gam
Đáp án: B
Phương pháp giải:
Tính theo PTHH: KClO3 \(\xrightarrow{{{t^o}}}\) KCl + 1,5 O2
Lời giải chi tiết:
nO2 = 6,72 : 22,4 = 0,3(mol)
PTHH: KClO3 \(\xrightarrow{{{t^o}}}\) KCl + 1,5 O2
=> n KClO3 = 0,3 : 1,5 = 0,2(mol)
=> n KClO3.5H2O = n KClO3
=> m KClO3.5H2O = 0,2 . 212,5 = 42,5(g)
Đáp án B
Câu hỏi 7 :
Thêm 3,0 gam MnO2 vào 197 gam hỗn hợp muối KCl và KClO3. Trộn kĩ và đun nóng hỗn hợp đến phản ứng hoàn toàn, thu được chất rắn cân nặng 152 gam. Hãy xác định thành phần phần trăm khối lượng của hỗn hợp muối đã dùng.
- A %mKClO3= 62,18%; %mKCl = 37,82%.
- B %mKClO3= 37,82%; %mKCl = 61,18%.
- C %mKClO3= 45%; %mKCl = 55%.
- D %mKClO3= 60%; %mKCl = 40%.
Đáp án: A
Phương pháp giải:
Ta có khối lượng chất rắn giảm là khối lượng oxi thoát ra ngoài => lượng O2
PTHH: KClO3 \(\xrightarrow{{{t^o}}}\) KCl + 1,5 O2
=> nKClO3 = nO2 : 1,5
Lời giải chi tiết:
Ta có khối lượng chất rắn giảm là khối lượng oxi thoát ra ngoài
=> mO2 = 197 + 3 – 152 = 48(g)
=> nO2 = 48/32 = 1,5mol
PTHH: KClO3 \(\xrightarrow{{{t^o}}}\) KCl + 1,5 O2
=> nKClO3 = nO2 : 1,5 = 1mol
=>%mKClO3 = [(1 . 122,5) . 100%] : 197 = 62,18%
=>%KCl = 100% - 62,18% = 37,82%
Đáp án A
Câu hỏi 8 :
Cho 5,6 lít hỗn hợp khí X gồm Cl2 và O2 (ở đktc) tác dụng vừa hết với 7,5 gam hỗn hợp Y gồm Mg và Al tạo ra 21,35 gam hỗn hợp oxit và muối clorua của hai kim loại. Thành phần % khối lượng của Mg và Al Trong Y lần lượt là:
- A 66,67 % và 33,33 %
- B 33,33% và 66,67 %
- C 36 % và 64%
- D 64 % và 36%
Đáp án: D
Phương pháp giải:
BTKL: mCl2 + O2 = m oxit + muối - mKL
Đặt số mol O2 và Cl2 lần lượt là x, y
- Phương trình về số mol hỗn hợp => (1)
- Phương trình khối lượng hỗn hợp khí => (2)
Giải (1) và (2) tính được số mol mỗi khí
Đặt số mol của Mg và Al lần lượt là a, b
- Phương trình khối lượng => (3)
- Bảo toàn e => (4)
Giải (1) và (2) tính được a, b
Lời giải chi tiết:
Bảo toàn khối lượng: mX = mhh sau - mkim loại = 21,35 – 7,5 = 13,85 g
Gọi số mol Cl2 và O2 lần lượt là x, y ta có:
=> x + y = 0,25 (1)
=> 71x + 32y = 13,85 (2)
Từ (1) và (2) => x = 0,15 và y = 0,1
Gọi số mol Mg, Al lần lượt là a,b ta có:
24a + 27b = 7,5 (3)
Mà
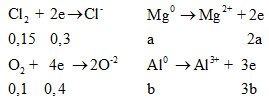
Ta có: ∑ne cho = ∑ne nhận
=> 2a + 3b = 0,7 mol (4)
Từ (3) và (4) => a = 0,2 và y = 0,1
=> % mMg = 4,8/7,5 = 64% => %mAl = 36 %
Đáp án D
Câu hỏi 9 :
Trong bình kín đựng O2 ở to và P1 (atm) , bật tia lửa điện, rồi đưa về to ban đầu thì áp suất là P2 (atm). Dẫn khí trong bình qua dung dịch KI dư thu được dung dịch X và 2,2848 lít khí (ở đktc). Dung dịch X phản ứng vừa đủ với 150ml dung dịch H2SO4 0,08M. Hiệu suất phản ứng ozon hóa và giá tị P2 so với P1 là
- A 80% và P2 = 0,9 P1
- B 16,667% và P2 = 0,944P1
- C 16,86% và P2 = 0,5 P1
- D Đáp án khác
Đáp án: B
Lời giải chi tiết:
nO2 dư = 0,102 mol
3O2 \(\overset {} \leftrightarrows \) 2O3 (1)
O3 + 2KI + H2O→ 2KOH + O2 + I2 (2)
2KOH + H2SO4 → K2SO4 + 2H2O
nKOH = 2 nH2SO4 = 0,024 mol
nO3 = nO2 sinh ra ở phản ứng (2) = 0,5.nKOH = 0,012 mol
=> nO2 phản ứng (1) = 0,018 mol
nO2 sinh ra ở phản ứng (2) + nO2 dư ở (1) = 0,102
=> nO2 dư ở (1) = 0,09 mol
=> nO2 ban đầu = 0,09 + 0,018 = 0,108 mol
=> H = 0,018/0,108 = 16,667 %
Ta có:
\(\frac{{{P_1}}}{{{P_2}}} = \frac{{{n_{{O_2}b{\rm{d}}}}}}{{{n_{{O_2}du}} + {n_{{O_3}}}}} = \frac{{0,108}}{{0,09 + 0,012}} = \frac{{18}}{{17}} \to {P_2} = 0,944{P_1}\)
Đáp án B
Câu hỏi 10 :
Nhiệt phân hoàn toàn 22,26 gam hỗn hợp X gồm KClO3; KMnO4 và KCl thu được 3,36 lít khí O2 (đktc) và hỗn hợp Y gồm KCl; K2MnO4; MnO2 trong đó KCl chiếm 51,203% về khối lượng. Hòa tan hết hỗn hợp Y cần dùng dung dịch HCl 32,85% (đun nóng) thu được dung dịch Z. Nồng độ phần trăm của KCl có trong dung dịch Z là
- A 17,51%.
- B 21,88%.
- C 26,26%.
- D 24,02%
Đáp án: C
Phương pháp giải:
Gọi số mol KClO3, KMnO4, KCl lần lượt là : x, y, z
(1) Phương trình về khối lượng hỗn hợp
(2) Phương trình về số mol O2 thu được
(3) Phương trình lượng KCl sau phản ứng nhiệt phân
Khi cho Y tác dụng với HCl ta có các phản ứng sau:
K2MnO4 + 8HClđặc → 2KCl + MnCl2 + 2Cl2 + 4H2O
MnO2 + 4HClđặc → MnCl2 + Cl2 + 2H2O
Lời giải chi tiết:
Bảo toàn khối lượng:
mX = mY + mO2 = > mY = 22,26 – 0,15.32 = 17,46 gam
=> mKCl = 17,46. 51,203:100 = 8,94 g => nKCl = 0,12 mol
Gọi số mol KClO3, KMnO4, KCl lần lượt là : x, y, z
=> Ta có hệ phương trình
\(\left\{ \begin{gathered}
{122,5x + 158y + 74,5z = 22,26} \hfill \\
{1,5x + 0,5y = 0,15} \hfill \\
{x + z = 0,12} \hfill \\
\end{gathered} \right.{ = > }\left\{ \begin{gathered}
{x = 0,08} \hfill \\
{y = 0,06} \hfill \\
{z = 0,04} \hfill \\
\end{gathered} \right.\)
=> nK2MnO4 = 0,03 mol; nMnO2 = 0,03 mol
K2MnO4 + 8HClđặc → 2KCl + MnCl2 + 2Cl2 + 4H2O
0,03 0,24 0,06 0,06
MnO2 + 4HClđặc → MnCl2 + Cl2 + 2H2O
0,03 0,12 0,03
=> ∑mKCl = 8,94 + 0,06.74,5 = 13,41 gam
=> ∑mCl2 = 0,09.71 = 6,39 g
=> ∑nHCl = 0,36 mol => mHCl = 13,14 gam => mdd HCl = 40 gam
=> mdd sau phản ứng = mY + mdd HCl – mCl2 = 17,46+40-6,39 = 51,07gam
=> C%KCl = 13,41/51,07.100= 26,26 %
Đáp án C
Câu hỏi 11 :
Cho 6,72 lít hỗn hợp gồm oxi và clo (đktc) phản ứng vừa đủ với hh rắn gồm 0,1 mol Mg và 0,2 mol Al. Tính % về khối lượng của oxi trong hh ban đầu
- A 33,33%
- B 66,67%
- C 18,4%
- D 81,8%
Đáp án: C
Phương pháp giải:
Gọi số mol Cl2 và O2 lần lượt là x , y
- Phương trình về số mol hỗn hợp khí ban đầu => (1)
- Bảo toàn electron => (2)
Lời giải chi tiết:
Gọi số mol Cl2 và O2 lần lượt là x , y
=> x + y = 0,3 mol (1)
Ta có:
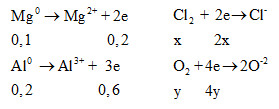
Bảo toàn e: ∑ne cho = ∑ne nhận
=> 2x+4y = 0,8 (2)
Từ (1) và (2) => x = 0,2 và y = 0,1
=> %mO2 = 0,1.32 : (0,1.32 + 0,2.71).100 = 18,4%
Đáp án C
Câu hỏi 12 :
Khi nhiệt phân hoàn toàn 100 gam mỗi chất sau: KClO3 (xúc tác MnO2), KMnO4, KNO3 và AgNO3. Chất tạo ra lượng O2 lớn nhất là
- A KMnO4.
- B KNO3.
- C KClO3
- D AgNO3.
Đáp án: C
Lời giải chi tiết:
KClO3 → KCl + 3/2O2
122,5.........................48 (g)
100............................39 (g)
2KMnO4 → O2 + K2MnO4+ MnO2
316.................32 (g)
100.................10 (g)
KNO3 → 1/2 O2 + KNO2
101................16 (g)
100...............15,84 (g)
AgNO3 → 1/2 O2 + Ag + NO2
170.....................16 (g)
100.....................9,4 (g)
Vậy KClO3 tạo ra lượng O2 max
Đáp án C
Câu hỏi 13 :
Hỗn hợp A gồm oxi và ozon có tỉ khối so với hiđro là 19,2. Hỗn hợp B gồm H2 và CO. Số mol hh A cần để đốt cháy hoàn toàn 1 mol hh B là
- A 2,08mol.
- B 0,417mol.
- C 2,40mol.
- D 1,25mol.
Đáp án: B
Phương pháp giải:
Quy hỗn hợp A là O
Sơ đồ phản ứng: H2 + O → H2O; CO + O → CO2
nO = nH2 + nCO = nB = ? => mA = ?
=> nA = mA/MA = ?
Lời giải chi tiết:
MA=19,2.2 = 38,4 g/mol
Quy hỗn hợp A là O
Sơ đồ phản ứng: H2 + O → H2O; CO + O → CO2
nO = nH2 + nCO = nB = 1 mol => mA = 16
=> nA = mA/MA = 16/38,4 = 0,417 mol.
Đáp án B
Câu hỏi 14 :
Cho 6 gam một kim loại R có hóa trị không đổi khi tác dụng với oxi tạo ra 10 gam oxit. Kim loại R là
- A Fe
- B Zn
- C Ca
- D Mg
Đáp án: D
Phương pháp giải:
Áp dụng định luật bảo toàn khối lượng
m O2 + m kim loại = m oxit
Áp dụng định luật bảo toàn e :
R0 → Rx+ + x e (với x là hóa trị của kim loại 1 ,2 hoặc 3)
O2 + 4 e → 2 O2-
ð n R . x = n O2 . 4
Lời giải chi tiết:
m O2 + m kim loại = m oxit
=> 6 + m O2 = 10
=> m O2 = 4 g
=> n O2 = 0,125 mol
BTe: n R . x = n O2 . 4
=> n R . x = 0,5
=> với x = 1 => n R = 0,5 mol => M R = 6 : 0,5 = 12 ( loại )
=> với x = 2 => n R = 0,25 mol => M R = 6 : 0,25 = 24 ( chọn Mg )
=> với x = 3 => n R = 0,5 / 3 mol => M R = 6 : 0,5 / 3 = 36 ( loại )
Kim loại là Mg
Câu hỏi 15 :
Cho V1 lít H2 tác dụng vừa đủ với V2 lít hỗn hợp khí O2, O3 có tỉ khối hơi so với H2 bằng 20 chỉ thu được sản phẩm duy nhất là nước. Biết các khí đo ở cùng điều kiện. Mối liên hệ giữa V1 và V2 là
- A V1 = V2.
- B V1 = 2,5V2.
- C V1 = 5V2.
- D V1 = 2V2.
Đáp án: B
Phương pháp giải:
Phương pháp đường chéo
Lời giải chi tiết:
M khí = 40
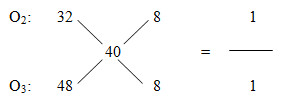
=> VO2 = VO3 = 0,5V2 (lít)
PTHH:
2H2 + O2 \(\xrightarrow{{{t}^{o}}}\) 2H2O
V2 ← 0,5V2
3H2 + O3 \(\xrightarrow{{{t}^{o}}}\) 3H2O
1,5V2 ← 0,5V2
=> VH2 = V2 + 1,5V2 = 2,5V2 hay V1 = 2,5V2
Đáp án B
Câu hỏi 16 :
Nhiệt phân 50,56 gam KMnO4 sau một thời gian thu được 46,72 gam chất rắn. Cho toàn bộ lượng khí sinh ra phản ứng hết với hỗn hợp X gồm Mg, Fe thu được hỗn hợp Y nặng 13,04 gam. Hòa tan hoàn toàn hỗn hợp Y trong dung dịch H2SO4 đặc nóng dư thu được 1,344 lít SO2 (đktc). % khối lượng Mg trong X là:
- A 28,15%.
- B 39,13%.
- C 52,17%.
- D 46,15%.
Đáp án: B
Phương pháp giải:
Bảo toàn nguyên tố, bảo toàn e, bảo toàn khối lượng
Lời giải chi tiết:
\(\begin{array}{*{20}{l}}
{BTKL:{\text{ }}{m_{{O_2}}} = {m_{KMn{O_4}}} - {m_{cran}} = 3,84{\text{ }}g{\text{ }} = > {\text{ }}{n_{{O_2}}} = 0,12{\text{ }}mol{\text{ }} = > {n_O} = 0,24{\text{ }}mol} \\
{{m_{Mg,Fe}} = {m_{oxit}} - {m_O} = 13,04 - 0,24.16 = 9,2{\text{ }}gam} \\
{Mg:{\text{ }}x{\text{ }}mol} \\
\begin{gathered}
Fe:{\text{ }}y{\text{ }}mol \hfill \\
= > \left\{ \begin{gathered}
24x + 56y = 9,2 \hfill \\
2x + 3y = 0,06.2 + 2.0,24(BT\,electron) \hfill \\
\end{gathered} \right. = > \left\{ \begin{gathered}
x = 0,15 \hfill \\
y = 0,1 \hfill \\
\end{gathered} \right. = > \% {m_{Mg}} = 39,13\% \hfill \\
\end{gathered}
\end{array}\)
Đáp án B
Câu hỏi 17 :
Tỉ khối của hỗn hợp X gồm oxi và ozon so với hiđro là 18. Phần trăm thể tích của oxi và ozon có trong hỗn hợp X lần lượt là:
- A 25% và 75%
- B 30% và 70%
- C 75% và 25%
- D 50% và 50%
Đáp án: C
Phương pháp giải:
Dùng phương pháp đường chéo.
Lời giải chi tiết:
MX = 18.2 = 36
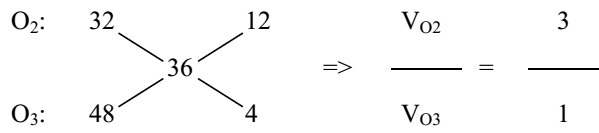
=> %VO2 = 3/(3 + 1) = 0,75 = 75%; %VO3 = 100 - 75 = 25%
Đáp án C
Câu hỏi 18 :
Oxi hóa hoàn toàn 9,1 gam hỗn hợp X gồm Cu và Al có tỉ lệ mol 1:1 thu được m gam hỗn hợp Y gồm các oxit. Giá trị của m là
- A 11,3.
- B 8,7
- C 13,1.
- D 10.
Đáp án: C
Phương pháp giải:
- Tìm số mol từng kim loại.
- Viết PTHH, tính số mol oxit theo số mol kim loại → m
Lời giải chi tiết:
Đặt: nCu = nAl = x(mol)
Ta có: 64x + 27x = 9,1 ⇒ x = 0,1 (mol)
2Cu + O2 \(\buildrel {{t^0}} \over\longrightarrow \) 2CuO
(mol) 0,1 → 0,1
4Al + 3O2 \(\buildrel {{t^0}} \over\longrightarrow \) 2Al2O3
(mol) 0,1 → 0,05
→ m = mCuO + mAl2O3 = 0,1.80 + 0,05.102 = 13,1 (gam)
Đáp án C
Câu hỏi 19 :
Đốt cháy hoàn toàn 12,8 gam một kim loại hóa trị II trong oxi dư đến khối lượng không đổi thu được 16 gam chất rắn X. Kim loại đó là
- A Zn.
- B Fe.
- C Cu.
- D Ca.
Đáp án: C
Phương pháp giải:
Nhận xét: nkim loại = noxit, tính số mol của kim loại và oxit theo M → tìm được M của kim loại
Lời giải chi tiết:
Gọi kim loại cần tìm là R
2R + O2 \(\buildrel {{t^o}} \over\longrightarrow \) 2RO
Theo PTHH ta có:
\(\begin{array}{l}{n_R} = {n_{RO}} \Leftrightarrow \frac{{12,8}}{{{M_R}}} = \frac{{16}}{{{M_R} + 16}}\\\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \Rightarrow 12,8{M_R} + 204,8 = 16{M_R}\\\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \Rightarrow 3,2{M_R} = 204,8\\\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \Rightarrow {M_R} = 64(Cu)\end{array}\)
Đáp án C
Câu hỏi 20 :
Hỗn hợp khí X gồm ozon và oxi ở điều kiện tiêu chuẩn có tỉ khối đối với hiđro bằng 20. Phần trăm theo thể tích O3 trong hỗn hợp X là
- A 40%.
- B 60%.
- C 75%.
- D 50%.
Đáp án: D
Phương pháp giải:
- Áp dụng sơ đồ đường chéo tìm tỉ lệ số mol O2 và O3 → Chọn số mol theo tỉ lệ đó → Tính toán theo số mol đã chọn.
- Ta có: %V = %n
Lời giải chi tiết:
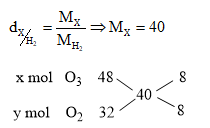
\( \Rightarrow \frac{x}{y} = \frac{8}{8} = \frac{1}{1} \Rightarrow \% {V_{{O_3}}} = \frac{1}{2}.100\% = 50\% \)
Đáp án D
Câu hỏi 21 :
Hỗn hợp X gồm O2 và O3 có tỉ khối so với H2 bằng 18. Đốt cháy hoàn toàn 4,48 lít khí C2H4 cần V lít hỗn hợp khí X. Các khí đo ở điều kiện tiêu chuẩn. Giá trị của V là
- A 35,84.
- B 11,95.
- C 15,91.
- D 22,4.
Đáp án: B
Phương pháp giải:
- Tìm tỉ lệ số mol giữa O2 và O3 dựa vào phương pháp đường chéo
- Áp dụng BTNT Oxi để tìm số mol từng khí → V
Lời giải chi tiết:
\({d_{X/{H_2}}} = {{{M_X}} \over {{M_{{H_2}}}}} \Rightarrow {M_X} = 18.2 = 36\;(g/mol)\)
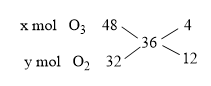
\( \Rightarrow {x \over y} = {4 \over {12}} = {1 \over 3}{\rm{ }} \Rightarrow {\rm{3x = y }}(1)\)
C2H4 \(\buildrel {{t^0}} \over\longrightarrow \) 2CO2 + 2H2O
0,2 0,4 0,4
BTNT O: nO trước = \(2{n_{{O_2}}} + 3{n_{{O_3}}}\)= 2y + 3x
nO sau = \(2{n_{C{O_2}}} + {n_{{H_2}O}}\)= 2.0,4 + 0,4 = 1,2
→ 3x + 2y = 1,2 (2)
Giải (1) và (2) ta được: \(x = {2 \over {15}};y = {2 \over 5} \Rightarrow {V_X}_{(dktc)} = ({2 \over {15}} + {2 \over 5}).22,4 \approx 11,95(l)\)
Đáp án B
Câu hỏi 22 :
Cho V lít hỗn hợp khí X gồm O2 và O3. Sau một thời gian ozon bị phân hủy hết, thu được chất khí duy nhất Y và thể tích khí tăng lên 5% so với thể tích ban đầu, biết thể tích các khí đo ở cùng điều kiện nhiệt độ và áp suất. Phần trăm thể tích của O3 trong hỗn hợp ban đầu là
- A 10%.
- B 5%.
- C 20%.
- D 15%.
Đáp án: A
Phương pháp giải:
- Chọn nX = 1mol và số mol của O3 là x (mol)
- Áp dụng tăng-giảm thể tích trong hỗn hợp kín.
- Thể tích tăng = thể tích O2 sinh ra – thể tích O3 mất đi → tìm x
Lời giải chi tiết:
Chọn hh X ban đầu = 1 (mol); Đặt số mol O3 phân hủy = x (mol)
Cùng điều kiện về nhiệt độ và áp suất thì tỉ lệ thể tích tương ứng với tỉ lệ về số mol
nkhí tăng = 5%nX = 0,05.1 = 0,05 (mol)
\(2{O_3} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 3{O_2}\)
(mol) x 1,5x
⇒ V tăng = VO2 sinh ra – VO3 mất đi = 1,5x – x = 0,5x (mol)
→ 0,5x = 0,05
→ x = 0,1
→\(\% {V_{{O_3}}} = \frac{{{n_{{O_3}}}\,}}{{{n_{hh}}}}.100\% = \frac{{0,1}}{1}.100\% = 10\% \)
Đáp án A
Câu hỏi 23 :
Để điều chế oxi, người ta nung hoàn toàn 36,75 g KClO3 (xúc tác MnO2) thì thu được bao nhiêu lít O2 (đktc) ?
- A 10,08 lít
- B 6,72 lít
- C 22,4 lít
- D 11,05 lít
Đáp án: A
Phương pháp giải:
Tính số mol KClO3, và tính theo PTHH
Lời giải chi tiết:
2KClO3 \(\buildrel {{t^o}} \over\longrightarrow \) 2KCl + 3O2
(mol) 0,3 → 0,45
⇒ Voxi = 0,45.22,4=10,08 lít
Đáp án A
Câu hỏi 24 :
Cho 15,68 lít hỗn hợp khí X (đktc) gồm Cl2 và O2 phản ứng vừa đủ với 22,2 gam hỗn hợp Y gồm Mg và Al, thu được 60,2 gam hỗn hợp Z. Phần trăm khối lượng của Al trong Y là:
- A 75,68%
- B 24,32%
- C 51,35%
- D 48,65%
Đáp án: B
Phương pháp giải:
Dùng định luật bảo toàn electron và bảo toàn khối lượng để tìm số mol Al trong Y, từ đó tìm được %mAl.
Lời giải chi tiết:
Theo bảo toàn khối lượng ta có mX = mZ - mY = 60,2 - 22,2 = 37,8 (gam)
Đặt số mol Cl2 là x mol; số mol O2 là y mol.
Ta có: x + y = nX = 0,7 mol và mX = 71x + 32y = 38 gam
Giải hệ trên ta có x = 0,4 và y = 0,3
Gọi số mol Mg là a mol; số mol Al là b mol → 24a + 27b = 22,2 (1)
Các quá trình cho e:
Mg0 → Mg+2 + 2e
Al0 → Al+3 + 3e
Các quá trình nhận e:
Cl2 + 2e → 2Cl-
O2 + 4e → 2O-2
Theo bảo toàn electron ta có 2.nMg + 3.nAl = 2.nCl2 + 4.nO2 → 2a + 3b = 2. 0,4 + 4.0,3 = 2 (mol) (2)
Giải hệ (1) và (2) ta có a = 0,7 và b = 0,2
Phần trăm khối lượng của Al trong Y là: %mAl =0,2.27.100%/22,2 = 24,32%
Đáp án B
Câu hỏi 25 :
Trong phòng thí nghiệm điều chế oxi bằng phản ứng nhiệt phân KClO3. Nếu dùng 12,25 gam KClO3 thì sau phản ứng hoàn toàn, thể tích O2 thu được (đktc) là
- A
6,72 lít.
- B
3,36 ml.
- C
672 ml.
- D
3,36 lít.
Đáp án: D
Phương pháp giải:
Tính theo PTHH: 2KClO3 \(\xrightarrow{{{t^0}}}\) 2KCl + 3O2
Lời giải chi tiết:
Ta có: nKClO3 = 12,25 : 122,5 = 0,1 mol
PTHH: 2KClO3 \(\xrightarrow{{{t^0}}}\) 2KCl + 3O2
Theo PTHH → nO2 = 1,5.nKClO3 = 0,15 mol
→ VO2 = 0,15.22,4 = 3,36 lít
Đáp án D
Câu hỏi 26 :
Hỗn hợp O2 và O3 có tỉ khối đồi với H2 bằng 20. Phần trăm số mol O2 và O3 lần lượt là (cho biết H = 1; O = 16)
- A 40 và 60
- B 75 và 25
- C 60 và 40
- D 50 và 50
Đáp án: D
Phương pháp giải:
Sử dụng phương pháp đường chéo hoặc công thức trung bình.
Lời giải chi tiết:
Mhh = 20. MH2 = 20.2 = 40 (g/mol)
Đặt số mol O2 = a(mol) ; số mol O3 = b (mol)
Áp dụng công thức tính phân tử khối trung bình ta có:
\(\begin{array}{l}{M_{hh}} = \frac{{{n_{{O_2}}}.{M_{{O_2}}} + {n_{{O_2}}}.{M_{{O_3}}}}}{{{n_{{O_2}}} + {n_{{O_3}}}}}\\ \Rightarrow 40 = \frac{{32a + 48b}}{{a + b}}\\ \Rightarrow 40a + 40b = 32a + 48b\\ \Rightarrow 8a = 8b\\ \Rightarrow a = b\end{array}\)
Vậy trong hh có nO2 = nO3 → Phần trăm số mol O2 = O3 = 50%
Đáp án D
Câu hỏi 27 :
Phóng điện qua O2 được hỗn hợp khí X có khối lượng mol trung bình là 40 g/mol. Hiệu suất của phản ứng ozon hóa là
- A 30%.
- B 80%.
- C 60%.
- D 20%.
Đáp án: C
Phương pháp giải:
- Chọn số mol O2 ban đầu là 1 mol, số mol O2 phản ứng là 3a mol
- Bảo toàn khối lượng: mO2 ban đầu = mX → tìmđược nX → tìm được a → tính được hiệu suất
Lời giải chi tiết:
Chọn số mol O2 ban đầu là 1 mol → mO2 bđ = 32 (g)
Đặt số mol O2 pư = 3a (mol)
\(3{O_2} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2{O_3}\)
nbđ 1 (mol)
npư 3a → 2a (mol)
nsau 1 – 3a 2a (mol)
BTKL ta có: mX = mO2bđ = 32 (g) ⇒ \({n_X} = \frac{{32}}{{40}} = 0,8(mol)\)
∑ nX = nO2 dư + nO3 = 1 – 3a + 2a
= 1 – a (mol)
→ 1 –a = 0,8
→ a = 0,2 (mol)
Hiệu suất của phản ứng là: \(\% H = \frac{{{n_{{O_2}pu}}}}{{{n_{{O_2}\,bd}}}}.100\% = \frac{{0,2.3}}{1}.100\% = 60\% \)
Đáp án C
Câu hỏi 28 :
Đốt cháy hoàn toàn 9,4 gam hỗn hợp ancol etylic C2H5OH và ancol metylic CH3OH (tỉ lệ số mol lần lượt là 2: 3) cần dùng bao nhiêu lít khí oxi ở đktc. Biết sản phẩm sau phản ứng thu được chỉ gồm CO2 và H2O?
- A 8,96 lít.
- B 16,80 lít.
- C 13,44 lít.
- D 11,76 lít.
Đáp án: D
Phương pháp giải:
Đặt số mol C2H5OH = 2x (mol) ⟹ số mol CH3OH = 3x (mol).
Dựa vào dữ kiện 9,4gam tìm được x =? Từ đó tính được số mol mỗi chất.
Viết PT cháy của mỗi chất, đặt số mol O2 theo số mol C2H5OH và CH3OH.
Lời giải chi tiết:
Đặt số mol C2H5OH = 2x (mol) ⟹ số mol CH3OH = 3x (mol)
Có: mC2H5OH + mCH3OH = 9,4
⟹ 2x.46 + 3x.32 = 9,4
⟹ 188x = 9,4
⟹ x = 0,05
⟹ C2H5OH: 0,1 (mol); CH3OH: 0,15 (mol)
Xét đốt cháy:
C2H6O + 3O2 \(\xrightarrow{{{t^0}}}\) 2CO2 + 3H2O (1)
0,1 → 0,3 (mol)
CH4O + 3/2O2 \(\xrightarrow{{{t^0}}}\) CO2 + 2H2O (2)
0,15 → 0,225 (mol)
∑nO2(1)+(2) = 0,3 + 0,225 = 0,525 (mol) ⟹ VO2(đktc) = 0,525×22,4 = 11,76 (lít)
Đáp án D
Câu hỏi 29 :
Đốt cháy hoàn toàn 13 gam bột một kim loại hóa trị II trong oxi dư, thu được chất rắn X có khối lượng 16,2 gam. Kim loại đó là
- A Zn.
- B Ca.
- C Cu.
- D Mg.
Đáp án: A
Phương pháp giải:
Sử dụng bảo toàn khối lượng tính được mO2 ⟹ nO2 = ?
Từ đó tính được nA và tìm được MA dựa theo PTHH: 2A + O2 \(\xrightarrow{{{t^0}}}\) 2AO
Lời giải chi tiết:
Đặt kim loại hóa trị II là A
PTHH: 2A + O2 \(\xrightarrow{{{t^0}}}\) 2AO
BTKL ta có: mO2 = mAO – mA = 16,2 – 13 = 3,2 (g)\( \Rightarrow {n_{{O_2}}} = \frac{{{m_{{O_2}}}}}{{{M_{{O_2}}}}} = \frac{{3,2}}{{32}} = 0,1\,(mol)\)
Theo PTHH: nA = 2nO2 = 2.0,1 = 0,2 (mol)
Ta có: \({M_A} = \frac{{{m_A}}}{{{n_A}}} = \frac{{13}}{{0,2}} = 65\,(g/mol)\)
⟹ A là kẽm (Zn)
Đáp án A
Câu hỏi 30 :
Đốt cháy a gam cacbon trong oxi thu được 4,48 lít khí CO2 duy nhất. Xác định giá trị của a cần dùng ?
- A 2,4 g
- B 2,5 g
- C 2,6 g
- D 2,7 g
Đáp án: A
Phương pháp giải:
Viết và tính theo PTHH: C + O2 \(\buildrel {{t^o}} \over\longrightarrow \) CO2
Lời giải chi tiết:
C + O2 \(\buildrel {{t^o}} \over\longrightarrow \) CO2
(mol) 0,2 ← 0,2
⇒ mC = 0,2.12 = 2,4 (g)
Đáp án A
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải









