30 câu hỏi luyện tập về tính chất của lưu huỳnh có lời giải
Làm đề thiCâu hỏi 1 :
Câu nào sau đây diễn tả đúng tính chất hóa học của lưu huỳnh?
- A
Lưu huỳnh có cả tính oxi hóa và tính khử.
- B
Lưu huỳnh không có tính oxi hóa và cả tính khử.
- C
Lưu huỳnh chỉ có tính khử
- D Lưu huỳnh chỉ có tính oxi hóa
Đáp án: A
Lời giải chi tiết:
A
S + H2 → H2S ( S0 → S-2 thể hiện tính oxy hóa )
S + O2 → SO2 ( S0 → S+4 thể hiện tính khử )
Câu hỏi 2 :
Cho phản ứng giữa lưu huỳnh với hidro như hình vẽ sau, trong đó ống nghiệm 1 để tạo ra H2, ống nghiệm thứ 2 dùng để nhận biết sản phẩm trong ống. Hãy cho biết hiện tượng quan sát được trong ống nghiệm 2 là:
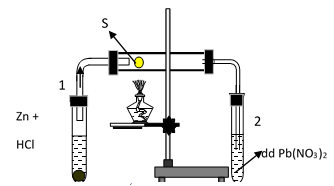
- A Dung dịch chuyển sang màu vàng do S tan vào nước.
- B Có kết tủa trắng của PbS
- C Có kết tủa đen của PbS
- D Có cả kết tủa trắng và dung dịch vàng xuất hiện.
Đáp án: C
Lời giải chi tiết:
Các phản ứng xảy ra :
Zn + 2HCl -> ZnCl2 + H2
H2 + S -> H2S
H2S + Pb(NO3)2 -> PbS↓ (đen) + 2HNO3
Đáp án C
Câu hỏi 3 :
Hơi thủy ngân rất độc, do đó phải thu hồi thủy ngân rơi vãi bằng cách
- A
Nhỏ nước brom lên giọt thủy ngân
- B
rắc bột lưu huỳnh lên giọt thủy ngân
- C Nhỏ nước ozon lên giọt thủy ngân
- D rắc bột photpho lên giọt thủy ngân
Đáp án: B
Lời giải chi tiết:
B
Hg + S → HgS ( không bay hơi )
Câu hỏi 4 :
Các ion đơn nguyên tử: X+ và Y2- có cấu hình eletron là [Ar]. Nhận định nào sau đây là sai?
- A Bán kính của X+ nhỏ hơn bán kính của Y2-.
- B Hợp chất chứa X đều tan tốt trong nước.
- C Trong hợp chất, Y chỉ có một mức hóa trị duy nhất là -2.
- D Số hiệu nguyên tử của X lớn hơn Y.
Đáp án: C
Lời giải chi tiết:
X nhường 1e để đạt được cấu hình của [Ar] => X là K+
Y nhận 2e để đạt được cấu hình của [Ar] => Y là S2-
=> Số hiệu của X lớn hơn Y
A. Đ vì anion và cation có cùng cấu hình e thì bán kính của cation nhỏ hơn bán kính của anion
B. Đ
C. Sai vì S có các số oxi hóa -2, 0, +4, +6
D. Đ
Đáp án C
Câu hỏi 5 :
Lưu huỳnh là một phi kim phổ biến, không mùi, không vị, nhiều hóa trị. Lưu huỳnh, trong dạng gốc của nó là chất rắn kết tinh màu vàng chanh. Trong tự nhiên, nó có thể tìm thấy ở dạng đơn chất hay trong các khoáng chất sulfua và sulfat. Nó là một nguyên tố thiết yếu cho sự sống và được tìm thấy trong hai axít amin. Sử dụng thương mại của nó chủ yếu trong các phân bón nhưng cũng được dùng rộng rãi trong thuốc súng, diêm, thuốc trừ sâu và thuốc diệt nấm. Trong phản ứng hóa học, 1 nguyên tử lưu huỳnh (S) chuyển thành ion sunfua (S2–) bằng cách :
- A nhường đi hai electron.
- B nhận thêm hai electron.
- C nhường đi một electron.
- D nhận thêm một electron.
Đáp án: B
Lời giải chi tiết:
\(\mathop S\limits^0 + 2e \to \mathop S\limits^{ - 2} \)
Đáp án B
Câu hỏi 6 :
Thủy ngân rất độc, dễ bay hơi. Khi nhiệt kế thủy ngân bị vỡ thì dùng chất nào trong các chất sau để khử độc thủy ngân?
- A Bột lưu huỳnh.
- B Nước.
- C Bột sắt.
- D Bột than.
Đáp án: A
Phương pháp giải:
Chọn chất mà thủy ngân phản ứng được ở nhiệt độ thường
Lời giải chi tiết:
Thủy ngân phản ứng được với lưu huỳnh ở nhiệt độ thường tạo thành muối thủy ngân sunfua (không độc)
Hg + S → HgS
Đáp án A
Câu hỏi 7 :
Ở điều kiện thường, kim loại nào sau đây phản ứng với bột lưu huỳnh?
- A Fe.
- B Hg.
- C Cr.
- D Cu.
Đáp án: B
Phương pháp giải:
Dựa vào tính chất hóa học của lưu huỳnh trong sgk hóa 10
Lời giải chi tiết:
Hg là kim loại duy nhất phản ứng với S ở nhiệt độ thường
Hg + S → HgS
Đáp án B
Câu hỏi 8 :
Lưu huỳnh có bao nhiêu dạng thù hình?
- A 2
- B 5
- C 3
- D 4
Đáp án: A
Phương pháp giải:
Dựa vào các dạng thù hình của lưu huỳnh.
Lời giải chi tiết:
Lưu huỳnh có 2 dạng thù hình là lưu huỳnh tà phương và lưu huỳnh đơn tà.
Đáp án A
Câu hỏi 9 :
Dãy gồm các chất đều tác dụng với lưu huỳnh (trong điều kiện phản ứng thích hợp) là:
- A Zn, H2, O2, F2.
- B H2, Pt, Cl2, KClO3.
- C Hg, O2, F2, HCl.
- D Na, He, Br2, H2SO4 loãng.
Đáp án: A
Phương pháp giải:
Dựa vào tính chất hóa học của lưu huỳnh để trả lời.
Lời giải chi tiết:
- Dãy B: S không tác dụng với Pt.
- Dãy C: S không tác dụng với HCl
- Dãy D: S không tác dụng với He, H2SO4 loãng.
Lưu huỳnh tác dụng với dãy chất: Zn, H2, O2, F2.
\(\begin{gathered}
S + Zn\xrightarrow{{{t^0}}}ZnS \hfill \\
{H_2} + S\xrightarrow{{{t^0}}}{H_2}S \hfill \\
{O_2} + S\xrightarrow{{{t^0}}}S{O_2} \hfill \\
3{F_2} + S\xrightarrow{{{t^0}}}S{F_6} \hfill \\
\end{gathered} \)
Đáp án A
Câu hỏi 10 :
Câu nào sau đây diễn tả đúng tính chất hóa học của lưu huỳnh?
- A Lưu huỳnh chỉ có tính khử.
- B Lưu huỳnh không có tính oxi hóa không có tính khử.
- C Lưu huỳnh chỉ có tính oxi hóa.
- D Lưu huỳnh vừa có tính oxi hóa, vừa có tính khử.
Đáp án: D
Phương pháp giải:
Dựa vào trạng thái số oxi hóa của lưu huỳnh để dự đoán tính chất hóa học của lưu huỳnh.
Lời giải chi tiết:
Lưu huỳnh có các số oxi hóa -2, 0, +4, +6.
Ở trạng thái đơn chất, lưu huỳnh có số oxi hóa 0 là số oxi hóa trung gian nên lưu huỳnh vừa có tính oxi hóa, vừa có tính khử.
Đáp án D
Câu hỏi 11 :
Các số oxi hóa của lưu huỳnh:
- A -2, 0, + 4, +6
- B -4, 0, +2, +4
- C -3, 0, +3, +5
- D -3, 0, +1 đến +5
Đáp án: A
Lời giải chi tiết:
Các số oxi hóa của lưu huỳnh:-2, 0, + 4, +6
Đáp án A
Câu hỏi 12 :
Dựa vào số oxi hóa của lưu huỳnh kết luận nào sau đây là đúng về tính chất hóa học cơ bản của S đơn chất:
- A Vừa có tính oxi hóa vừa có tính khử
- B Có tính oxi hóa
- C Có tính khử
- D Không có tính khử và tính oxi hóa
Đáp án: A
Phương pháp giải:
Dựa vào số oxi hóa của lưu huỳnh để suy ra tính chất hóa học cơ bản của lưu huỳnh đơn chất.
Lời giải chi tiết:
Nguyên tố S có các số oxi hóa thường gặp là -2; 0; +4 và +6.
Ở trạng thái đơn chất, S có số oxi hóa trung gian là 0 vừa có thể tăng vừa có thể giảm. Do đó lưu huỳnh đơn chất vừa có tính oxi hóa vừa có tính khử.
Đáp án A
Câu hỏi 13 :
Người ta thường sử dụng chất nào dưới đây để thu gom thuỷ ngân rơi vãi?
- A Bột sắt.
- B Khí oxi.
- C Khí ozon.
- D Bột lưu huỳnh.
Đáp án: D
Phương pháp giải:
Dựa vào tính chất hóa học của các chất trên để lựa chọn chất có thể tác dụng với thủy ngân ngay ở điều kiện thường tạo thành chất ít độc hơn và dễ di chuyển.
Lời giải chi tiết:
Người ta thường sử dụng bột lưu huỳnh để thu gom thuỷ ngân rơi vãi vì:
Hg + S → HgS, phản ứng này xảy ra ngay tại điều kiện thường, tạo thành HgS trạng thái rắn dễ dàng thu dọn.
Đáp án D
Câu hỏi 14 :
Đốt 4 mol lưu huỳnh phản ứng hoàn toàn với 2 mol oxi. Tính khối lượng SO2 tạo thành?
Phương pháp giải:
Viết phương trình, xác định chất hết, chất dư. Tính khối lượng SO2 tạo thành.
Lời giải chi tiết:
S + O2 \(\xrightarrow{{{t^0}}}\) SO2
4 2 mol (So sánh: 4/1 > 2/1 => O2 hết, S dư)
Ta có: nSO2 = nO2 = 2 mol suy ra mSO2 = 2.64 = 128 gam
Câu hỏi 15 :
Chọn câu trả lời sai về lưu huỳnh?
- A Lưu huỳnh là chất rắn màu vàng.
- B Lưu huỳnh có 2 dạng thù hình.
- C Lưu huỳnh có 6e ở lớp ngoài cùng.
- D Lưu huỳnh chỉ có tính oxi hóa.
Đáp án: D
Phương pháp giải:
Dựa vào tính chất vật lí và tính chất hóa học của S để trả lời.
Lời giải chi tiết:
A đúng
B đúng, đó là lưu huỳnh tà phương và lưu huỳnh đơn tà
C đúng
D sai vì ở dạng đơn chất S có số oxi hóa 0 là số oxi hóa trung gian nên S vừa có tính oxi hóa và tính khử
Đáp án D
Câu hỏi 16 :
Ở nhiệt độ thường, kim loại nào sau đây phản ứng với bột lưu huỳnh:
- A Zn
- B Fe
- C Hg
- D Cu
Đáp án: C
Lời giải chi tiết:
Ở điều kiện thường: Hg + S → HgS↓
Đáp án C
Câu hỏi 17 :
Nguyên tử S (Z = 16) có cấu hình electron là
- A 1s22s22p63s13p5.
- B 1s22s22p63s23p4.
- C 1s22s22p63s13p33d1.
- D 1s22s22p63s13p33d2.
Đáp án: B
Phương pháp giải:
Viết cấu hình electron nguyên tử theo các phân mức năng lượng tăng dần
Lời giải chi tiết:
S (Z = 16): 1s22s22p63s23p4.
Đáp án B
Câu hỏi 18 :
Lưu huỳnh tác dụng với dung dịch kiềm nóng theo phản ứng sau:
3S + 6KOH → 2K2S + K2SO3 + 3H2O
Trong phản ứng này có tỉ lệ số nguyên tử lưu huỳnh bị oxi hóa : số nguyên tử lưu huỳnh bị khử là:
- A 2 : 1.
- B 1 : 2.
- C 1 : 3.
- D 2 : 3.
Đáp án: B
Phương pháp giải:
- Viết quá trình trao đổi electron để xác định tỉ lệ
- Số nguyên tử lưu huỳnh bị oxi hóa : số nguyên tử lưu huỳnh bị khử = Số nguyên tử S là chất khử : Số nguyên tử lưu huỳnh là chất oxi hóa
Lời giải chi tiết:
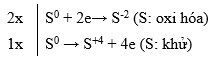
Đáp án B
Câu hỏi 19 :
Anion X2- phân mức năng lượng cao nhất là 3p chứa 6 electron. Nguyên tố X là
- A Ne.
- B Cl.
- C O.
- D S.
Đáp án: D
Phương pháp giải:
- Viết cấu hình electron của ion, từ đó viết cấu hình electron của nguyên tử và xác định được nguyên tố.
Lời giải chi tiết:
X2- : 1s22s22p63s23p6 → X : 1s22s22p63s23p4 → X : S
Đáp án D
Câu hỏi 20 :
Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50%, thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối so với H2 bằng 5. Tỉ lệ a : b bằng
- A 2 : 1
- B 1 : 1
- C 3 : 1
- D 3 : 2
Đáp án: A
Phương pháp giải:
Áp dụng phương pháp đường chéo cho hỗn hợp khí Z tính được nH2 : nH2S = 3 : 1
Ta luôn có nFe = nH2S + nH2; nH2S = nS pứ = nFe pứ
Biện luận để xác định hiệu suất phản ứng tính theo S hay theo Fe.
Từ đó tính được số mol S ban đầu và tỉ lệ a : b.
Lời giải chi tiết:
- Nung nóng hỗn hợp bột X gồm Fe và S (phản ứng có hiệu suất) thu được hỗn hợp Y:
Fe + S → FeS (1)
⟹ Hỗn hợp Y chứa FeS, Fe dư, S dư
- Cho hỗn hợp Y tác dụng với HCl dư thu được hỗn hợp khí Z:
FeS + 2HCl → FeCl2 + H2S ↑ (2)
Fe + 2HCl → FeCl2 + H2 ↑ (3)
⟹ Hỗn hợp khí Z chứa H2 và H2S
Áp dụng phương pháp đường chéo cho hỗn hợp khí Z (MZ = 5.2 = 10):
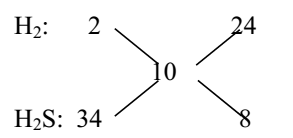
⟹ nH2 : nH2S = 24 : 8 = 3 : 1
Giả sử H2S là 1 mol thì số mol H2 là 3 mol
Theo (1) (2) ⟹ nFe pư = nFeS = nH2S = 1 mol
Theo (3) ⟹ nFe dư = nH2 = 3 mol
⟹ nFe ban đầu = nFe pư + nFe dư = 3 + 1 = 4 mol
Vì H = 50% > nFe pu/nFe = 0,25 nên hiệu suất phản ứng tính theo nguyên tố S.
Ta có: nS pư = nFeS = 1 mol ⟹ nS ban đầu = 1.(100%/H%) = 2 mol.
Vậy a : b = 4 : 2 = 2 : 1.
Đáp án A
Câu hỏi 21 :
Phát biểu nào sau đây là sai khi nói về lưu huỳnh ?
- A
Chất rắn, màu vàng.
- B
Không tan trong các dung môi hữu cơ.
- C
Không tan trong nước.
- D
Dẫn điện, dẫn nhiệt kém.
Đáp án: B
Phương pháp giải:
Dựa vào tính chất vật lí của lưu huỳnh.
Lời giải chi tiết:
Lưu huỳnh là chất rắn, màu vàng, không tan trong nước, tan trong các dung môi hữu cơ, dẫn điện, dẫn nhiệt kém.
Vậy phát biểu sai là không tan trong các dung môi hữu cơ.
Đáp án B
Câu hỏi 22 :
Lưu huỳnh là chất khử trong phản ứng nào sau đây ?
- A
S + O2 \(\xrightarrow{{{t^0}}}\) SO2.
- B
S + 2Na \(\xrightarrow{{{t^0}}}\) Na2S.
- C
S+ H2 \(\xrightarrow{{{t^0}}}\) H2S.
- D
S + Mg \(\xrightarrow{{{t^0}}}\) MgS.
Đáp án: A
Phương pháp giải:
Chất khử là chất nhường electron nên có số oxi hóa tăng sau phản ứng.
Chất oxi hóa là chất nhận electron nên có số oxi hóa giảm sau phản ứng.
Lời giải chi tiết:
Xác định số oxi hóa của S trước và sau phản ứng:
\(A.{\text{ }}\mathop S\limits^0 {\text{ }} + {\text{ }}{\mathop O\limits^0 _2}\xrightarrow{{{t^0}}}\mathop S\limits^{ + 4} {\mathop O\limits^{ - 2} _2}\)
\(B.{\text{ }}\mathop S\limits^0 {\text{ }} + {\text{ }}2\mathop {Na}\limits^0 \xrightarrow{{{t^0}}}{\mathop {Na}\limits^{ + 1} _2}\mathop S\limits^{ - 2} \)
\(C.{\text{ }}\mathop S\limits^0 + {\text{ }}{\mathop H\limits^0 _2}\xrightarrow{{{t^0}}}{\mathop H\limits^{ + 1} _2}\mathop S\limits^{ - 2} \)
\(D.{\text{ }}\mathop S\limits^0 {\text{ }} + {\text{ }}\mathop {Mg}\limits^0 \;\xrightarrow{{{t^0}}}\mathop {Mg}\limits^{ + 2} \mathop S\limits^{ - 2} \)
Ta thấy ở phản ứng A, số oxi hóa của S tăng từ 0 lên +4 nên lưu huỳnh là chất khử.
Đáp án A
Câu hỏi 23 :
Đốt cháy hoàn toàn 8 gam lưu huỳnh trong bình chứa khí oxi dư thu được V lít khí sunfurơ (đktc). Giá trị của V là
- A 3,36.
- B 5,6.
- C 2,24.
- D 11,2.
Đáp án: B
Phương pháp giải:
Tính theo PTHH: S + O2 \(\xrightarrow{{{t^0}}}\) SO2
Lời giải chi tiết:
PTHH: S + O2 \(\xrightarrow{{{t^0}}}\) SO2
Theo PTHH: nSO2 = nS = 8 : 32 = 0,25 mol
Vậy V = VSO2 = 0,25.22,4 = 5,6 lít
Đáp án B
Câu hỏi 24 :
Nung 28 gam Fe với 16 gam S ở nhiệt độ cao trong điều kiện không có không khí, thu được hỗn hợp chất rắn X. Cho X vào dung dịch HCl dư thu được hỗn hợp khí Y. Tỉ khối của Y đối với H2 là 10,6. Hiệu suất của phản ứng giữa Fe với S là
- A 70%.
- B 50%.
- C 60%.
- D 80%.
Đáp án: C
Phương pháp giải:
Ta có: nFe = 0,5 mol và nS = 0,5 mol
Fe + S → FeS (1)
Do nFe = nS nên hiệu suất phản ứng tính theo S hoặc Fe.
Hỗn hợp rắn X có FeS, S dư và Fe dư.
Cho X tác dụng với dung dịch HCl:
FeS + 2HCl → FeCl2 + H2S (2)
Fedư + 2HCl → FeCl2 + H2 (3)
Hỗn hợp khí Y có chứa a mol H2S và b mol H2.
Từ MY tìm mối quan hệ giữa a và b
Theo PTHH (2) ta có: nFeS = nH2S
Theo PTHH (1) ta có: nFe phản ứng = nFeS
Hiệu suất phản ứng là \(H = \frac{{{n_{Fe(pu)}}}}{{{n_{Fe(bandau)}}}}.100\% \)
Lời giải chi tiết:
Ta có: nFe = \(\frac{{28}}{{56}}\) = 0,5 mol và nS = \(\frac{{16}}{{32}}\) = 0,5 mol
Fe + S → FeS (1)
Do nFe = nS nên hiệu suất phản ứng tính theo S hoặc Fe.
Hỗn hợp rắn X có FeS, S dư và Fe dư.
Cho X tác dụng với dung dịch HCl:
FeS + 2HCl → FeCl2 + H2S (2)
Fedư + 2HCl → FeCl2 + H2 (3)
Giả sử hỗn hợp khí Y có chứa a mol H2S và b mol H2.
Ta có: \(\overline {{M_Y}} = \frac{{{m_{H2S}} + {m_{H2}}}}{{{n_{H2S}} + {n_{H2}}}} = \frac{{34a + 2b}}{{a + b}} = 10,6.2 = 21,2\left( {g/mol} \right)\)
Suy ra 12,8a = 19,2b → a = 1,5b
Theo PTHH (2) ta có: nFeS = nH2S = a mol
Theo PTHH (1) ta có: nFe phản ứng = nFeS = a mol
Suy ra nFe ban đầu = nFe phản ứng + nFe dư = a + b = 1,5b + b = 2,5b (mol)
Hiệu suất phản ứng là \(H = \frac{{{n_{Fe(pu)}}}}{{{n_{Fe(bandau)}}}}.100\% = \frac{a}{{2,5b}}.100\% = \frac{{1,5b}}{{2,5b}}.100\% = 60\% \)
Đáp án C
Câu hỏi 25 :
Nung nóng hỗn hợp gồm 3 mol Fe và 2 mol S trong môi trường không có không khí đến khi phản ứng xảy ra hoàn toàn, thu được chất rắn X. Cho X tác dụng với dung dịch HCl dư thu được khí Y. Thành phần của khí Y là
- A H2S.
- B H2.
- C H2S và SO2.
- D H2S và H2
Đáp án: D
Phương pháp giải:
Viết PTHH xảy ra, xét xem Fe và S chất nào phản ứng hết.
Khi đó xác định được rắn X gồm những chất gì (có thể gồm Fe và FeS hoặc gồm S và FeS hoặc chỉ chứa FeS)
Cho X pư với dd HCl dư thì có Fe và FeS pư
Lời giải chi tiết:
PTHH: Fe + S \(\xrightarrow{{{t^0}}}\)FeS
Ta thấy nFe = 3 (mol) > nS = 2 mol → S pư hết, Fe dư.
Vậy rắn X thu được gồm: FeS và Fe dư
Cho X pư với dd HCl dư có pư:
PTHH: Fe + 2HCl → FeCl2 + H2↑
FeS + 2HCl → FeCl2 + H2S↑
→ Khí Y thu được gồm H2 và H2S.
Đáp án D
Câu hỏi 26 :
Cấu hình electron lớp ngoài cùng của lưu huỳnh là
- A 2s22p4.
- B 3s23p4.
- C 2s22p6.
- D 3s23p5.
Đáp án: B
Phương pháp giải:
Dựa vào cấu hình electron của lưu huỳnh được học trong sgk hóa 10 trang 129.
Lời giải chi tiết:
S (Z = 16): 1s22s22p63s23p4 ⟹ có cấu hình e lớp ngoài cùng là 3s23p4.
Đáp án B
Câu hỏi 27 :
Phát biểu nào sau đây đúng?
- A Lưu huỳnh chỉ có tính oxi hóa.
- B Lưu huỳnh vừa có tính oxi hóa, vừa có tính khử.
- C Lưu huỳnh chỉ có tính khử.
- D Lưu huỳnh không có tính oxi hóa, tính khử.
Đáp án: B
Phương pháp giải:
Dựa vào số oxi hóa của S ở trạng thái cơ bản. Nếu số oxi hóa thấp nhất thì chỉ có tính khử, nếu số oxi hóa cao nhất thì chỉ có tính oxi hóa, nếu số oxi hóa ở trạng thái trung gian thì có cả tính khử và tính oxi hóa.
Lời giải chi tiết:
Lưu huỳnh (S0) có số oxi hóa trung gian có thể xuống số oxi hóa -2 (thể hiện tính oxi hóa) và lên số oxi hóa (+4, +6) thể hiện tính khử
⟹ Lưu huỳnh vừa có tính oxi hóa, vừa có tính khử.
Đáp án B
Câu hỏi 28 :
Cho 2,8 gam Fe tác dụng hết với S, sau phản ứng thu được bao nhiêu gam muối?
- A 5,5 gam.
- B 4,4 gam.
- C 2,2 gam.
- D 8,8 gam.
Đáp án: B
Phương pháp giải:
Đổi số mol Fe, tính toán mol FeS theo số mol Fe dựa vào PTHH: Fe + S \(\xrightarrow{{{t^0}}}\) FeS
Lời giải chi tiết:
nFe = mFe : MFe = 2,8 : 56 = 0,05 (mol)
PTHH: Fe + S \(\xrightarrow{{{t^0}}}\) FeS
Theo PTHH: nFeS = nFe = 0,05 (mol) ⟹ mFeS = nFeS×MFeS = 0,05×88 = 4,4(g)
Đáp án B
Câu hỏi 29 :
Khi tác dụng với các phi kim hoạt động mạnh hơn, S thể hiện những số oxi hóa nào?
- A +1, +6.
- B -2, +6.
- C -2, +4.
- D +4, +6.
Đáp án: D
Phương pháp giải:
Dựa vào tính chất hóa học của S
Lời giải chi tiết:
Khi tác dụng với các phi kim mạnh hơn, S thể hiện số oxi hóa + 4, +6 (tính khử)
VD: \(\mathop S\limits^0 \, + \mathop {{O_2}}\limits^0 \xrightarrow{{{t^0}}}\mathop S\limits^{ + 4} \mathop {{O_2}}\limits^{ - 2} \)
\(\mathop S\limits^0 \, + \mathop {{F_2}}\limits^0 \xrightarrow{{{t^0}}}\mathop S\limits^{ + 6} \mathop {{F_6}}\limits^{ - 1} \)
Đáp án D
Câu hỏi 30 :
Đun nóng hỗn hợp X gồm 4,2 gam bột Fe và 1,2 gam bột S trong điều kiện không có oxi, sau khi phản ứng xảy ra hoàn toàn thu được chất rắn Y. Cho toàn bộ Y vào 200 ml dung dịch HCl vừa đủ thu được một hỗn hợp khí bay ra. Nồng độ mol/l của dung dịch HCl đã dùng là
- A 0,75M.
- B 0,50M.
- C 0,25M.
- D 0,15M.
Đáp án: A
Phương pháp giải:
Đổi số mol Fe, S.
Làm bài toán theo phương pháp 3 dòng dựa vào PTHH: Fe + S \(\xrightarrow{{{t^0}}}\) FeS
Xác định được số mol mối chất trong rắn Y gồm: Fe dư và FeS.
Lời giải chi tiết:
\({n_{Fe}} = \frac{{{m_{Fe}}}}{{{M_{Fe}}}} = \frac{{4,2}}{{56}} = 0,075\,(mol);{n_S} = \frac{{{m_S}}}{{{M_S}}} = \frac{{1,2}}{{32}} = 0,0375\,(mol)\)
PTHH: Fe + S \(\xrightarrow{{{t^0}}}\) FeS (1)
bđ 0,075 0,0375
pư 0,0375←0,0375→ 0,0375
sau 0,0375 0 0,0375
Hỗn hợp rắn Y thu được gồm: Fe dư: 0,0375 (mol) và FeS: 0,0375 (mol)
PTHH: Fe dư + 2HCl → FeCl2 + H2↑ (2)
FeS + 2HCl → FeCl2 + H2S↑ (3)
Theo PTHH (2) và (3) ta có: nHCl = 2nFe dư + 2nFeS = 2.0,0375 + 2.0,0375 = 0,15 (mol)
200 ml = 0,2 (lít)
⟹ CM HCl = nHCl : VHCl = 0,15 : 0,2 = 0,75 (mol/lít)
Đáp án A
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải
- 20 câu hỏi cân bằng phản ứng OXH - Khử mức độ vận dụng, vận dụng cao có lời giải
- 50 câu hỏi ôn tập về bảng tuần hoàn các nguyên tố và định luật tuần hoàn có lời giải
- 40 câu hỏi lý thuyết về axit sunfuric - muối sunfat có lời giải (phần 1)
- 30 bài tập thông hiểu về cấu hình electron có lời giải (phần 1)
- 20 bài tập vận dụng về cấu hình electron có lời giải









