Trắc nghiệm Bài 11. Liên kết ion - Hóa 10 Kết nối tri thức
Đề bài
Liên kết hóa học trong NaCl được hình thành là do
-
A.
hai hạt nhân nguyên tử hút electron rất mạnh.
-
B.
mỗi nguyên tử Na và Cl góp chung 1 electron.
-
C.
mỗi nguyên tử đó nhường hoặc thu electron để trở thành các ion trái dấu hút nhau.
-
D.
Na – e → Na+; Cl + e → Cl- ; Na+ + Cl- → NaCl.
Muối ăn ở thể rắn là:
-
A.
Các phân tử NaCl.
-
B.
Các ion Na+ và Cl-.
-
C.
Các tinh thể hình lập phương : các ion Na+ và Cl- được phân bố luân phiên đều đặn trên mỗi đỉnh.
-
D.
Các tinh thể hình lập phương : các ion Na+ và Cl- được phân bố luân phiên đều đặn thành từng phân tử riêng rẽ.
Các ion và nguyên tử 9F-, 10Ne, 11Na+ giống nhau về
-
A.
số khối.
-
B.
số electron.
-
C.
số proton.
-
D.
số nơtron.
Cấu hình electron nguyên tử X và Y lần lượt là 1s22s22p63s23p64s1 và 1s22s22p5 Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết.
-
A.
cho - nhận.
-
B.
kim loại.
-
C.
ion
-
D.
cộng hoá trị.
X thuộc chu kì 3, nhóm IA, Y thuộc chu kì 3, nhóm VIIA. Công thức phân tử và bản chất liên kết của hợp chất giữa X và Y là
-
A.
X2Y ; liên kết ion
-
B.
XY ; liên kết ion.
-
C.
XY2 ; liên kết cộng hoá trị.
-
D.
X2Y2 ; liên kết cộng hoá trị.
Hợp chất trong phân tử có liên kết ion là
-
A.
NH4Cl.
-
B.
NH3.
-
C.
HCl.
-
D.
H2O.
Khi phản ứng hoá học xảy ra giữa những nguyên tử có cấu hình electron ở trạng thái cơ bản là 1s22s1 và 1s22s22p5 thì liên kết này là
-
A.
liên kết cộng hoá trị có cực.
-
B.
liên kết cộng hoá trị không cực.
-
C.
liên kết ion.
-
D.
liên kết kim loại.
Liên kết ion là loại liên kết hóa học được hình thành nhờ lực hút tĩnh điện giữa các phần tử nào sau đây?
-
A.
cation và anion
-
B.
các anion
-
C.
cation và electron tự do
-
D.
electron và hạt nhân nguyên tử
Tính chất nào sau đây là tính chất của hợp chất ion?
-
A.
Hợp chất ion có nhiệt độ nóng chảy thấp
-
B.
Hợp chất ion có nhiệt độ nóng chảy cao
-
C.
Hợp chất ion dễ hóa lỏng
-
D.
Hợp chất ion có nhiệt độ sôi không xác định
Dãy gồm các phân tử đều có liên kết ion là
-
A.
Cl2, Br2, I2, HCl
-
B.
HCl, H2S, NaCl, N2O
-
C.
Na2O, KCl, BaCl2, Al2O3
-
D.
MgO, H2SO4, H3PO4, HCl
Cho giá trị độ âm điện của các nguyên tố: F (3,98); O (3,44); C (2,55); H (2,20); Na (0,93). Hợp chất nào sau đây là hợp chất ion?
-
A.
NaF.
-
B.
CO2.
-
C.
CH4.
-
D.
H2O.
Phân tử KF có kiểu liên kết :
-
A.
cộng hóa trị
-
B.
cộng hóa trị phân cực
-
C.
ion
-
D.
cho – nhận
M thuộc nhóm IIA, X thuộc nhóm VIA. Trong oxit cao nhất M chiếm 71,43% khối lượng, còn X chiếm 40% khối lượng. Liên kết giữa X và M trong hợp chất thuộc loại liên kết nào sau đây ?
-
A.
Liên kết ion.
-
B.
Liên kết cộng hoá trị.
-
C.
Liên kết cho nhận
-
D.
Liên kết ion, liên kết cộng hoá trị.
Các ion nào sau đây có cấu hình electron ở lớp ngoài cùng là 1s22s22p6?
-
A.
Na+, K+, Cl−, O2−
-
B.
Na+, O2−, Mg2+, N3−
-
C.
Li+, Mg2+, Cl−, N3−
-
D.
K+, Li+, N3−, O2−
Điều nào dưới đây đúng khi nói về ion S2-?
-
A.
Có chứa 18 proton.
-
B.
Có chứa 18 electron.
-
C.
Trung hoà về điện.
-
D.
Được tạo thành khi nguyên tử sulfur (S) nhận vào 2 proton.
Điều nào dưới đây không đúng khi nói về hợp chất sodium oxide (Na2O)?
-
A.
Trong phân tử Na2O, các ion sodium Na+ và ion oxide O2- đều đạt cấu hình electron bền vững của khí hiếm neon.
-
B.
Phân tử Na2O tạo bởi lực hút tĩnh điện giữa hai ion Na+ và một ion O2-.
-
C.
Là chất rắn trong điều kiện thường.
-
D.
Không tan trong nước, chỉ tan trong dung môi không phân cực như benzene, carbon tetrachloride, ...
Tính chất nào dưới đây đúng khi nói về hợp chất ion?
-
A.
Hợp chất ion có nhiệt độ nóng chảy thấp.
-
B.
Hợp chất ion tan tốt trong dung môi không phân cực.
-
C.
Hợp chất ion có cấu trúc tinh thể.
-
D.
Hợp chất ion dẫn điện ở trạng thái rắn.
Hợp chất A có các tính chất sau: Ở thể rắn trong điều kiện thường, dễ tan trong nước tạo dung dịch dẫn điện được. Hợp chất A là
-
A.
sodium chloride.
-
B.
glucose.
-
C.
sucrose.
-
D.
fructose.
Tính chất nào sau đây không phải của magnesium oxide (MgO)?
-
A.
Có nhiệt độ nóng chảy cao hơn so với NaCl.
-
B.
Chất khí ở điều kiện thường.
-
C.
Có cấu trúc tinh thể.
-
D.
Phân tử tạo bởi lực hút tĩnh điện giữa ion Mg2+ và O2-.
Cho các ion: Na+, Ca2+, F-, CO32-. Số lượng các hợp chất chứa hai loại ion có thể tạo thành từ các ion này là
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Lời giải và đáp án
Liên kết hóa học trong NaCl được hình thành là do
-
A.
hai hạt nhân nguyên tử hút electron rất mạnh.
-
B.
mỗi nguyên tử Na và Cl góp chung 1 electron.
-
C.
mỗi nguyên tử đó nhường hoặc thu electron để trở thành các ion trái dấu hút nhau.
-
D.
Na – e → Na+; Cl + e → Cl- ; Na+ + Cl- → NaCl.
Đáp án : D
Liên kết trong phân tử NaCl là liên kết ion, do vậy sự hình thành NaCl phải là sự cho nhận e của cation (Na+) và anion (Cl-)
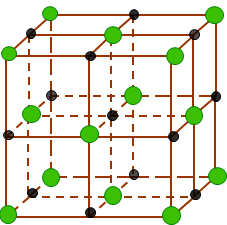
Muối ăn ở thể rắn là:
-
A.
Các phân tử NaCl.
-
B.
Các ion Na+ và Cl-.
-
C.
Các tinh thể hình lập phương : các ion Na+ và Cl- được phân bố luân phiên đều đặn trên mỗi đỉnh.
-
D.
Các tinh thể hình lập phương : các ion Na+ và Cl- được phân bố luân phiên đều đặn thành từng phân tử riêng rẽ.
Đáp án : C
Ở thể rắn, NaCl tồn tại dưới dạng tinh thể ion. Trong mạng tinh thể NaCl, các ion Na+ và Cl- được phân bố luân phiên đều đặn trên các đỉnh của các hình lập phương nhỏ.
Các ion và nguyên tử 9F-, 10Ne, 11Na+ giống nhau về
-
A.
số khối.
-
B.
số electron.
-
C.
số proton.
-
D.
số nơtron.
Đáp án : B
Viết cấu hình e, xác định số p, số e, số n, số khối của từng ion và nguyên tử
9F-: (Z = 9): 1s22s22p6 => Có 10e, 9p
10Ne: (Z = 10): 1s22s22p6 => Có 10e, 10p
11Na+ (Z = 11): 1s22s22p6 => Có 10e, 11p
Cấu hình electron nguyên tử X và Y lần lượt là 1s22s22p63s23p64s1 và 1s22s22p5 Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết.
-
A.
cho - nhận.
-
B.
kim loại.
-
C.
ion
-
D.
cộng hoá trị.
Đáp án : C
X thuộc nhóm IA là kim loại điển hình
Y thuộc nhóm VIIA là phi kim điển hình
=> liên kết giữa X và Y là liên kết ion
X thuộc chu kì 3, nhóm IA, Y thuộc chu kì 3, nhóm VIIA. Công thức phân tử và bản chất liên kết của hợp chất giữa X và Y là
-
A.
X2Y ; liên kết ion
-
B.
XY ; liên kết ion.
-
C.
XY2 ; liên kết cộng hoá trị.
-
D.
X2Y2 ; liên kết cộng hoá trị.
Đáp án : B
X thuộc nhóm IA là kim loại điển hình, điện tích 1+
Y thuộc nhóm VIIA là phi kim điển hình, điện tích 1-
=> CT là XY, liên kết giữa X và Y là liên kết ion
Hợp chất trong phân tử có liên kết ion là
-
A.
NH4Cl.
-
B.
NH3.
-
C.
HCl.
-
D.
H2O.
Đáp án : A
Liên kết ion là lực hút tĩnh điện giữa 2 ion mang điện tích trái dấu
NH4Cl được tạo thành từ ion NH4+ và Cl-
Khi phản ứng hoá học xảy ra giữa những nguyên tử có cấu hình electron ở trạng thái cơ bản là 1s22s1 và 1s22s22p5 thì liên kết này là
-
A.
liên kết cộng hoá trị có cực.
-
B.
liên kết cộng hoá trị không cực.
-
C.
liên kết ion.
-
D.
liên kết kim loại.
Đáp án : C
1s22s1 thuộc nhóm IA là kim loại điển hình
1s22s22p5 thuộc nhóm VIIA là phi kim điển hình
=> liên kết giữa 2 nguyên tố trên là liên kết ion
Liên kết ion là loại liên kết hóa học được hình thành nhờ lực hút tĩnh điện giữa các phần tử nào sau đây?
-
A.
cation và anion
-
B.
các anion
-
C.
cation và electron tự do
-
D.
electron và hạt nhân nguyên tử
Đáp án : A
Lực hút tĩnh điện giữa các ion mang điện tích trái dấu trong phân tử tạo ra liên kết
=> Lực hút tĩnh điện giữa cation và anion
Tính chất nào sau đây là tính chất của hợp chất ion?
-
A.
Hợp chất ion có nhiệt độ nóng chảy thấp
-
B.
Hợp chất ion có nhiệt độ nóng chảy cao
-
C.
Hợp chất ion dễ hóa lỏng
-
D.
Hợp chất ion có nhiệt độ sôi không xác định
Đáp án : B
Trong tinh thể ion, giữa các ion có lực hút tĩnh điện rất mạnh nên các hợp chất ion thường là chất rắn, khó nóng chảy
Dãy gồm các phân tử đều có liên kết ion là
-
A.
Cl2, Br2, I2, HCl
-
B.
HCl, H2S, NaCl, N2O
-
C.
Na2O, KCl, BaCl2, Al2O3
-
D.
MgO, H2SO4, H3PO4, HCl
Đáp án : C
Liên kết ion tạo bởi kim loại điển hình và phi kim điển hình
A. Sai vì cả 4 chất đều là liên kết cộng hóa trị
B. Sai vì HCl, H2S, N2O là liên kết cộng hóa trị
C. Đúng
D. Sai vì H2SO4, H3PO4, HCl là liên kết cộng hóa trị
Cho giá trị độ âm điện của các nguyên tố: F (3,98); O (3,44); C (2,55); H (2,20); Na (0,93). Hợp chất nào sau đây là hợp chất ion?
-
A.
NaF.
-
B.
CO2.
-
C.
CH4.
-
D.
H2O.
Đáp án : A
Dựa vào độ âm điện của các nguyên tố
NaF có hiệu độ âm điện 3,05 > 1,7 => hợp chất ion
Phân tử KF có kiểu liên kết :
-
A.
cộng hóa trị
-
B.
cộng hóa trị phân cực
-
C.
ion
-
D.
cho – nhận
Đáp án : C
Dựa vào độ âm điện của K và F
KF có hiệu độ âm điện > 1,7 => liên kết ion
M thuộc nhóm IIA, X thuộc nhóm VIA. Trong oxit cao nhất M chiếm 71,43% khối lượng, còn X chiếm 40% khối lượng. Liên kết giữa X và M trong hợp chất thuộc loại liên kết nào sau đây ?
-
A.
Liên kết ion.
-
B.
Liên kết cộng hoá trị.
-
C.
Liên kết cho nhận
-
D.
Liên kết ion, liên kết cộng hoá trị.
Đáp án : A
Gọi công thức oxide của M là MO
%M = \(\frac{M}{{M + 16}}.100\% = 71,43\% \to M = 40(Ca)\)
Gọi công thức oxide của X là XO3
%X = \(\frac{X}{{X + 3.16}}.100\% = 40\% \to X = 32(S)\)
Liên kết giữa CaS là liên kết ion
Các ion nào sau đây có cấu hình electron ở lớp ngoài cùng là 1s22s22p6?
-
A.
Na+, K+, Cl−, O2−
-
B.
Na+, O2−, Mg2+, N3−
-
C.
Li+, Mg2+, Cl−, N3−
-
D.
K+, Li+, N3−, O2−
Đáp án : B
Các nguyên tố gần với nguyên tố khí hiếm (Z=10)
Na+, O2−, Mg2+, N3−
Điều nào dưới đây đúng khi nói về ion S2-?
-
A.
Có chứa 18 proton.
-
B.
Có chứa 18 electron.
-
C.
Trung hoà về điện.
-
D.
Được tạo thành khi nguyên tử sulfur (S) nhận vào 2 proton.
Đáp án : B
- Bước 1: Viết cấu hình electron của S
- Bước 2: Viết cấu hình electron của S2-
- Bước 3: Xác định số proton và electron trong ion S2-
- Nguyên tố S ở ô số 16 trong bảng tuần hoàn
=> Cấu hình electron của nguyên tử S là 1s22s22p63s23p4
=> Cấu hình electron của nguyên tử S2- là 1s22s22p63s23p6
- Trong ion S2- có: 16 proton và 16 + 2 = 18 electron
=> Đáp án: B
- Sửa lỗi:
+ Đáp án A sai ở “18 proton” sửa thành “16 proton”
+ Đáp án C sai ở “trung hòa về điện” sửa thành “ion S2- mang điện tích âm”
+ Đáp án D sai ở “nhận vào 2 proton” sửa thành “nhận vào 2 electron”
Điều nào dưới đây không đúng khi nói về hợp chất sodium oxide (Na2O)?
-
A.
Trong phân tử Na2O, các ion sodium Na+ và ion oxide O2- đều đạt cấu hình electron bền vững của khí hiếm neon.
-
B.
Phân tử Na2O tạo bởi lực hút tĩnh điện giữa hai ion Na+ và một ion O2-.
-
C.
Là chất rắn trong điều kiện thường.
-
D.
Không tan trong nước, chỉ tan trong dung môi không phân cực như benzene, carbon tetrachloride, ...
Đáp án : D
Dựa vào đặc điểm của hợp chất ion: Trong điều kiện thường, các hợp chất ion thường tồn tại ở trạng thái rắn, khó nóng chảy, khó bay hơi và không dẫn điện ở trạng thái rắn. Hợp chất ion thường dễ tan trong nước, tạo thành dung dịch có khả năng dẫn điện.
- Đáp án D, sửa thành “Tan trong nước, không tan trong dung môi không phân cực như benzene, carbon tetrachloride,…” vì Na2O là một chất phân cực thì sẽ tan trong các dung môi phân cực
Tính chất nào dưới đây đúng khi nói về hợp chất ion?
-
A.
Hợp chất ion có nhiệt độ nóng chảy thấp.
-
B.
Hợp chất ion tan tốt trong dung môi không phân cực.
-
C.
Hợp chất ion có cấu trúc tinh thể.
-
D.
Hợp chất ion dẫn điện ở trạng thái rắn.
Đáp án : C
Dựa vào đặc điểm của hợp chất ion: Trong điều kiện thường, các hợp chất ion thường tồn tại ở trạng thái rắn, khó nóng chảy, khó bay hơi và không dẫn điện ở trạng thái rắn. Hợp chất ion thường dễ tan trong nước, tạo thành dung dịch có khả năng dẫn điện.
- Đáp án: C
- Sửa lại:
+ Đáp án A, sai ở “nhiệt độ nóng chảy thấp” sửa thành “nhiệt độ nóng chảy cao”
+ Đáp án B, sai ở “dung môi không phân cực” sửa thành “dung môi phân cực”
+ Đáp án D, sai ở “dẫn điện ở trạng thái rắn” sửa thành “không dẫn điện ở trạng thái rắn”
Hợp chất A có các tính chất sau: Ở thể rắn trong điều kiện thường, dễ tan trong nước tạo dung dịch dẫn điện được. Hợp chất A là
-
A.
sodium chloride.
-
B.
glucose.
-
C.
sucrose.
-
D.
fructose.
Đáp án : A
Dựa vào đặc điểm của hợp chất ion: Trong điều kiện thường, các hợp chất ion thường tồn tại ở trạng thái rắn, khó nóng chảy, khó bay hơi và không dẫn điện ở trạng thái rắn. Hợp chất ion thường dễ tan trong nước, tạo thành dung dịch có khả năng dẫn điện.
- Hợp chất A phải là một hợp chất ion => Thường được tạo thành khi kim loại điển hình tác dụng với phi kim điển hình
=> Đáp án: A (NaCl)
Tính chất nào sau đây không phải của magnesium oxide (MgO)?
-
A.
Có nhiệt độ nóng chảy cao hơn so với NaCl.
-
B.
Chất khí ở điều kiện thường.
-
C.
Có cấu trúc tinh thể.
-
D.
Phân tử tạo bởi lực hút tĩnh điện giữa ion Mg2+ và O2-.
Đáp án : B
Dựa vào đặc điểm của hợp chất ion: Trong điều kiện thường, các hợp chất ion thường tồn tại ở trạng thái rắn, khó nóng chảy, khó bay hơi và không dẫn điện ở trạng thái rắn. Hợp chất ion thường dễ tan trong nước, tạo thành dung dịch có khả năng dẫn điện.
- Phân tử MgO tạo bởi lực hút tĩnh điện giữa ion Mg2+ và O2- " Đây là một hợp chất ion ð Đáp án: B, sửa thành “chất rắn ở điều kiện thường”
Cho các ion: Na+, Ca2+, F-, CO32-. Số lượng các hợp chất chứa hai loại ion có thể tạo thành từ các ion này là
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Đáp án : C
Dựa vào số lượng cation và số lượng anion, số lượng các hợp chất chứa 2 loại ion = số cation x số anion
- Số lượng các hợp chất chứa 2 loại ion = 2x2 = 4
-> Đáp án: C
Luyện tập và củng cố kiến thức Bài 12. Liên kết cộng hóa trị Hóa 10 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 13. Liên kết hydrogen và tương tác van der Waals Hóa 10 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 10. Quy tắc octet Hóa 10 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
- Trắc nghiệm Bài 22. Hydrogen halide. Muối halide - Hóa 10 Kết nối tri thức
- Trắc nghiệm Bài 21. Nhóm halogen - Hóa 10 Kết nối tri thức
- Trắc nghiệm Bài 19. Tốc độ phản ứng - Hóa 10 Kết nối tri thức
- Trắc nghiệm Bài 17. Biến thiên enthalpy trong các phản ứng hóa học - Hóa 10 Kết nối tri thức
- Trắc nghiệm Bài 15. Phản ứng oxi hóa - khử - Hóa 10 Kết nối tri thức










Danh sách bình luận