Lý thuyết mol và tỉ khối chất khí - Khoa học tự nhiên 8 - Kết nối tri thức
Mol là lượng chất có chứa NA (6,022.10-23) nguyên tử hoặc phân tử của chất đó.
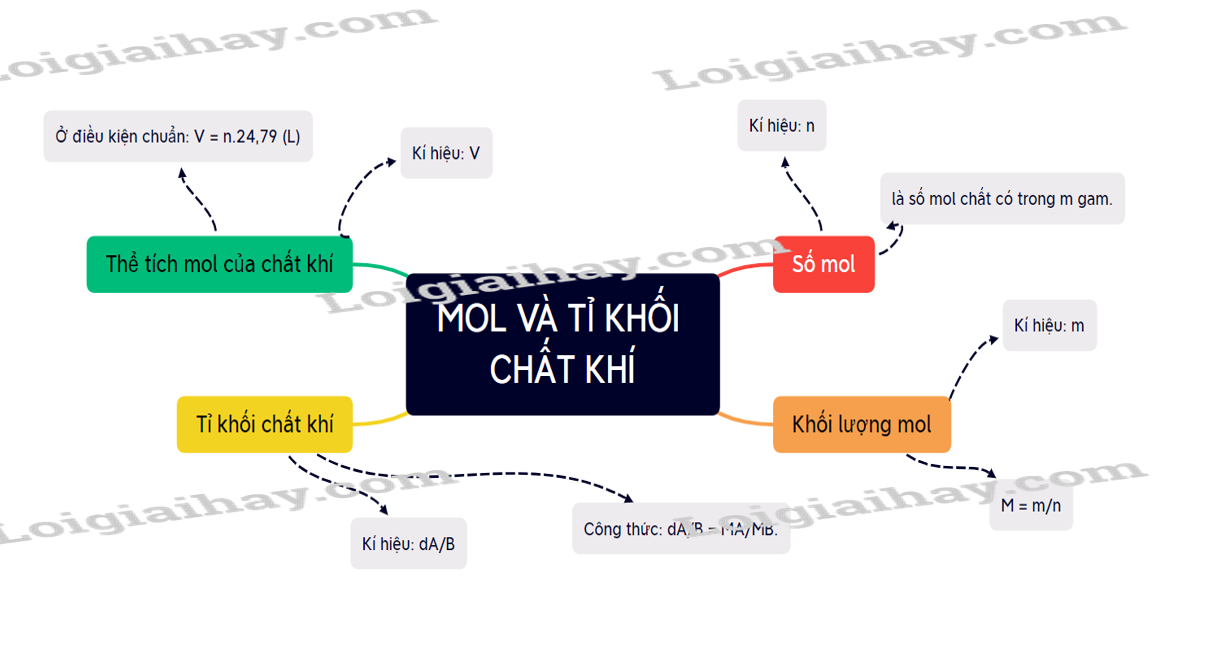
I. Mol
1. Khái niệm
- Mol là lượng chất có chứa NA (6,022.1023) nguyên tử hoặc phân tử của chất đó.
- NA = 6,022.1023 là số Avogadro.
2. Khối lượng mol
- Kí hiệu: M
- Khối lượng mol của một chất là khối lượng của NA nguyên tử hoặc phân tử chất đó tính theo đơn vị gam.
- Công thức tính khối lượng mol: (với n là số mol chất có trong m gam)
3. Thể tích mol của chất khí
- Thể tích mol của chất khí là thể tích chiếm bởi NA phân tử của chất khí đó.
- Ở điều kiện chuẩn (25oC và 1 bar), 1mol khí đều chiếm 24,79 lít.
→ V = n.24,79 (L)
II. Tỉ khối chất khí
- Để xác định khí A nặng hay nhẹ hơn bao nhiêu lần, người ta dựa vào tỉ số khối lượng mol của khí A (MA) và khối lượng mol khí B (MB).
- Công thức: dA/B = MA/MB.
- Tỉ khối của khí A so với không khí: dA/kk = MA/29.
Sơ đồ tư duy
Luyện Bài Tập Trắc nghiệm KHTN 8 - Kết nối tri thức - Xem ngay
Các bài khác cùng chuyên mục
- Lý thuyết Bảo vệ môi trường - Khoa học tự nhiên 8 Kết nối tri thức
- Lý thuyết Cân bằng tự nhiên - Khoa học tự nhiên 8 Kết nối tri thức
- Lý thuyết Sinh quyển - Khoa học tự nhiên 8 Kết nối tri thức
- Lý thuyết Hệ sinh thái - Khoa học tự nhiên 8 Kết nối tri thức
- Lý thuyết Quần xã sinh vật - Khoa học tự nhiên 8 Kết nối tri thức
- Lý thuyết Bảo vệ môi trường - Khoa học tự nhiên 8 Kết nối tri thức
- Lý thuyết Cân bằng tự nhiên - Khoa học tự nhiên 8 Kết nối tri thức
- Lý thuyết Sinh quyển - Khoa học tự nhiên 8 Kết nối tri thức
- Lý thuyết Hệ sinh thái - Khoa học tự nhiên 8 Kết nối tri thức
- Lý thuyết Quần xã sinh vật - Khoa học tự nhiên 8 Kết nối tri thức












Danh sách bình luận