 Giải khoa học tự nhiên 8, soạn sgk khtn lớp 8 kết nối tri thức với cuộc sống
Giải khoa học tự nhiên 8, soạn sgk khtn lớp 8 kết nối tri thức với cuộc sống
 Chương 2. Một số hợp chất thông dụng - KHTN 8 Kết nối t..
Chương 2. Một số hợp chất thông dụng - KHTN 8 Kết nối t.. Bài 11. Muối trang 48, 49, 50, 51, 52 Khoa học tự nhiên 8 Kết nối tri thức
Muối có tính chất hoá học nào và được điều chế như thế nào?
CH tr 48 MĐ
Muối có tính chất hoá học nào và được điều chế như thế nào?
Lời giải chi tiết:
- Một số tính chất hoá học của muối:
+ Dung dịch muối tác dụng với kim loại;
+ Muối tác dụng với dung dịch acid;
+ Dung dịch muối tác dụng với dung dịch base;
+ Dung dịch muối tác dụng với dung dịch muối.
- Muối có thể được điều chế bằng một số phương pháp như:
+ Dung dịch acid tác dụng với base;
+ Dung dịch acid tác dụng với oxide base;
+ Dung dịch acid tác dụng với muối;
+ Oxide acid tác dụng với dung dịch base;
CH tr 48 CH
Quan sát bảng 11.1 và thực hiện các yêu cầu:
1. Nhận xét sự khác nhau giữa thành phần phân tử của acid (chất phản ứng) và muối (chất sản phẩm). Đặc điểm chung của các phản ứng ở bảng 11.1 là gì?
2. Nhận xét cách gọi tên muối.
Phương pháp giải:
Dựa vào bảng 11.1 theo dõi để trả lời câu hỏi
Lời giải chi tiết:
1. Công thức phân tử của acid và phân tử muối khác nhau là phân tử acid gồm các nguyên tử H liên kết với anion gốc acid còn phân tử muối nguyên tử H đã được thay thế bằng nguyên tử kim loại.
Đặc điểm chung của các phản ứng trong bảng 11.1 là có acid là chất tham gia, sản phẩm tạo thành là muối.
2. Cách gọi tên muối: Tên kim loại (Kèm hóa trị đối với kim loại nhiều hóa trị) + Tên gốc acid
CH tr 49
1. Viết công thức của các muối sau: potassium sulfate, sodium hydrogen sulfate, sodium hydrogen carbonate, sodium chloride, sodium nitrate, calcium hydrogen phosphate, magnesium sulfate, copper(II) sulfate.
2. Gọi tên các muỗi sau: AlCl3, KCI, Al2(SO4)3, MgSO4, NH4NO3, NaHCO3.
3. Viết phương trình hoá học của phản ứng tạo thành muối KCl và MgSO4.
Phương pháp giải:
Dựa vào khái niệm của muối và cấu tạo của muối, tính chất hoá học của muối, và cách gọi tên của muối
Lời giải chi tiết:
1. Công thức của các muối sau:
potassium sulfate: K2SO4.
sodium hydrogensulfate:NaHSO4
sodium hydrogen carbonate: NaHCO3
sodium chloride: NaCl
sodium nitrate: NaNO3
calcium hydrogen phosphate: CaHPO4
magnesium sulfate: MgSO4
copper(II) sulfate: CuSO4
2. Gọi tên các muối sau:
AlCl3: Aluminum chloride
KCl: Potassium Chloride
Al2(SO4)3: Aluminum sulfate
MgSO4: Magnesium sulfate
NH4NO3: Ammonium nitrate
NaHCO3: Sodium hydrogen carbonate
3. PTHH: 2KCl + MgSO4 → K2SO4 + MgCl2
CH tr 50
Quan sát hiện tượng xảy ra ở mỗi ống nghiệm và thực hiện yêu cầu:
1. Viết phương trình hóa học giải thích hiện tượng xảy ra.
2. Thảo luận nhóm rút ra kết luận về tính chất hóa học của muối.
Phương pháp giải:
Quan sát thí nghiệm ở hình 11.1 để trả lời câu hỏi
Lời giải chi tiết:
1. PTHH:
(1) Fe + CuSO4 → FeSO4 + Cu
Hiện tượng: Chất rắn màu trắng xám Iron (Fe) bị 1 lớp đồng đỏ phủ lên bề mặt.
(2) BaCl2 + H2SO4 → 2HCl + BaSO4↓
Hiện tượng: Xuất hiện kết tủa trắng không tan trong dung dịch.
(3) BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl
Hiện tượng: Xuất hiện kết tủa trắng trong dung dịch.
(4) CuSO4 + NaOH → Cu(OH)2 ↓ + Na2SO4
Hiện tượng: xuất hiện kết tủa màu xanh lam không tan trong dung dịch.
2. Kết luận:
Muối + kim loại → Muối mới + kim loại mới
Muối + acid → muối mới + acid mới
Muối + muối → 2 muối mới
Muối + base → muối mới + base mới
Sản phẩm tạo thành có chất kết tủa (không tan)
CH tr 51
Trong dung dịch giữa các cặp chất nào sau đây có xảy ra phản ứng? Viết phương trình hóa học của các phản ứng đó.

Phương pháp giải:
Dựa vào tính chất hoá học của muối để trả lời câu hỏi
Lời giải chi tiết:
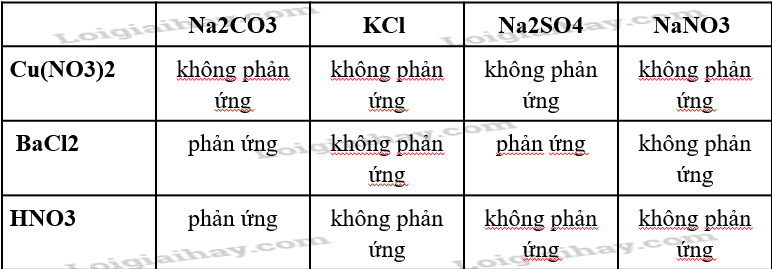
PTHH
Na2CO3 + BaCl2 → 2NaCl + BaCO3(↓)
Na2SO4 + BaCl2 → 2NaCl + BaSO4(↓)
Na2CO3 + 2HNO3 → 2NaNO3 + CO2 ↑ + H2O
CH tr 52
Dựa vào sơ đồ Hình 11.2 và cho biết tính chất của oxide, acid, base. Viết phương trình hóa học minh họa.
Phương pháp giải:
Dựa vào tính chất hoá học của acid, base, muối và sơ đồ hình 11.2 biểu diễn mối liên hệ về tính chất hoá học của các hợp chất
Lời giải chi tiết:
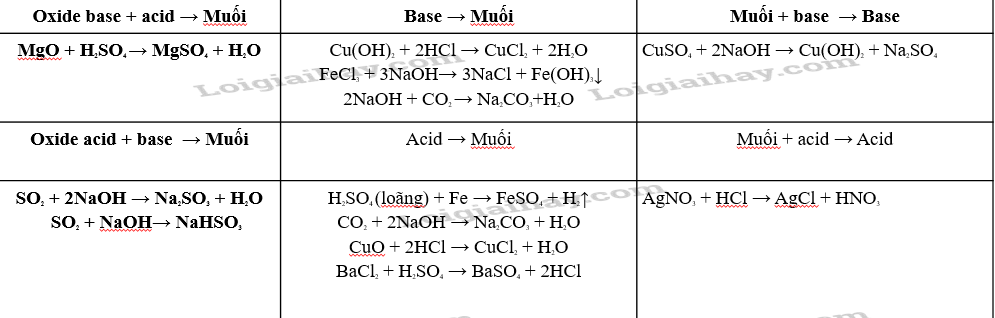
- Bài 12. Phân bón hóa học trang 53, 54, 55 Khoa học tự nhiên 8 Kết nối tri thức
- Bài 10. Oxide trang 44, 45, 46, 47 Khoa học tự nhiên 8 Kết nối tri thức
- Bài 9. Base - thang pH trang 39, 40, 41, 42, 43 Khoa học tự nhiên 8 Kết nối tri thức
- Bài 8. Acid trang 35, 36, 37, 38 Khoa học tự nhiên 8 Kết nối tri thức
Luyện Bài Tập Trắc nghiệm KHTN 8 - Kết nối tri thức - Xem ngay
Các bài khác cùng chuyên mục
- Lý thuyết Bảo vệ môi trường - Khoa học tự nhiên 8 Kết nối tri thức
- Lý thuyết Cân bằng tự nhiên - Khoa học tự nhiên 8 Kết nối tri thức
- Lý thuyết Sinh quyển - Khoa học tự nhiên 8 Kết nối tri thức
- Lý thuyết Hệ sinh thái - Khoa học tự nhiên 8 Kết nối tri thức
- Lý thuyết Quần xã sinh vật - Khoa học tự nhiên 8 Kết nối tri thức
- Lý thuyết Bảo vệ môi trường - Khoa học tự nhiên 8 Kết nối tri thức
- Lý thuyết Cân bằng tự nhiên - Khoa học tự nhiên 8 Kết nối tri thức
- Lý thuyết Sinh quyển - Khoa học tự nhiên 8 Kết nối tri thức
- Lý thuyết Hệ sinh thái - Khoa học tự nhiên 8 Kết nối tri thức
- Lý thuyết Quần xã sinh vật - Khoa học tự nhiên 8 Kết nối tri thức












Danh sách bình luận