 SBT Hóa 12 - giải SBT Hóa học 12 - Kết nối tri thức với cuộc sống
SBT Hóa 12 - giải SBT Hóa học 12 - Kết nối tri thức với cuộc sống
 Chương 8. Sơ lược về dãy kim loại chuyển tiếp thứ nhất ..
Chương 8. Sơ lược về dãy kim loại chuyển tiếp thứ nhất .. Bài 27. Đại cương về kim loại chuyển tiếp dãy thứ nhất trang 98, 99, 100 SBT Hóa 12 Kết nối tri thức
Kim loại nào sau đây thuộc dãy kim loại chuyển tiếp thứ nhất?
27.1
Kim loại nào sau đây thuộc dãy kim loại chuyển tiếp thứ nhất?
A. Ti B. Al C. Ba D. Na
Phương pháp giải:
Dựa vào vị trí của kim loại chuyển tiếp dãy thứ nhất.
Lời giải chi tiết:
Ti thuộc dãy kim loại chuyển tiếp thứ nhất.
Đáp án A
27.2
Kim loại được mạ lên sắt để bảo vệ sắt và dùng để chế tạo thép không gỉ ( dùng làm thìa, dao, dụng cụ y tế,…) là
A. Na B. Mg C. Cr D. Ca
Phương pháp giải:
Dựa vào Phương pháp mạ điện.
Lời giải chi tiết:
Cr được mạ lên sắt để bảo vệ sắt và dùng để chế tạo thép không gỉ.
Đáp án C
27.3
Nguyên tử Manganese có số oxi hóa +4 trong hợp chất nào sau đây?
A. KMnO4 B. K2MnO4 C. MnO2 D. MnSO4
Phương pháp giải:
Dựa vào cách xác định số oxi hóa.
Lời giải chi tiết:
Mn có số oxi hóa + 4 trong hợp chất MnO2.
Đáp án C
27.4
Trong hợp chất K2Cr2O7, số oxi hóa của nguyên tử Cr là
A. +6 B. +3 C. +2 D. 0
Phương pháp giải:
Dựa vào cách xác định số oxi hóa.
Lời giải chi tiết:
Cr trong hợp chất K2Cr2O7 là +6.
Đáp án A
27.5
Sắt được sử dụng để sản xuất nam châm trong các máy phát điện và nhiều thiết bị (loa, chuông, tivi, máy tính, điện thoại,…) dựa trên tính chất nào sau đây?
A. Tính dẫn điện B. Tính dẫn nhiệt C. Tính dẻo D. Tính nhiễm từ
Phương pháp giải:
Dựa vào tính chất vật lí của kim loại.
Lời giải chi tiết:
Dựa trên tính nhiễm từ của sắt nên được sử dụng để sản xuất nam châm trong các máy phát điện và nhiều thiết bị.
Đáp án D
27.6
Đồng kim loại được sử dụng để chế tạo dây dẫn điện, thiết bị điện,.. dựa trên tính chất vật lí đặc trưng nào sau đây?
A. Dẫn điện tốt B. Tính dẻo C. Dẫn nhiệt tốt D. Ánh kim
Phương pháp giải:
Dựa vào tính chất vật lí của kim loại.
Lời giải chi tiết:
Dựa vào tính chất dẫn điện tốt của đồng nên được sử dụng để chế tạo dây dẫn điện, thiết bị điện,…
Đáp án A
27.7
Ở trạng thái cơ bản, cấu hình electron của nguyên tử nào sau đây có phân lớp 3d bão hòa?
A. Sc( Z=21) B. Cu(Z=29) C. Ni(Z=28) D. Mn(Z=25)
Phương pháp giải:
Dựa vào cấu hình electron của kim loại.
Lời giải chi tiết:
Cu(Z=29) vì có cấu hình [Ar]3d10
Đáp án B
27.8
Nguyên tố nào sau đây không thể hiện xu hướng có nhiều số oxi hóa trong hợp chất?
A. Cr B. Mn C. Fe D. Mg
Phương pháp giải:
Dựa vào tính chất của kim loại chuyển tiếp dãy thứ nhất.
Lời giải chi tiết:
Mg chỉ có 1 số oxi hóa là +2 trong hợp chất.
Đáp án D
27.9
Nguyên tố kim loại có trong hemoglobin làm nhiệm vụ vận chuyển oxygen, duy trì sự sống là
A. sodium B. magnesium C. nhôm D. sắt
Phương pháp giải:
Dựa vào trạng thái tự nhiên của kim loại chuyển tiếp dãy thứ nhất.
Lời giải chi tiết:
Fe có trong hemiglobin làm nhiệm vụ vận chuyển oxygen, duy trì sự sống.
Đáp án D
27.10
Trong dãy kim loại chuyển tiếp thứ nhất, kim loại có độ cứng cao nhất là
A. Ti B. Fe C. Cr D. Cu
Phương pháp giải:
Dựa vào tính chất vật lí của kim loại.
Lời giải chi tiết:
Cr là kim loại có độ cứng cao nhất.
Đáp án C
27.11
Trong dãy kim loại chuyển tiếp thứ nhất, hai kim loại nào sau đây đều là kim loại nhẹ (D < 5g/cm3)
A. Cr, Mn B. Fe, Co C. Sc, Ti D. Ni,Cu
Phương pháp giải:
Dựa vào tính chất vật lí của kim loại.
Lời giải chi tiết:
Sc, Ti là kim loại nhẹ.
Đáp án C
27.12
Cấu hình electron của nguyên tử vanadium ở trạng thái cơ bản là [Ar]3d34s2. Trong bảng tuần hoàn, nguyên tố vanadium thuộc nhóm
A. VB B. IB C. VIB D. IIB
Phương pháp giải:
Dựa vào cấu hình electron của nguyên tử.
Lời giải chi tiết:
Nguyên tử V có 23 electron thuộc phân lớp d nên nguyên tố V thuộc nhóm VB.
Đáp án A
27.13
Muối nào sau đây có khả năng làm mất màu thuốc tím trong môi trường sulfuric acid loãng?
A. Na2SO4 B. FeSO4 C. MgSO4 D. Fe2(SO4)3
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại chuyển tiếp dãy thứ nhất.
Lời giải chi tiết:
FeSO4 khi tác dụng với KMnO4 trong môi trường H2SO4 đặc tạo muối Fe2(SO4)3 và kết tủa đen MnO2 làm mất màu thuốc tím.
Đáp án B
27.14
Từ cấu hình electron của nguyên tử Cu ở trạng thái cơ bản là [Ar]3d104s1, xác định được cấu hình electron của ion Cu2+ là
A. [Ar]3d9 B. [Ar]3d84s1
C. [Ar]3d10 D. [Ar]3d8
Phương pháp giải:
Dựa vào cấu hình electron của nguyên tử Cu.
Lời giải chi tiết:
Cấu hình electron của ion Cu2+ là [Ar]3d9
Đáp án A
27.15
Trong dãy kim loại chuyển tiếp thứ nhất, kim loại có tính dẫn điện tốt nhất là
A. Fe B. Ti C. Cu D. Mn
Phương pháp giải:
Dựa vào tính chất vật lí của kim loại.
Lời giải chi tiết:
Cu là kim loại có tính dẫn điện tốt nhất trong dẫy kim loại chuyển tiếp thứ nhất.
Đáp án C
27.16
Nguyên tử Cr có cấu hình electron ở trạng thái cơ bản là [Ar]3d54s1. Trong phản ứng hóa học, khi nguyên tử Cr nhường đi 3 electron để tạo thành ion Cr3+, số electron còn lại trên phân lớp 3d là
A. 5 B. 4 C. 3 D. 2
Phương pháp giải:
Dựa vào cấu hình nguyên tử Cr.
Lời giải chi tiết:
Cấu hình electron của ion Cr3+ là [Ar]3d3. Số electron còn lại trên phân lớp 3d là 3.
Đáp án C
27.17
Nguyên tố nào sau đây được mệnh danh là “nguyên tố của màu sắc” do có khả năng thể hiện màu sắc phong phú?
A. Sắt B. Đồng C. Nickel D. Chromium
Phương pháp giải:
Dựa vào trạng thái tự nhiên của kim loại.
Lời giải chi tiết:
Cr là nguyên tố có khả năng đổi màu trong các hợp chất của nó.
Đáp án D
27.18
Dung dịch nào sau đây có màu vàng chanh?
A. CuSO4 B. FeCl3 C. KMnO4 D. FeSO4
Phương pháp giải:
Dựa vào màu sắc của kim loại chuyển tiếp dãy thứ nhất.
Lời giải chi tiết:
FeCl3 có màu vàng chanh.
Đáp án B
27.19
Dãy kim loại nào sau đây sắp xếp theo thứ tự tăng dần nhiệt độ nóng chảy?
A. Na, Fe,Mg B. Na,Mg,Fe C. Fe,Mg,Na D. Mg, Fe,Na
Phương pháp giải:
Dựa vào tính chất vật lí của kim loại.
Lời giải chi tiết:
Na < Mg < Fe đặc sắp xếp theo thứ tự tăng dần nhiệt độ nóng chảy.
Đáp án B
27.20
Sự hình thành các nguyên tố chuyển tiếp dãy thứ nhất là do có sự sắp xếp lần lượt các electron vào phân lớp?
A. 3d B. 4s C. 4p D. 3p
Phương pháp giải:
Dựa vào cấu hình electron của nguyên tử.
Lời giải chi tiết:
Sự hình thành các nguyên tố chuyển tiếp dãy thứ nhất là do sự sắp xếp lần lượt các electron vào phân lớp 3d.
Đáp án A
27.21
Ion nào sau đây không có electron trên phân lớp 3d và không có màu trong dung dịch nước?
A. Fe3+ B. Cr3+ C. Ti3+ D. Sc3+
Phương pháp giải:
Dựa vào trạng thái của các ion kim loại chuyển tiếp dãy thứ nhất.
Lời giải chi tiết:
Sc3+ không có electron trên phân lớp 3d: 1s2 2s22p6 3s23p5 và không có màu trong dung dịch nước.
Đáp án D
27.22
Oxide nào sau đây có màu trắng?
A. Fe2O3 B. Cr2O3 C. Al2O3 D. CuO
Phương pháp giải:
Dựa vào tính chất của các hợp chất.
Lời giải chi tiết:
Al2O3 là oxide có màu trắng.
Đáp án C
27.23
Ion nào sau đây vừa có khả năng thể hiện tính khử, vừa có khả năng thể hiện tính oxi hóa?
A. Cr3+ B. CrO42- C. AlO2- D. Sc3+
Phương pháp giải:
Các ion chưa đạt số oxi hóa thấp nhất hay cao nhất đều thể hiện cả tính khử và tính oxi hóa.
Lời giải chi tiết:
Cr3+ chưa đạt số oxi hóa cao nhất vì cao nhất là +6 và thấp nhất là 0.
Đáp án A
27.24
Nhỏ vài giọt dung dịch NaOH vào dung dịch FeCl3 thu được kết tủa có màu?
A. keo trắng B. nâu đỏ C. xanh lam D. tím đen
Phương pháp giải:
Dựa vào màu sắc của các hợp chất kim loại chuyển tiếp dãy thứ nhất.
Lời giải chi tiết:
Fe(OH)3 thu được có màu nâu đỏ.
Đáp án B
27.25
Trong dung dịch muối sulfate, ion kim loại nào sau đây có màu xanh?
A. Mn2+ B. Fe3+ C. Ti3+ D. Cu2+
Phương pháp giải:
Dựa vào màu sắc của các hợp chất kim loại chuyển tiếp dãy thứ nhất.
Lời giải chi tiết:
CuSO4 có màu xanh.
Đáp án D
27.26
Sắt là kim loại phổ biến thứ hai (sau nhôm) trên vỏ Trái Đất do nguyên tử sắt thuộc loại nguyên tử bền. Số neutron có trong một nguyên tử \(_{26}^{56}Fe\)
A. 30 B. 26 C. 56 D. 28
Phương pháp giải:
Dựa vào kí hiệu của nguyên tố Fe.
Lời giải chi tiết:
\(_{26}^{56}Fe\) có p = e = 26; n = 56 – 26 = 30
Đáp án A
27.27
Kim loại nào sau đây thể hiện hai hóa trị khi tác dụng với dung dịch HCl và khí Cl2 (toC)
A. Nhôm B. Sắt C. Đồng D. Magnesium
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại chuyển tiếp dãy thứ nhất.
Lời giải chi tiết:
Fe có 2 hóa trị II và III khi tác dụng với HCl và khí Cl2 (toC) theo phương trình hóa học sau:
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 → 2FeCl3
Đáp án B
27.28
Hợp chất iron (III) có khả năng thể hiện tính oxi hóa khi tác dụng với chất khử. Quá trình khử ion Fe3+ được biểu diễn là
A. Fe3+ + 1e → Fe2+ B. Fe2+→ Fe3+ + 1e C. Fe2+ + 2e → Fe D. Fe → Fe2+ + 1e
Phương pháp giải:
Dựa vào quá trình khử ion.
Lời giải chi tiết:
Fe3+ + 1e → Fe2+
Đáp án A
27.29
Trong không khí ẩm, gang và thép bị ăn mòn điện hóa. Trong quá trình ăn mòn, sắt bị oxi hóa ở anode tạo thành ion Fe2+ theo quá trình
A. Fe2+ + 2e → Fe B. Fe → Fe2+ + 2e C. Fe3+ + 1e → Fe2+ D. Fe2+→ Fe3+ + 1e
Phương pháp giải:
Dựa vào quá trình khử, oxi hóa tại các điện cực.
Lời giải chi tiết:
Quá trình oxi hóa ở anode là: Fe → Fe2+ + 2e
Đáp án B
27.30
Muối nào sau đây vừa có khả năng thể hiện tính oxi hóa ( trong môi trường acid), vừa có khả năng thể hiện tính khử ( trong môi trường kiềm)?
A. K2Cr2O7 B. Cr2(SO4)3 C. K2CrO4 D. Na2CrO4
Phương pháp giải:
Các chất chưa đạt số oxi hóa cao nhất hoặc nhỏ nhất sẽ thể hiện tính oxi hóa và tính khử.
Lời giải chi tiết:
Cr2(SO4)3 vừa có khả năng thể hiện tính oxi hóa, vừa có khả năng thể hiện tính khử.
Đáp án B
27.31
Khi so sánh kim loại Fe với Ca, nhận định nào sau đây không đúng?
A. Có khối lượng riêng lớn hơn B. Có độ cứng cao hơn
C. Có tính khử mạnh hơn D. Có nhiệt độ nóng chảy cao hơn
Phương pháp giải:
Dựa vào tính chất của kim loại chuyển tiếp dãy thứ nhất.
Lời giải chi tiết:
Fe có tính khử yếu hơn Ca.
Đáp án C
27.32
Khi so sánh nguyên tử Ti với K, nhận định nào sau đây không đúng?
A. Có bán kính lớn hơn B. Có số elctron hóa trị nhiều hơn
C. Có số electron độc thân nhiều hơn D. Có độ âm điện lớn hơn.
Phương pháp giải:
Dựa vào tính chất vật lí của kim loại.
Lời giải chi tiết:
K có bán kính lớn hơn Ti trong bảng tuần hoàn.
Đáp án A
27.33
Trong dãy nguyên tử Sc, Ti, V, Cr bán kính nguyên tử thay đổi như thế nào?
A. Tăng dần B. Không đổi C. Giảm dần D. Không có quy luật
Phương pháp giải:
Dựa vào quy luật bảng tuần hoàn.
Lời giải chi tiết:
Sc, Ti, V, Cr có bán kính giảm dần trong bảng tuần hoàn.
Đáp án C
27.34
Các hợp chất ứng với số oxi hóa cao nhất của Cr có tính oxi hóa mạnh. Giá trị thế điện cực chuẩn nào sau đây thuộc về cặp Cr2O72- , H+/Cr3+
A. -0.44V B. -2,93V C. 0V D. +1,36V
Phương pháp giải:
Dựa vào bảng thế điện cực chuẩn của các chất.
Lời giải chi tiết:
Giá trị thế điện cực chuẩn nào sau đây thuộc về cặp Cr2O72- , H+/Cr3+ là 1,36V
Đáp án D
27.35
Trong dung dịch K2Cr2O7 tồn tại cân bằng:
Cr2O72- (da cam) + H2O \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) 2CrO42- (vàng) + 2H+
Cho vài giọt dung dịch chất X vào dung dịch K2Cr2O7 thì dung dịch chuyển dần từ màu da cam sang màu vàng. Chất phù hợp với X là
A. K2SO4 B. H2SO4 C. KCl D. KOH
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại chuyển tiếp dãy thứ nhất.
Lời giải chi tiết:
Để chuyển từ màu da cam sang màu vàng khi K2Cr2O7 tác dụng với dung dịch kiềm KOH.
Đáp án D
27.36
hãy chọn đúng sai cho mỗi ý a,b,c,d ở các câu 27.36 – 27.37
a. nguyên tố chromium thuộc chu kì 4, nhóm vib trong bảng tuần hoàn
b. chromium là kim loại nhe, có nhiệt độ nóng chảy thấp
c. chromium là kim loại chuyển tiếp dãy thứ nhất
d. nguyên tử chromium có số oxi hóa cao nhất là +3 trong các hợp chất
Phương pháp giải:
Dựa vào vị trí của kim loại chuyển tiếp dãy thứ nhất.
Lời giải chi tiết:
a. đúng
b. sai, cr là kim loại nặng, có nhiệt độ nóng chảy cao.
c. đúng
d. sai, cr có số oxi hóa +6 trong các hợp chất.
27.37
Tiến hành các thí nghiệm xác định hàm lượng iron (ii) sulfate bằng phương pháp chuẩn độ thuốc tím trong môi trường sulfuric acid loãng, dư
a. thuốc tím phải cho vào burette, không được cho vào bình tam giác
b. cần sử dụng chất chỉ thị để nhận biết điểm kết thúc chuẩn độ
c. iron (ii) sulfate là chất khử, thuốc tím là chất oxi hóa.
d. phải đun nóng dung dịch trong bình tam giác trước khi chuẩn độ
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại chuyển tiếp dãy thứ nhất.
Lời giải chi tiết:
a. đúng
b. không cần sử dụng chất chỉ thị vì iron (ii) sulfate có khả năng làm mất màu kmno4, để xác định điểm kết thúc chuẩn độ chỉ cần 1 giọt dư kmno4.
c. đúng
d. không cần đun nóng trong bình tam giác, vì phản ứng xảy ra ở nhiệt độ thường.
27.38
Tiến hành thí nghiệm theo các bước sau:
Bước 1: Dùng pipette hút chính xác 5ml dung dịch FeSO4 nồng độ a mol/L cho vào bình định mức loại 50mL. Thêm tiếp nước cất và định mức đến vạch, thu được 50mL dung dịch Y.
Bước 2: Chuẩn độ 10ml dung dịch Y trong môi trường H2SO4 loãng cần vừa đủ 8,8ml dung dịch KMnO4 0,02M. giá trị của a là bao nhiêu?
Phương pháp giải:
Dựa vào phương pháp chuẩn độ.
Lời giải chi tiết:
n KMnO4 = \(8,{8.10^{ - 3}}.0,02 = 0,{176.10^{ - 3}}mol\)
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
0,88.10-4 ←0,176.10-3
CM FeSO4 = \(\frac{{0,{{88.10}^{ - 4}}}}{{{{10.10}^{ - 3}}}} = 0,88M\)
27.39
Ở 20oC, độ tan của CuSO4.5H2O trong nước là 32g trong 100g nước. Ở nhiệt độ này, dung dịch CuSO4 bão hòa có nồng độ là a%. Giá trị của a là bao nhiêu?
Phương pháp giải:
Dựa vào công thức tính nồng độ C%.
Lời giải chi tiết:
Khối lượng CuSO4.5H2O trong 100g nước là: 32g
n CuSO4.5H2O = 32 : 250 = 0,128 mol
n CuSO4.5H2O = n CuSO4 = 0,128 mol
C%CuSO4 = \(\frac{{0,128.160}}{{32 + 100}}.100 = 15,51\% \)
27.40
Ở điều kiên thường, tinh thể Fe có khối lượng riêng bằng 7,87g/cm3. Giả thiết các nguyên tử Fe là những hình cầu chiếm 68% thể tích tinh thể, phần còn lại là khe rỗng.
Cho biết: công thức tính thể tích hình cầu V = \(\frac{4}{3}\pi {r^3}\)
Số Avogadro NA = 6,022.1023 và số pi π = 3,1416
Bán kính nguyên tử Fe là bao nhiêu pm?
Phương pháp giải:
Dựa vào công thức tính thể tích hình cầu.
Lời giải chi tiết:
Trong 1 cm3 tinh thể kim loại Fe thì các quả cầu kim loại chiếm thể tích 0,68 cm3 và có khối lương 7,87g. Số khối Fe = 55,85
Số quả cầu kim loại = 6,022.1023.\(\frac{{7,87}}{{55,85}}\)= 0,8487.1023 = 0,08487.1024
Tổng thể tích các quả cầu kim loại: \(\frac{4}{3}\pi .{r^3}.0,{08487.10^{24}} = 0,68(c{m^3})\)
→ r = 1,24.10-8 cm = 124pm
27.41
Dung dịch FeCl3 có môi trường acid do sự thủy phân của ion Fe3+ theo phản ứng đơn giản hóa:
Fe3+ (aq) + H2O (l) [Fe(OH)]2+ (aq) + H+(aq) Ka = 10-2,19
Gía trị pH của dung dịch FeCl3 0,1M là
A. 2,19 B.1,66 C. 0,22 D. 1,22
Phương pháp giải:
Dựa vào công thức tính KC.
Lời giải chi tiết:
Fe3+ (aq) + H2O (l) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) [Fe(OH)]2+ (aq) + H+(aq)
Trước phản ứng: 0,1 0 0
Phản ứng: a → a a
Cân bằng: 0,1 – a a a
\(\begin{array}{l}{K_a} = \frac{{{\rm{[[Fe(OH)}}{{\rm{]}}^{2 + }}{\rm{]}}{\rm{.[}}{{\rm{H}}^ + }{\rm{]}}}}{{{\rm{[}}F{e^{3 + }}{\rm{]}}}} = {10^{ - 2,19}}\\ \to \frac{{a.a}}{{(0,1 - a)}} = {10^{ - 2,19}} \to a = 0,022M\end{array}\)
[H+] = 0,022M → pH = - log ([H+]) = - log(0,022) = 1,66
Đáp án B
27.42
Cân bằng được duy trì ở pH = 6
Cr2O72- (da cam) + H2O \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) 2CrO42- (vàng) + 2H+ KC = 10-15,2
Phần trăm lượng Cr2O72- ban đầu đã chuyển hóa thành CrO42- là
A. 4,2% B. 3,1% C. 3,9% D. 4,8%
Phương pháp giải:
Dựa vào tính chất của kim loại chuyển tiếp dãy thứ nhất
Lời giải chi tiết:
Giả sử nồng độ của \(C{r_2}O_7^{2 - }\)là 0,1M
Cr2O72- (da cam) + H2O \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) 2CrO42- (vàng) + 2H+
Trước phản ứng: 0,1 0 10-6
Phản ứng: x 2x 10-6
Cân bằng: 0,1 – x 2x 10-6
KC = \(\frac{{{{{\rm{[}}CrO_4^{2 - }{\rm{]}}}^2}.{{{\rm{[}}{H^ + }{\rm{]}}}^2}}}{{{\rm{[}}C{r_2}O_7^{2 - }{\rm{]}}}} = {10^{ - 15,2}}\)
→\(\frac{{{{(2x)}^2}.{{({{10}^{ - 6}})}^2}}}{{(0,1 - x)}} = {10^{ - 15,2}} \to x = 3,{9.10^{ - 3}}\)
Phần trăm \(C{r_2}O_7^{2 - }\)đã chuyển hóa = \(\frac{{3,{{9.10}^{ - 3}}}}{{0,1}}.100\% = 3,9\% \)
Đáp án C
27.43
Khi làm lạnh dung dịch FeCl3 thu được tinh thể FeCl3.6H2O. Cho độ tan của FeCl3.6H2O trong nước ở một số nhiệt độ như sau:
|
Nhiệt độ |
0 |
20 |
30 |
|
Độ tan |
74,4 |
91,8 |
106,8 |
Dung dịch bão hòa của FeCl3 ở 0oC có nồng độ phần trăm là
A. 22,2% B. 17.4% C. 18,2% D. 25,6%
Phương pháp giải:
Dựa vào công thức tính C%.
Lời giải chi tiết:
FeCl3 + 6H2O → FeCl3.6H2O
Độ tan của FeCl3.6H2O ở 0oC là 74,4g
n FeCl3.6H2O = \(\frac{{74,4}}{{270,5}} = 0,275mol\)→ n FeCl3 = 0,275 mol → m FeCl3 = 0,275.162,5 = 45g
C% = \(\frac{{45}}{{74,4 + 100}}.100\% = 25,6\% \)
Đáp án D
27.44
Thuốc tím dễ bị phân hủy khi bảo quản nên trước khi sử dụng thuốc tím pha sẵn cần xác định lai nồng độ bằng cách chuẩn độ với dung dịch H2C2O4. Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cân chinh xác lượng oxalic acid ngậm nước (H2C2O4.2H2O, M =126,07) để pha chế được 100ml dung dịch H2C2O4 có nồng độ chuẩn 0,05M
Bước 2: Dùng pipette hút 5ml dung dịch H2C2O4 vừa pha chế cho vào bình tam giáC. Chuyển dung dịch KMnO4 nồng độ a.10-2mol/L vào burette rồi tiến hành chuẩn độ đến khi dung dịch trong bình tam giác có màu hồng nhạt bền khoảng 10 giây thì vừa hết 5,1mL. Giá trị của a là
A. 2,04 B. 1,84 C. 2,12 D. 1,96
Phương pháp giải:
Dựa vào Phương pháp chuẩn độ.
Lời giải chi tiết:
n H2C2O4 = 0,05.100.10-3 = 5.10-3 mol
n H2C2O4 đem chuẩn độ là: = 5.10-3.0,05 = 2,5.10-4 mol
5H2C2O4 + 2KMnO4 + 3H2SO4 → 10CO2 + K2SO4 + 2MnSO4 + 8H2O
2,5.10-4 → 10-4
Nồng độ dung dịch KMnO4 = \(\frac{{{{10}^{ - 4}}}}{{5,{{1.10}^{ - 3}}}} = 1,{96.10^{ - 2}}M\)
Đáp án D
27.45
Ở điều kiện thường, tinh thể K và tinh thể Cr đều có cấu trúc lập phương tâm khối. Biết một số thông số của kim loại K và Cr được cho ở bảng sau:
|
Tính chất |
K |
Cr |
|
Bán kính nguyên tử (pm) |
227 |
128 |
|
Nhiệt độ nóng chảy (oC) |
63,3 |
1900 |
|
Khối lượng riêng (g/cm3) |
0,862 |
7,19 |
|
Độ cứng (kim cương – 10) |
0,5 |
8,5 |
a. Tinh thể Cr có liên kết kim loại mạnh hơn tinh thể K
b. Trong cùng một đơn vị thể tích thì khối lượng kim loại trong tinh thể Cr và K bằng nhau
c. Nguyên tử Cr có bán kính nhỏ hơn nguyên tử K vì nguyên tử Cr có số lớp electron ít hơn.
d. K là kim loại nhẹ và Cr là kim loại nặng
Phương pháp giải:
Dựa vào tính chất vật lí của tinh thể K và Cr.
Lời giải chi tiết:
a. đúng vì tinh thể cr có liên kết kim loại mạnh hơn tinh thể k vì đều có cùng cấu trúc tinh thể nhưng lại có nhiệt độ nóng chảy và độ cứng cao hơn.
b. sai vì tinh thể cr có khối lượng riêng lớn hơn tinh thể k nên khối lượng kim loại nhiều hơn
c. sai vì nguyên tử cr và nguyên tử k đều có 4 lớp electron nhưng nguyên tử cr có điện tích hạt nhân lớn hơn.
d. đúng vì kim loại nhẹ (d < 5g/cm3) và Cr là kim loại nặng
27.46
Tinh thể Cu có cấu trúc lập phương tâm mặt với cạnh của hình lập phương là 361pm như mô tả trong hình vẽ bên ( biết Cu = 63,54amu, 1amu=1,66.10-24 g)
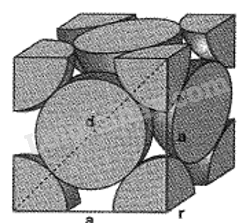
a. bán kính của nguyên tử cu là 128pm
b. tổng số nguyên tử cu có trong một hình lập phương trên bằng 6
c. khối lượng riêng của tinh thể cu là 8,96g/cm3
d. các quả cầu cu chiếm 74% thể tích trong tinh thể.
Phương pháp giải:
Dựa vào cấu trúc tinh thể.
Lời giải chi tiết:
a, đúng vì:
độ dài đường chéo hình vuông bằng 4 lần bán kính: d = a√2 = 4r
→ r = \(\frac{{a\sqrt 2 }}{4} = \frac{{361pm\sqrt 2 }}{4} = 128pm\)
b. sai vì trong mỗi hình lập phương, mỗi nguyên tử cu ở đỉnh đóp góp 1/8 thể tích, mỗi nguyên tử ở mặt đóng góp ½ thể tích.
tổng số nguyên tử cu = \(\frac{1}{8}.8 + \frac{1}{2}.6 = 4\)nguyên tử
c. đúng vì:
khối lượng riêng =
d = \(\frac{{63,54.4.1,{{66.10}^{ = 24}}}}{{{{(3,{{61.10}^{ - 8}})}^3}}} = \frac{{63,54.4.1,66}}{{3,{{61}^3}}} = 8,97g/c{m^3}\)
d. đúng vì
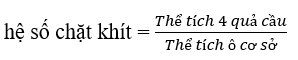
\(\rho = \frac{{4.(\frac{4}{3})\pi {r^3}}}{{{a^3}}} = \frac{{4.(\frac{4}{3})\pi .{{(\frac{{a\sqrt 2 }}{4})}^3}}}{{{a^3}}} = \frac{{\pi \sqrt 2 }}{6} = 0,74 = 74\% \)
27.47
Theo QCVN 01-1:2018/BYT, hàm lượng sắt tối đa cho phép trong nước sinh hoạt là 0,3mg/L. Một mẫu nước có hàm lượng sắt cao gấp 28 lần ngưỡng cho phép, giả thiết sắt trong mẫu nước tồn tại ở dạng Fe2(SO4)3 và FeSO4 với tỉ lệ mol tương ứng là 1:8. Quá trình tách loại sắt trong 10m3 mẫu nước trên được thực hiện bằng cách sử dụng m gam vôi tôi (vừa đủ) để tăng pH, sau đó sục không khí:
Fe2(SO4)3 + Ca(OH)2 → Fe(OH)3 + CaSO4 (1)
FeSO4 + Ca(OH)2 + O2 + H2O → Fe(OH)3 + CaSO4 (2)
Giả thiết vôi tôi chỉ chứa Ca(OH)2. Giá trị của m là bao nhiêu?
Phương pháp giải:
Dựa vào tính chất của nguyên tố kim loại chuyển tiếp dãy thứ nhất.
Lời giải chi tiết:
Khối lượng sắt có trong 10 m3 = 0,3.10000 .28 = 84000mg = 84g
n Fe = 84 : 56 = 1,5 mol
Gọi số mol Fe3+ và Fe2+ lần lượt theo tỉ lệ là a và 8a
Bảo toàn nguyên tố Fe có: n Fe = n Fe2+ + 2n Fe3+
→ 1,5 = 2.a + 8a → a = 0,15 mol
Vậy n Fe2+ = 8.0,15 = 1,2 mol; n Fe3+ = 0,15.2 = 0,3 mol
Fe2(SO4)3 + 3Ca(OH)2 → 2Fe(OH)3 + 3CaSO4 (1)
0,15→ 0,45
4FeSO4 + 4Ca(OH)2 + O2 + 2H2O → 4Fe(OH)3 + 4CaSO4 (2)
1,2 → 1,2
n Ca(OH)2 = 1,65 mol → m Ca(OH)2 = 1,65.74 = 122g
27.48
Các nghiên cứu được thực hiện với một muối carbonate của kim loại M ( hóa trị II)
Nghiên cứu 1: Tiến hành phân tích hàm lượng các nguyên tố, xác định M chiếm 48,2% khối lượng muối
Nghiên cứu 2: Nung nóng muối carbonate tới phản ứng hoàn toàn trong các khí quyển khác nhau:
|
Thí nghiệm |
1 |
2 |
3 |
|
Khí quyển |
N2 |
O2 |
HCl |
Phần trăm chênh lệch giữa khối lượng mẫu chất rắn sau khi nung so với muối ban đầu ở thí nghiệm 2 là a%. Tính a?
Phương pháp giải:
Dựa vào tính chất hóa học của nguyên tố chuyển tiếp.
Lời giải chi tiết:
Gọi công thức muối carbonate là MCO3.
Vì M chiếm 48,2% nên %CO3 = 51,72%
Lập tỉ lệ: \(\frac{{\% M}}{{\% MC{O_3}}} = \frac{M}{{60}} = \frac{{48,28}}{{51,27}} \to M = 56(Fe)\)
Phương trình hóa học xảy ra ở thí nghiệm (2) là: 4FeCO3 + O2 \( \to \) 2Fe2O3 + 4CO2
Chất rắn sau nung là Fe2O3.
Sự chênh lệch khối lượng giữa chất rắn sau nung và muối ban đầu là: \(\frac{{\frac{{{M_{F{e_2}{O_3}}}}}{2} - {M_{FeC{O_3}}}}}{{{M_{FeC{O_3}}}}}.100\% = 31\% \)
27.49
Iron (II)sulfate thường được bảo quản ở dạng muối Mohr màu xanh nhạt có công thức FeSO4.(NH4)2SO4.nH2O
Thực hiện các thí nghiệm sau:
Thí nghiệm 1: Cân 1,96g muối Mohr rồi hòa tan vào nước, sau đó định mức trong bình 50mL. Chuẩn độ 5mL dung dịch vừa pha cần dùng 5mL dung dịch KMnO4 0,02M trong môi trường H2SO4 loãng. Xác định công thức phân tử muối Mohr.
Thí nghiệm 2: Làm lạnh 100g dung dịch muối Mohr bão hòa ở 30oC đến nhiệt độ ổn định ở 0oC thu được m gam muối Mohr kết tinh. Cho độ tan của muối Mohr trong nước ở các nhiệt độ như sau:
|
Nhiệt độ |
0 |
10 |
20 |
30 |
|
Độ tan |
17,2 |
31 |
36,4 |
45 |
Giá trị của m là bao nhiêu?
Phương pháp giải:
Dựa vào các thông tin đề bài cung cấp.
Lời giải chi tiết:
n KMnO4 = 0,02.5.10-3 = 1.10-4 mol
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
5.10-4 mol ←1.10-4 mol
Vì thể tích ban đầu của muối mohr là 50ml, khi chuẩn độ cần dùng 5ml nên tỉ lệ là 1:10.
M muối mohr = \(\frac{{1,96}}{{{{5.10}^{ - 4}}.10}} = 392 \to n = 6\)
Công thức của muối là FeSO4.(NH4)2SO4.6H2O
Ở 30oC, 100g nước hòa tan được 45g muối Mohr → 100g dung dịch có chứa khối lượng muối Mohr là: \(45.\frac{{100}}{{100 + 45}} = 31g\)
Tại 0oC giả sử có x gam muối Mohr kết tinh thì khối lượng phần dung dịch bão hòa còn lại là 100-x gam
Khối lượng muối Mohr có trong (100-x) gam dung dịch bão hòa ở 0oC là: \(x + 17,2.\frac{{100 - x}}{{100}} = 31 \to x = 16,6g\)
Luyện Bài Tập Trắc nghiệm Hóa 12 - Kết nối tri thức - Xem ngay
Các bài khác cùng chuyên mục
- Bài 30. Ôn tập chương 8 trang 113, 114 SBT Hóa 12 Kết nối tri thức
- Bài 29. Một số tính chất và ứng dụng của phức chất trang 108, 109, 110 SBT Hóa 12 Kết nối tri thức
- Bài 28. Sơ lược về phức chất trang 106,107 SBT Hóa 12 Kết nối tri thức
- Bài 27. Đại cương về kim loại chuyển tiếp dãy thứ nhất trang 98, 99, 100 SBT Hóa 12 Kết nối tri thức
- Bài 26. Ôn tập chương 7 trang 93, 94, 95 SBT Hóa 12 Kết nối tri thức
- Bài 30. Ôn tập chương 8 trang 113, 114 SBT Hóa 12 Kết nối tri thức
- Bài 29. Một số tính chất và ứng dụng của phức chất trang 108, 109, 110 SBT Hóa 12 Kết nối tri thức
- Bài 28. Sơ lược về phức chất trang 106,107 SBT Hóa 12 Kết nối tri thức
- Bài 27. Đại cương về kim loại chuyển tiếp dãy thứ nhất trang 98, 99, 100 SBT Hóa 12 Kết nối tri thức
- Bài 26. Ôn tập chương 7 trang 93, 94, 95 SBT Hóa 12 Kết nối tri thức












Danh sách bình luận