Bài 17. Ôn tập chương 5 trang 59, 60 SBT Hóa 12 Kết nối tri thức
Cặp oxi hoá - khử nào sau đây có giá trị thế điện cực chuẩn nhỏ hơn 0?
17.1
Cặp oxi hoá - khử nào sau đây có giá trị thế điện cực chuẩn nhỏ hơn 0?
A. Ag+/Ag. B. Na+/Na. C. Hg2+/Hg. D. Cu2+/Cu.
Phương pháp giải:
Dựa vào giá trị thế điện cực chuẩn của kim loại.
Lời giải chi tiết:
Na+/Na có giá trị điện cực nhỏ hơn 0.
Đáp án B
17.2
Kí hiệu cặp oxi hoá - khử tương ứng với quá trình khử:
Fe(OH)3 + le \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) Fe(OH)2 + OH- là
A. Fe3+/Fe2+. B. Fe2+/Fe. C. Fe3+/Fe. D. Fe(OH)3/Fe(OH)2.
Phương pháp giải:
Dựa vào phản ứng oxi hóa – khử.
Lời giải chi tiết:
Kí hiệu cặp oxi hóa – khử tương ứng với quá trình khử: Fe(OH)3/Fe(OH)2.
Đáp án D
17.3
Trong dãy điện hoá của kim loại, khi đi từ trái sang phải, tính oxi hoá của cảc ion kim loại biến đổi như thế nào?
A. Không đổi. B. Tuần hoàn. C. Giảm dần. D. Tăng dần.
Phương pháp giải:
Dựa vào ý nghĩa của dãy điện hóa.
Lời giải chi tiết:
Khi đi từ trái sang phải, tính oxi hóa của các ion kim loại tăng dần.
Đáp án D
17.4
Trong pin điện hoá Zn - Cu, ở anode (cực âm) xảy ra quá trình
A. oxi hoá Zn thành ion Zn2+. B. khử ion Cu2+ thành Cu.
C. khử Cu thành ion Cu2+. D. oxi hoá ion Zn2+ thành Zn.
Phương pháp giải:
Dựa vào nguyên tắc hoạt động của pin điện hóa.
Lời giải chi tiết:
Trong pin điện hóa Zn – Cu, ở anode xảy ra quá trình oxi hóa của Zn thành ion Zn2+.
Đáp án A
17.5
Khi điện phân dung dịch NaCl bằng dòng điện một chiều (với điện cực trơ, có màng ngăn xốp) thì ở cathode xảy ra quá trình
A. oxi hoá H2O thảnh H+ và O2. B. khử Cl- thành Cl2.
C. oxi hoá Cl- thành Cl2. D. khử H2O thành H2 và OH-.
Phương pháp giải:
Dựa vào nguyên tắc điện phân dung dịch.
Lời giải chi tiết:
Khi điện phân dung dịch NaCl bằng dòng điện một chiều, ở cathode (điện cực âm) xảy ra quá trình khử H2O thành H2 và OH- vì Na+ không bị khử.
Đáp án D
17.6
Khi điện phân dung dịch CuSO4 bằng dòng điện một chiều (với điện cực anode bằng Cu) thì ở anode xảy ra quá trình
A. oxi hoá H2O thành H+ và O2. B. khử Cu2+ thành Cu.
C. oxi hoá Cu thành Cu2+. D. khử H2O thành H2 và OH-.
Phương pháp giải:
Dựa vào điện phân dung dịch.
Lời giải chi tiết:
Tại anode (điện cực dương) SO42- không bị oxi hóa, ở đó xảy ra quá trình oxi hóa Cu thành Cu2+ vì điện cực anode làm bằng Cu.
Đáp án C
17.7
Trong nước, thế điện cực chuẩn của kim loại Mn+/M càng lớn thì dạng khử có tính khử ...(1)... và dạng oxi hoá có tính oxi hoá ...(2)... Cụm từ cần điền vào (1) và (2) lần lượt là
A. càng mạnh và càng yếu. B. càng mạnh và càng mạnh.
C. càng yếu và càng yếu. D. càng yếu và càng mạnh.
Phương pháp giải:
Dựa vào cặp oxi hóa – khử của kim loại.
Lời giải chi tiết:
(1) càng yếu, (2) càng mạnh.
Đáp án D
17.8
Cho thứ tự sắp xếp các cặp oxi hoá - khử trong dãy điện hoá: Mg2+/Mg; H2O/H2, OH-; 2H+/H2; Ag+/Ag.
Thí nghiệm nào sau đây không xảy ra phản ứng ở điều kiện chuẩn?
A. Cho sợi phoi bào Mg vào nước. B. Cho lá Mg vào dung dịch HC1.
C. Cho lá Ag vào dung dịch H2SO4. D. Cho sợi Mg vào dung dịch AgNO3.
Phương pháp giải:
Dựa vào ý nghĩa của giá trị thế điện cực chuẩn.
Lời giải chi tiết:
Vì Ag+/Ag đứng sau 2H+/H2 nên không khử được H+ trong acid.
Đáp án C
17.9
Xét phản ứng hoá học giữa hai cặp oxi hoá - khử của kim loại:
R + 2M+ --> R2+ + 2M
Biết giá trị thế điện cực chuẩn các cặp oxi hoá - khử M+/M và R2+/R lần lượt là x (V) và y (V). Nhận xét nào sau đây đúng?
A. x < y. B. x > y. C. x - y. D. 2x = y.
Phương pháp giải:
Dựa vào giá trị thế điện cực chuẩn của kim loại.
Lời giải chi tiết:
Vì R khử được M+ nên giá trị thế điện cực của M+/M lớn hơn R2+/R nên y > x.
Đáp án A
17.10
Cho phản ứng hoá học: Cu + 2Fe3+ \( \to \) Cu2+ + 2Fe2+.
Phát biểu nào sau đây về phản ứng trên không đúng?
A. Cu bị Fe3+ oxi hoá thành Cu2+.
B. Cu2+ có tính oxi hoá mạnh hơn Fe3+.
C. Fe3+ bị Cu khử thành Fe2+.
D. Cu là chất khử, Fe3+ là chất oxi hoá.
Phương pháp giải:
Dựa vào ý nghĩa của giá trị thế điện cực chuẩn của kim loại.
Lời giải chi tiết:
Vì có xảy ra phản ứng oxi hóa – khử nên \(E_{C{u^{2 + }}/Cu}^o < E_{F{e^{3 + }}/Fe}^o\)nên Cu2+ có tính oxi hóa mạnh hơn Fe3+.
Đáp án B
17.11
Cho các cặp oxi hoá - khử và thế điện cực chuẩn tương ứng:
|
Cặp oxi hóa – khử |
Na+/Na |
Mg2+/Mg |
Al3+/A1 |
Cu2+/Cu |
|
Thể điện cực chuẩn (V) |
-2,713 |
-2,356 |
-1,676 |
+0,340 |
lon kim loại nào sau đây bị khử tại cathode khi điện phân (với điện graphite) dung dịch muối sulfate tương ứng?
A. Mg2+. B. Na+. C. Cu2+. D. Al3+.
Phương pháp giải:
Dựa vào ý nghĩa của giá trị thế điện cực chuẩn của kim loại.
Lời giải chi tiết:
Khi điện phân dung dịch, tại cathode xảy ra quá trình khử Cu2+ +2e \( \to \)Cu.
Đáp án C
17.12
Hãy chọn đúng hoặc sai cho mỗi ý a, b, c, d của các câu 17.12 - 17.13.
Ở điều kiện chuẩn, cho bột Cu dư vào dung dịch Fe2(SO4)3 tới khi phản ứng hoàn toàn, thu được chất rắn X và dung dịch Y
Cho biết:
|
Cặp oxi hoá - khử |
Fe2+/Fe |
Cu2+/Cu |
Fe3+/Fe2+ |
|
Thế điện cực chuẩn (V) |
-0,44 |
+0,340 |
+0,771 |
a) X gồm hai kim loại.
b) Cu có tính khử mạnh hơn Fe2+ ở điều kiện chuẩn.
c) Y gồm hai chất tan là CuSO4 và FeSO4.
d) Trong điều kiện Fe2(SO4)3 dư thì Y gồm ba muối.
Phương pháp giải:
Dựa vào giá trị thế điện cực chuẩn của kim loại.
Lời giải chi tiết:
Khi cho bột Cu dư vào dung dịch Fe2(SO4)3 xảy ra phản ứng sau: Cu + 2Fe3+ \( \to \)Cu2+ + 2Fe2+
Dung dịch Y gồm: CuSO4 và FeSO4.
Chất rắn X là Cu.
a) Sai vì X chỉ có kim loại Cu dư.
b) Đúng
c) Đúng
d) Đúng
17.13
a) Kim loại càng mạnh thì thế điện cực chuẩn càng âm.
b) Khi tạo thành pin điện hoá, kim loại mạnh hơn sẽ đóng vai trò là cathode.
c) Điện phân dung dịch CuSO4, cứ thu được 1 moi Cu thì khối lượng dung dịch giảm 80 g.
d) Để bảo vệ đồ vật bằng kim loại, nên gắn chúng với những mảnh kim loại yếu hơn.
Phương pháp giải:
Dựa vào ứng dụng của điện phân.
Lời giải chi tiết:
a) Đúng;
b) Sai vì khi tạo thành pin điện hoá, kim loại mạnh hơn sẽ đóng vai trò là anode.
c) Đúng;
d) Sai vì để bảo vệ đồ vật bằng kim loại, nên gắn chúng với những mảnh kim loại mạnh hơn.
17.14
Hãy chọn đúng hoặc sai cho mỗi ý a, b, c, d của câu sau.
Xét quá trình hoạt động của một pin điện hoá Cu – Ag được thiết lập ở các điều kiện như hình vẽ bên.
Cho thế điện cực chuẩn của các cặp Cu2+/Cu và Ag+/Ag lần lượt là +0,340 V vả +0,799 V.
a) Giá trị sức điện động chuẩn của pin điện hoá trên là 0,459 V.
b) Ở anode xảy ra quá trình oxi hoá Cu, ở cathode xảy ra quá trình khử Ag+.
c) Điện cực Cu tăng khối lượng, điện cực Ag giảm khối lượng.
d) Phản ứng hoá học xảy ra trong pin: Cu + 2Ag+\( \to \) Cu2+ + 2Ag.
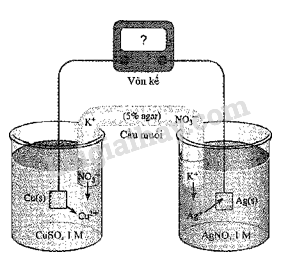
Phương pháp giải:
Dựa vào nguyên tắc của pin điện.
Lời giải chi tiết:
a) Đúng;
b) Đúng;
c) Sai vì điện cực Cu giảm khối lượng, điện cực Ag tăng khối lượng;
d) Đúng.
17.15
Một pin Galvani được lắp ghép từ hai điện cực tạo bởi hai cặp oxi hoá - khử là Pb2+/Pb (Epb2+/pb = - 0,126 v) và Fe3+/Fe2+ (EFe3+/Fe2+ = +0,771 v).
Sức điện động chuẩn của pin Galvani trên là bao nhiêu vôn? (Làm tròn kết quả đến phần trăm).
Phương pháp giải:
Dựa vào công thức tính sức điện động của pin.
Lời giải chi tiết:
\(E_{pin}^o = E_{catho{\rm{d}}e}^o - E_{an{\rm{od}}e}^o = 0,771 - ( - 0,126) = 0,897V \approx 0,9V\)
17.16
Sức điện động chuẩn của một pin Galvani (được lắp ghép từ hai điện cực tạo bởi hai cặp oxi hoá - khử là 2H+/H2 và Ag+/Ag) đo được bằng vôn kế có điện trở vô cùng lớn là 0,771 V.
Từ kết quả trên, xác định được thế điện cực chuẩn của cặp Ag+/Ag là bao nhiêu vôn? (Làm tròn kết quả đến phần trăm).
Phương pháp giải:
Dựa vào công thức tính sức điện động của pin.
Lời giải chi tiết:
\(E_{pin}^o = E_{catho{\rm{d}}e}^o - E_{an{\rm{od}}e}^o = 0,771 + 0 = 0,771 \approx 0,78V\)
17.17
Điện phân 2 lít dung dịch NaCl 0,5 M với điện cực trơ, màng ngăn xốp bằng dòng điện có cường độ không đổi 0,2 A. Sau 1 930 giây thì dừng điện phân, thu được dung dịch X (giả thiết thể tích dung dịch không đổi). Dung dịch X có pH bằng bao nhiêu?
Phương pháp giải:
Dựa vào định luật Faraday.
Lời giải chi tiết:
Áp dụng định luật Faraday ta có:
\({n_e} = \frac{{I.t}}{{96500}} = \frac{{0,2.1930}}{{96500}} = 0,004mol\)
|
Tại cực âm |
Tại cực dương |
|
2H2O + 2e\( \to \)2OH- + H2 |
2Cl-\( \to \)Cl2 + 2e 0,02 \( \leftarrow \)0,004 |
2NaCl + 2H2O --> 2NaOH + Cl2 + H2
0,004 0,002 (mol)
CM NaOH = \(\frac{{0,004}}{2} = 0,002M \to pOH = 2,7 \to pH = 14 - 2,7 = 11,3\)
Luyện Bài Tập Trắc nghiệm Hóa 12 - Kết nối tri thức - Xem ngay
Các bài khác cùng chuyên mục
- Bài 30. Ôn tập chương 8 trang 113, 114 SBT Hóa 12 Kết nối tri thức
- Bài 29. Một số tính chất và ứng dụng của phức chất trang 108, 109, 110 SBT Hóa 12 Kết nối tri thức
- Bài 28. Sơ lược về phức chất trang 106,107 SBT Hóa 12 Kết nối tri thức
- Bài 27. Đại cương về kim loại chuyển tiếp dãy thứ nhất trang 98, 99, 100 SBT Hóa 12 Kết nối tri thức
- Bài 26. Ôn tập chương 7 trang 93, 94, 95 SBT Hóa 12 Kết nối tri thức
- Bài 30. Ôn tập chương 8 trang 113, 114 SBT Hóa 12 Kết nối tri thức
- Bài 29. Một số tính chất và ứng dụng của phức chất trang 108, 109, 110 SBT Hóa 12 Kết nối tri thức
- Bài 28. Sơ lược về phức chất trang 106,107 SBT Hóa 12 Kết nối tri thức
- Bài 27. Đại cương về kim loại chuyển tiếp dãy thứ nhất trang 98, 99, 100 SBT Hóa 12 Kết nối tri thức
- Bài 26. Ôn tập chương 7 trang 93, 94, 95 SBT Hóa 12 Kết nối tri thức













Danh sách bình luận