Đề thi giữa kì 1 KHTN 7 Chân trời sáng tạo - Đề số 13
Đề thi giữa kì 1 - Đề số 13
Đề bài
Nguyên tử X có 26 proton trong hạt nhân. Cho các phát biểu sau về X:
(1) X có 26 neutron trong hạt nhân. (2) X có 26 electron ở vỏ nguyên tử.
(3) X có điện tích hạt nhân là +26. (4) Khối lượng nguyên tử X là 26 amu.
Trong các phát biểu trên, số phát biểu đúng là:
-
A.
2
-
B.
1
-
C.
3
-
D.
4
Năm 1911, Rơ-đơ-pho (E. Rutherford) và các cộng sự đã dùng các hạt α bắn phá lá vàng mỏng và dùng màn huỳnh quang đặt sau lá vàng để theo dõi đường đi của các hạt α. Kết quả thí nghiệm đã rút ra các kết luận về nguyên tử như sau:
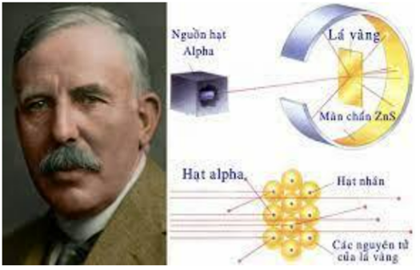
(1) Nguyên tử có cấu tạo rỗng.
(2) Hạt nhân nguyên tử có kích thước rất nhỏ so với kích thước nguyên tử.
(3) Hạt nhân nguyên tử mang điện tích âm.
(4) Xung quanh nguyên tử là các electron chuyển động tạo nên lớp vỏ nguyên tử.
Số kết luận sai là:
-
A.
2
-
B.
3
-
C.
4
-
D.
1
Cho nguyên tử X có tổng số hạt là 28, trong đó số hạt không mang điện nhiều hơn số hạt mang điện dương là 1 hạt. Số electron của nguyên tử X là:
-
A.
9
-
B.
10.
-
C.
11
-
D.
14.
Cách viết 2Fe, 3Al lần lượt chỉ ý gì?
-
A.
Hai nguyên tử iron, ba nguyên tử alumium.
-
B.
Hai phân tử iron và ba nguyên tử alumium.
-
C.
Hai phân tử iron và ba phân tử alumium.
-
D.
Hai nguyên tử iron và ba phân tử alumium.
Kí kiệu hóa học nào sau đây viết sai?
-
A.
NA.
-
B.
Fe.
-
C.
K.
-
D.
Al.
Nguyên tử của nguyên tố X có 3 lớp electron, lớp electron ngoài cùng có 2 electron. Vị trí của nguyên tố X là
-
A.
chu kỳ 3, nhóm IIA.
-
B.
chu kỳ 3, nhóm VIA.
-
C.
chu kỳ 2, nhóm IIIA.
-
D.
chu kỳ 2, nhóm VIA.
Trong một chu kì, khi đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân:
-
A.
Mở đầu chu kì là một kim loại điển hình (trừ chu kì 1), cuối chu kì là một phi kim điển hình (trừ chu kì 7) và kết thúc chu kì là một khí hiếm.
-
B.
Mở đầu chu kì là một phi kim điển hình (trừ chu kì 7), cuối chu kì là một kim loại điển hình (trừ chu kì 1) và kết thúc chu kì là một khí hiếm.
-
C.
Mở đầu chu kì là một phi kim điển hình (trừ chu kì 7), cuối chu kì là một khí hiếm và kết thúc chu kì là một kim loại điển hình (trừ chu kì 1).
-
D.
Mở đầu chu kì là một kim loại điển hình (trừ chu kì 1), cuối chu kì là một khí hiếm và kết thúc chu kì là một phi kim điển hình (trừ chu kì 7).
Biết vị trí nguyên tử X như sau: có 3 lớp electron, lớp ngoài cùng có 5 electron. Dựa vào bảng tuần hoàn thì nguyên tố X là
-
A.
Phosphorus.
-
B.
Chlorine.
-
C.
Nitrogen.
-
D.
Sulfur.
Hợp chất Ba(NO3)y có khối lượng phân tử là 261 amu. Giá trị của y là
-
A.
4
-
B.
3
-
C.
2
-
D.
1
Trong các chất sau, dãy nào gồm đơn chất kim loại?
-
A.
Al, Fe, C, P.
-
B.
Mg, Na, H2, O2.
-
C.
Al, Fe, Mg, Na.
-
D.
Al, Mg, C, H2.
Chất nào sau đây là hợp chất?
-
A.
khí Nitrogen do nguyên tố N tạo nên.
-
B.
kim loại copper do nguyên tố Cu tạo nên.
-
C.
ethanol do 3 nguyên tố C, H và O tạo nên.
-
D.
khí Fluorine do nguyên tố F tạo nên.
Số electron ở lớp ngoài cùng của nguyên tử K và F lần lượt là 1 và 7. Hãy cho biết khi K kết hợp với F để tạo thành phân tử potassium fluoride, nguyên tử K cho hay nhận bao nhiêu electron?
-
A.
cho đi 1 electron ở lớp ngoài cùng.
-
B.
nhận thêm 1 electron.
-
C.
cho đi 7 electron.
-
D.
nhận thêm 7 electron.
Có các phát biểu sau:
a) Trong hợp chất, kim loại luôn nhường electron, phi kim luôn nhận electron.
b) Để có 8 electron ở lớp vỏ ngoài cùng thì nguyên tử aluminium hoặc nhường 3 electron hoặc nhận 5 electron.
c) Liên kết trong hợp chất tạo bởi magnesium và chlorine là liên kết ion.
d) Khi tạo liên kết hóa học, nguyên tử chlorine chỉ tạo ion âm bằng cách nhận thêm 1 electron.
Số phát biểu đúng là:
-
A.
2
-
B.
3
-
C.
1
-
D.
4
Nguyên tử K kết hợp với nguyên tử Cl tạo thành phân tử potassium chloride. Ở điều kiện thường potassium chloride là chất
-
A.
rắn.
-
B.
lỏng.
-
C.
khí.
-
D.
dung dịch.
Nguyên tố X có hóa trị III, công thức hợp chất của X với nhóm SO4 (có hóa trị II) là
-
A.
X2(SO4)3
-
B.
XSO4
-
C.
X(SO4)3
-
D.
X3SO4
Hợp chất A trong phân tử gồm có 1X, 1S, 4O liên kết với nhau, biết X có khối lượng nguyên tử 40 amu. Công thức hóa học của A là
-
A.
CaSO4
-
B.
CuSO4
-
C.
FeSO4
-
D.
MgSO4
Hợp chất (X) tạo bởi 2 nguyên tố potassium K và oxygen O có khối lượng phân tử bằng 94 amu, trong đó potassium K chiếm 82,98% về khối lượng. Công thức hóa học của hợp chất (X) là
-
A.
K2O
-
B.
KO
-
C.
KO2
-
D.
K3O
Liên kết cộng hóa trị là liên kết
-
A.
được tạo nên giữa 2 nguyên tử bằng một hay nhiều cặp electron chung.
-
B.
trong đó cặp electron chung bị lệch về một nguyên tử.
-
C.
được hình thành do sự dùng chung electron của 2 nguyên tử khác nhau.
-
D.
giữa các phi kim với nhau.
Khối lượng của phân tử Phosphoric acid H3PO4 là
-
A.
48 amu.
-
B.
86 amu.
-
C.
96 amu.
-
D.
98 amu.
Kim cương là một trong hai dạng thù hình được biết đến nhiều nhất của carbon, dạng còn lại đó là than chì. Kim cương có độ cứng cao và khả năng quang học cực tốt và chúng được ứng dụng trong các ngành công nghiệp và đặc biệt những viên kim cương chất lượng tốt nhất được sử dụng trong ngành kim hoàn với giá trị kinh tế rất cao. Nguyên tử của nguyên tố carbon có số hiệu nguyên tử là 6 và số khối là 12. Tổng số hạt proton, electron và neutron trong nguyên tử carbon là:
-
A.
18
-
B.
28.
-
C.
11.
-
D.
8.
Quãng đường di chuyển có quan hệ như thế nào với thời gian khi tốc độ không đổi?
-
A.
Tăng tuyến tính với thời gian
-
B.
Giảm tuyến tính với thời gian
-
C.
Không phụ thuộc vào thời gian
-
D.
Cả A và B
Công cụ nào có thể dùng để đo tốc độ của xe máy?
-
A.
Đồng hồ bấm giờ
-
B.
Thước đo
-
C.
Tốc kế
-
D.
La bàn
Nếu quãng đường di chuyển của một người đi bộ trong 30 phút là 2 km, tốc độ trung bình của người đó là bao nhiêu?
-
A.
1 km/h
-
B.
2 km/h
-
C.
3 km/h
-
D.
4 km/h
Một chiếc xe đi từ A đến B trong 4 giờ với tốc độ 80 km/h. Quãng đường từ A đến B là:
-
A.
160 km
-
B.
200 km
-
C.
320 km
-
D.
400 km
Khi xe di chuyển nhanh, thì lực tác dụng lên người lái trong trường hợp tai nạn:
-
A.
Giảm đi
-
B.
Không thay đổi
-
C.
Tăng lên
-
D.
Không phụ thuộc vào tốc độ
Lời giải và đáp án
Nguyên tử X có 26 proton trong hạt nhân. Cho các phát biểu sau về X:
(1) X có 26 neutron trong hạt nhân. (2) X có 26 electron ở vỏ nguyên tử.
(3) X có điện tích hạt nhân là +26. (4) Khối lượng nguyên tử X là 26 amu.
Trong các phát biểu trên, số phát biểu đúng là:
-
A.
2
-
B.
1
-
C.
3
-
D.
4
Đáp án : A
Dựa vào thành phần nguyên tử.
Vì p = e nên X có 26 electron ở vỏ nguyên tử và X có điện tích hạt nhân là +26.
Đáp án A
Năm 1911, Rơ-đơ-pho (E. Rutherford) và các cộng sự đã dùng các hạt α bắn phá lá vàng mỏng và dùng màn huỳnh quang đặt sau lá vàng để theo dõi đường đi của các hạt α. Kết quả thí nghiệm đã rút ra các kết luận về nguyên tử như sau:

(1) Nguyên tử có cấu tạo rỗng.
(2) Hạt nhân nguyên tử có kích thước rất nhỏ so với kích thước nguyên tử.
(3) Hạt nhân nguyên tử mang điện tích âm.
(4) Xung quanh nguyên tử là các electron chuyển động tạo nên lớp vỏ nguyên tử.
Số kết luận sai là:
-
A.
2
-
B.
3
-
C.
4
-
D.
1
Đáp án : A
Dựa vào thành phần nguyên tử.
1. Đúng
2. Đúng
3. Sai, hạt nhân nguyên tử mang điện tích dương.
4. sai, vì xung quanh nguyên tử có các lớp vỏ nguyên tử, trên các lớp vỏ có các electron chuyển động.
Đáp án A
Cho nguyên tử X có tổng số hạt là 28, trong đó số hạt không mang điện nhiều hơn số hạt mang điện dương là 1 hạt. Số electron của nguyên tử X là:
-
A.
9
-
B.
10.
-
C.
11
-
D.
14.
Đáp án : A
Dựa vào thành phần nguyên tử.
Ta có: P + N + E = 28.
N = P + 1
P = E
\( \to \)P = E = 9; N = 10
Vậy số electron của X là 9.
Đáp án A
Cách viết 2Fe, 3Al lần lượt chỉ ý gì?
-
A.
Hai nguyên tử iron, ba nguyên tử alumium.
-
B.
Hai phân tử iron và ba nguyên tử alumium.
-
C.
Hai phân tử iron và ba phân tử alumium.
-
D.
Hai nguyên tử iron và ba phân tử alumium.
Đáp án : A
Dựa vào kí hiệu hóa học.
Cách viết 2Fe, 3Al lần lượt chỉ hai nguyên tử iron, ba nguyên tử alumium.
Đáp án A
Kí kiệu hóa học nào sau đây viết sai?
-
A.
NA.
-
B.
Fe.
-
C.
K.
-
D.
Al.
Đáp án : A
Dựa vào kí hiệu hóa học.
NA là kí hiệu viết sai, cách viết đúng là Na.
Đáp án A
Nguyên tử của nguyên tố X có 3 lớp electron, lớp electron ngoài cùng có 2 electron. Vị trí của nguyên tố X là
-
A.
chu kỳ 3, nhóm IIA.
-
B.
chu kỳ 3, nhóm VIA.
-
C.
chu kỳ 2, nhóm IIIA.
-
D.
chu kỳ 2, nhóm VIA.
Đáp án : A
Dựa vào bảng tuần hoàn hóa học.
Chu kì = số lớp electron.
Nhóm = số electron lớp ngoài cùng.
Vậy X thuộc chu kỳ 3, nhóm IIA.
Đáp án A
Trong một chu kì, khi đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân:
-
A.
Mở đầu chu kì là một kim loại điển hình (trừ chu kì 1), cuối chu kì là một phi kim điển hình (trừ chu kì 7) và kết thúc chu kì là một khí hiếm.
-
B.
Mở đầu chu kì là một phi kim điển hình (trừ chu kì 7), cuối chu kì là một kim loại điển hình (trừ chu kì 1) và kết thúc chu kì là một khí hiếm.
-
C.
Mở đầu chu kì là một phi kim điển hình (trừ chu kì 7), cuối chu kì là một khí hiếm và kết thúc chu kì là một kim loại điển hình (trừ chu kì 1).
-
D.
Mở đầu chu kì là một kim loại điển hình (trừ chu kì 1), cuối chu kì là một khí hiếm và kết thúc chu kì là một phi kim điển hình (trừ chu kì 7).
Đáp án : A
Dựa vào bảng tuần hoàn hóa học.
Trong một chu kì, khi đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân mở đầu chu kì là một kim loại điển hình (trừ chu kì 1), cuối chu kì là một phi kim điển hình (trừ chu kì 7) và kết thúc chu kì là một khí hiếm.
Đáp án A
Biết vị trí nguyên tử X như sau: có 3 lớp electron, lớp ngoài cùng có 5 electron. Dựa vào bảng tuần hoàn thì nguyên tố X là
-
A.
Phosphorus.
-
B.
Chlorine.
-
C.
Nitrogen.
-
D.
Sulfur.
Đáp án : A
Dựa vào sơ lược về bảng tuần hoàn hóa học.
Vì X có 3 lớp electron, lớp ngoài cùng có 5 electron nên X có tổng số 15 electron.
Vậy nguyên tố X là phosphorus (P).
Đáp án A
Hợp chất Ba(NO3)y có khối lượng phân tử là 261 amu. Giá trị của y là
-
A.
4
-
B.
3
-
C.
2
-
D.
1
Đáp án : C
Dựa vào quy tắc hóa trị.
Khối lượng phân tử hợp chất Ba(NO3)y = 137 + (14 + 16.3).y = 261
\( \to \)y = 2
Đáp án C
Trong các chất sau, dãy nào gồm đơn chất kim loại?
-
A.
Al, Fe, C, P.
-
B.
Mg, Na, H2, O2.
-
C.
Al, Fe, Mg, Na.
-
D.
Al, Mg, C, H2.
Đáp án : C
Dựa vào sơ lược bảng tuần hoàn hóa học.
Dãy gồm đơn chất kim loại gồm: Al, Fe, Mg, Na.
Đáp án C
Chất nào sau đây là hợp chất?
-
A.
khí Nitrogen do nguyên tố N tạo nên.
-
B.
kim loại copper do nguyên tố Cu tạo nên.
-
C.
ethanol do 3 nguyên tố C, H và O tạo nên.
-
D.
khí Fluorine do nguyên tố F tạo nên.
Đáp án : C
Dựa vào khái niệm về hợp chất
Ethanol là hợp chất do được tạo thành từ 3 nguyên tố C, H và O.
Đáp án C
Số electron ở lớp ngoài cùng của nguyên tử K và F lần lượt là 1 và 7. Hãy cho biết khi K kết hợp với F để tạo thành phân tử potassium fluoride, nguyên tử K cho hay nhận bao nhiêu electron?
-
A.
cho đi 1 electron ở lớp ngoài cùng.
-
B.
nhận thêm 1 electron.
-
C.
cho đi 7 electron.
-
D.
nhận thêm 7 electron.
Đáp án : A
Dựa vào liên kết hóa học.
Nguyên tử K có 1 electron lớp ngoài cùng nên có xu hướng cho đi 1 electron ở lớp ngoài cùng để có lớp electron giống khí hiếm.
Có các phát biểu sau:
a) Trong hợp chất, kim loại luôn nhường electron, phi kim luôn nhận electron.
b) Để có 8 electron ở lớp vỏ ngoài cùng thì nguyên tử aluminium hoặc nhường 3 electron hoặc nhận 5 electron.
c) Liên kết trong hợp chất tạo bởi magnesium và chlorine là liên kết ion.
d) Khi tạo liên kết hóa học, nguyên tử chlorine chỉ tạo ion âm bằng cách nhận thêm 1 electron.
Số phát biểu đúng là:
-
A.
2
-
B.
3
-
C.
1
-
D.
4
Đáp án : A
Dựa vào liên kết hóa học.
a. sai, vì phi kim có thể nhường electron như nguyên tử H.
b. sai, nguyên tử aluminium chỉ có thể nhường 3 electron.
c. đúng
c. đúng
Đáp án A
Nguyên tử K kết hợp với nguyên tử Cl tạo thành phân tử potassium chloride. Ở điều kiện thường potassium chloride là chất
-
A.
rắn.
-
B.
lỏng.
-
C.
khí.
-
D.
dung dịch.
Đáp án : A
Dựa vào liên kết ion.
ở điều kiện thường, KCl là hợp chất rắn do tạo thành từ liên kết ion.
Đáp án A
Nguyên tố X có hóa trị III, công thức hợp chất của X với nhóm SO4 (có hóa trị II) là
-
A.
X2(SO4)3
-
B.
XSO4
-
C.
X(SO4)3
-
D.
X3SO4
Đáp án : A
Dựa vào quy tắc hóa trị.
Gọi công thức chung là Xa(SO4)b
Theo quy tắc hóa trị: a.III = b.II \( \to \)a : b = 2 : 3
Công thức hợp chất là X2(SO4)3
Đáp án A
Hợp chất A trong phân tử gồm có 1X, 1S, 4O liên kết với nhau, biết X có khối lượng nguyên tử 40 amu. Công thức hóa học của A là
-
A.
CaSO4
-
B.
CuSO4
-
C.
FeSO4
-
D.
MgSO4
Đáp án : A
Dựa vào công thức hóa học.
Vì khối lượng nguyên tử X là 40amu nên X là Ca.
Công thức hóa học của A là CaSO4.
Đáp án A
Hợp chất (X) tạo bởi 2 nguyên tố potassium K và oxygen O có khối lượng phân tử bằng 94 amu, trong đó potassium K chiếm 82,98% về khối lượng. Công thức hóa học của hợp chất (X) là
-
A.
K2O
-
B.
KO
-
C.
KO2
-
D.
K3O
Đáp án : A
Dựa vào công thức hóa học.
Gọi công thức hóa học chung là KxOy
%K = \(\frac{{39.x}}{{94}}.100 = 82,98\% \to x = 2\)
Công thức hợp chất X là: K2O.
Đáp án A
Liên kết cộng hóa trị là liên kết
-
A.
được tạo nên giữa 2 nguyên tử bằng một hay nhiều cặp electron chung.
-
B.
trong đó cặp electron chung bị lệch về một nguyên tử.
-
C.
được hình thành do sự dùng chung electron của 2 nguyên tử khác nhau.
-
D.
giữa các phi kim với nhau.
Đáp án : A
Dựa vào khái niệm về liên kết cộng hóa trị.
Liên kết cộng hóa trị là liên kết được tạo nên giữa 2 nguyên tử bằng một hay nhiều cặp electron dùng chung.
Đáp án A
Khối lượng của phân tử Phosphoric acid H3PO4 là
-
A.
48 amu.
-
B.
86 amu.
-
C.
96 amu.
-
D.
98 amu.
Đáp án : D
Dựa vào khối lượng phân tử.
Khối lượng của phân tử H3PO4 là: 3.1 + 31 + 16.4 = 98amu
Đáp án D
Kim cương là một trong hai dạng thù hình được biết đến nhiều nhất của carbon, dạng còn lại đó là than chì. Kim cương có độ cứng cao và khả năng quang học cực tốt và chúng được ứng dụng trong các ngành công nghiệp và đặc biệt những viên kim cương chất lượng tốt nhất được sử dụng trong ngành kim hoàn với giá trị kinh tế rất cao. Nguyên tử của nguyên tố carbon có số hiệu nguyên tử là 6 và số khối là 12. Tổng số hạt proton, electron và neutron trong nguyên tử carbon là:
-
A.
18
-
B.
28.
-
C.
11.
-
D.
8.
Đáp án : A
Dựa vào thành phần nguyên tử.
Số hiệu nguyên tử = số proton = số electron = 6.
Số khối = số proton + số neutron = 12
\( \to \)số neutron = 12 – 6 = 6.
Tổng số hạt proton, electron và neutron trong nguyên tử carbon là: 6 + 6 + 6 = 18
Đáp án A
Quãng đường di chuyển có quan hệ như thế nào với thời gian khi tốc độ không đổi?
-
A.
Tăng tuyến tính với thời gian
-
B.
Giảm tuyến tính với thời gian
-
C.
Không phụ thuộc vào thời gian
-
D.
Cả A và B
Đáp án : A
Dựa vào mối quan hệ quãng đường thời gian
Quãng đường di chuyển Tăng tuyến tính với thời gian khi tốc độ không đổi
Đáp án A
Công cụ nào có thể dùng để đo tốc độ của xe máy?
-
A.
Đồng hồ bấm giờ
-
B.
Thước đo
-
C.
Tốc kế
-
D.
La bàn
Đáp án : C
Dựa vào đo tốc độ
Tốc kế có thể dùng để đo tốc độ của xe máy
Đáp án C
Nếu quãng đường di chuyển của một người đi bộ trong 30 phút là 2 km, tốc độ trung bình của người đó là bao nhiêu?
-
A.
1 km/h
-
B.
2 km/h
-
C.
3 km/h
-
D.
4 km/h
Đáp án : D
Dựa vào công thức tính tốc độ
Tốc độ trung bình của người đó là: \[v = \frac{s}{t} = \frac{2}{{0,5}} = 4km/h\]
Đáp án D
Một chiếc xe đi từ A đến B trong 4 giờ với tốc độ 80 km/h. Quãng đường từ A đến B là:
-
A.
160 km
-
B.
200 km
-
C.
320 km
-
D.
400 km
Đáp án : C
Dựa vào công thức tính quãng đường
Quãng đường từ A đến B là: s = v.t = 80.4 = 320 km
Đáp án C
Khi xe di chuyển nhanh, thì lực tác dụng lên người lái trong trường hợp tai nạn:
-
A.
Giảm đi
-
B.
Không thay đổi
-
C.
Tăng lên
-
D.
Không phụ thuộc vào tốc độ
Đáp án : C
Dựa vào an toàn giao thông
Khi xe di chuyển nhanh, thì lực tác dụng lên người lái trong trường hợp tai nạn tăng lên
Đáp án C
Tổng số hạt = Số p + Số e + Số n = 34 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt
→ Số p + Số e – Số n = 10 (2)
Từ (1) và (2) suy ra Số n = 12
Nguyên tử trung hòa về điện nên tổng số hạt proton bằng tổng số hạt electron.
→ Số p = Số e = \(\frac{{34 - 12}}{2} = 11\)
Nguyên tử M có 2 electron ở lớp ngoài cùng => M nằm ở nhóm IIA
- Nguyên tử M có 3 lớp electron => M nằm ở chu kì 3
=> M thuộc ô số 12, nằm ở nhóm IIA, chu kì 3
- Ô số 12 màu xanh => Nguyên tử M là kim loại
a) Ta có: hoá trị của C và S trong hợp chất cần xác định là (IV).
Công thức hoá học chung: MxOy ; với M là nguyên tố đại diện cho C, S.
Theo quy tắc hoá trị, ta có: x. IV = y x II <=> x : y = II: IV = 1 : 2
Chọn x = 1, y = 2. Vậy công thức hoá học của các hợp chất này là CO2 hoặc SO2
KLPT(CO2) = 12 + 16 x 2 = 44 (amu).
KLPT(SO2) = 32 + 16 x 2 = 64 (amu).
b) Liên kết trong các phân tử CO2, SO2 là liên kết cộng hoá trị.
Tốc độ di chuyển quyết định quãng đường phanh khi xảy ra tình huống bất ngờ. Khi di chuyển nhanh, người lái cần nhiều thời gian và khoảng cách hơn để dừng xe, nên khả năng xảy ra tai nạn tăng lên. Quãng đường di chuyển phụ thuộc vào thời gian và tốc độ, nên việc kiểm soát tốc độ sẽ giúp người lái có thể điều chỉnh kịp thời trong các tình huống đột ngột, giảm nguy cơ gây nguy hiểm.
Đề thi giữa kì 1 - Đề số 12
Đề thi giữa kì 1 - Đề số 11
Câu 1: Nguyên tử calcium có 20 electron ở vỏ nguyên tử. Hạt nhân của nguyên tử calcium có số proton là A. 2. B. 10. C. 18. D. 20.
Câu 1: Phát biểu nào dưới đây không đúng? A. Nguyên tử được cấu thành từ các hạt cơ bản là proton, neutron và electron. B. Hầu hết hạt nhân nguyên tử được cấu thành từ các hạt proton và neutron.
Câu 1: Một đơn vị khối lượng nguyên tử (1 amu) theo định nghĩa có giá trị bằng A. 1/16 khối lượng của nguyên tử oxygen.
Câu 1: Có những hạt nào được tìm thấy trong hạt nhân của nguyên tử? A. Các hạt mang điện tích âm (electron).
Câu 1: Phát biểu nào sau đây không mô tả đúng mô hình nguyên tử của Rơ-dơ-pho – Bo? A. Nguyên tử có cấu tạo rỗng, gồm hạt nhân ở tâm nguyên tử và các electron ở vỏ nguyên tử.
Nguyên tử của nguyên tố X có tổng số hạt mang điện là 16. Số lớp eletron và số electron lớp ngoài cùng của X lần lượt là? Nguyên tử của nguyên tố X có số đơn vị điện tích hạt nhân là 13. Số neutron trong X bằng 14. Tên gọi của nguyên tố X là
Phát biểu nào không mô tả đúng mô hình nguyên tử của Rơ – dơ – pho – Bo? Hạt nhân nguyên tử nguyên tố A có 24 hạt, trong đó số hạt không mang điện là 12. Số electron trong A là
Nguyên tử của nguyên tố X có số electron bằng 8. Tổng số hạt trong X là 24. X có số neutron là? Trong một nguyên tử có số proton bằng 9, số electron trong các lớp của vỏ nguyên tử, viết từ lớp trong ra lớp ngoài lần lượt là
Nguyên tử của nguyên tố X có số electron bằng 8. Tổng số hạt trong X là 24. X có số neutron là? Trong một nguyên tử có số proton bằng 9, số electron trong các lớp của vỏ nguyên tử, viết từ lớp trong ra lớp ngoài lần lượt là
Nguyên tử của nguyên tố X có số electron bằng 8. Tổng số hạt trong X là 24. X có số neutron là? Trong một nguyên tử có số proton bằng 9, số electron trong các lớp của vỏ nguyên tử, viết từ lớp trong ra lớp ngoài lần lượt là
>> Học trực tuyến lớp 7 trên Tuyensinh247.com. Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Cam kết giúp học sinh lớp 7 học tốt, hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |










Danh sách bình luận