Lý thuyết pH của dung dịch. Chuẩn độ acid - base - Hóa học 11 - Cánh diều
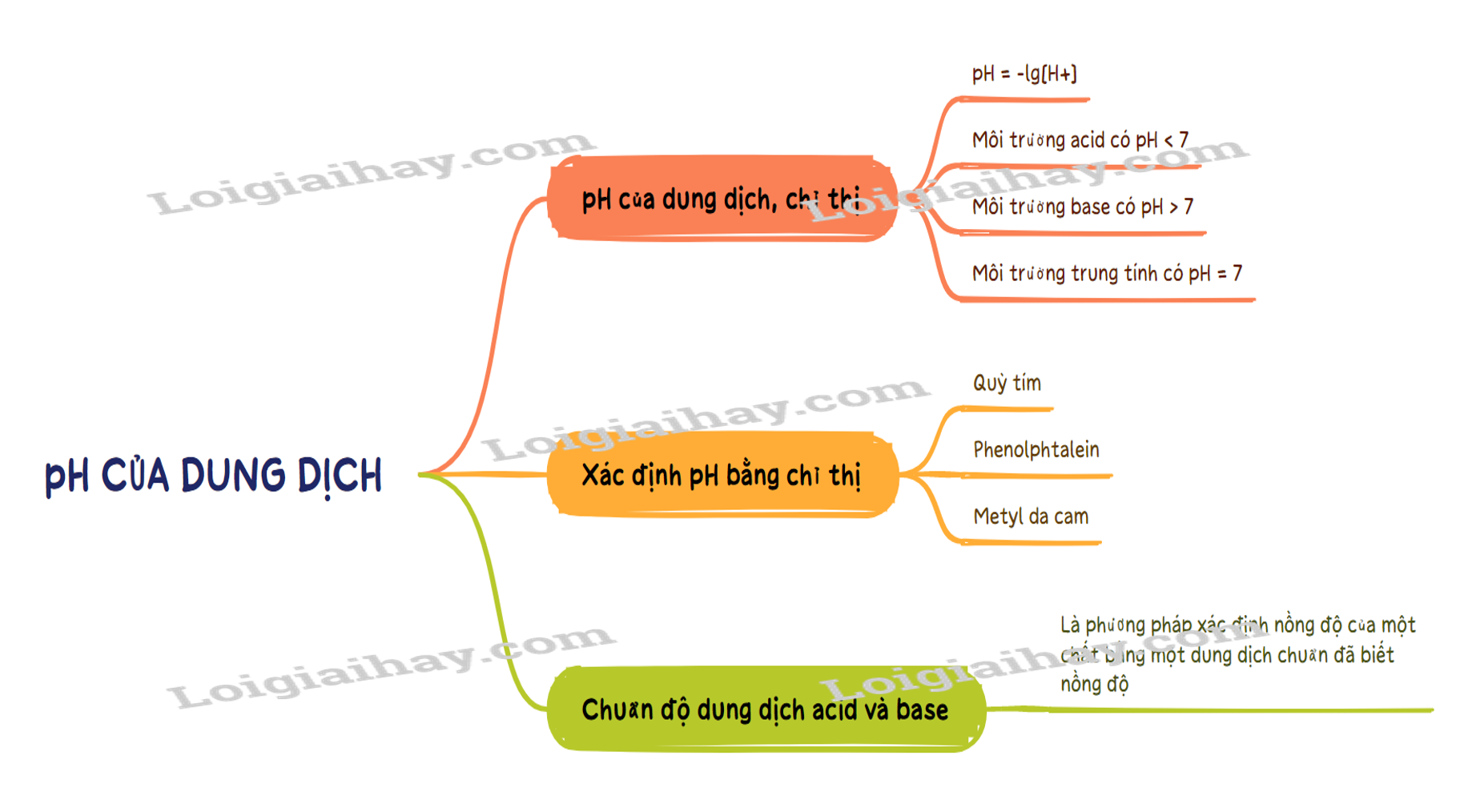
- Môi trường acid có pH < 7. - Môi trường base có pH > 7. - Môi trường trung tính có pH = 7.
I. pH của dung dịch, chất chỉ thị
1. pH của dung dịch
|
pH = -lg[H+] hoặc [H+] = 10-pH
|
với [H+] là nồng độ mol của ion H+.
- Môi trường acid có pH < 7.
- Môi trường base có pH > 7.
- Môi trường trung tính có pH = 7.
2. Ý nghĩa của pH trong thực tiễn
- pH có ý nghĩa trong tự nhiên, trong sản xuất và trong cơ thể sống xảy ra trong dung dịch nước với sự có mặt của các acid – base.
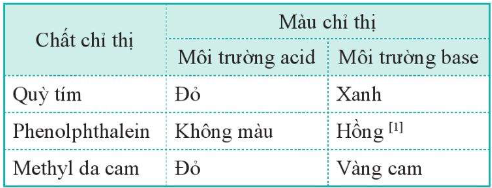
3. Xác định pH bằng chất chỉ thị
II. Chuẩn độ dung dịch acid và base
Nguyên tắc: Chuẩn độ là phương pháp xác định nồng độ của một chất bằng một dung dịch chuẩn đã biết nồng độ.
SƠ ĐỒ TƯ DUY
Các bài khác cùng chuyên mục
- Bài 19: Carboxylic acid trang 132, 133, 134, 135, 136, 137, 138, 139 Hóa học 11 Cánh diều
- Bài 18: Hợp chất carbonyl trang 122, 123, 124, 125, 126, 127, 128, 129, 130, 131 Hóa học 11 Cánh diều
- Bài 17: Phenol trang 116, 117, 118, 119, 120, 121 Hóa học 11 Cánh diều
- Bài 16: Alcohol trang 107, 108, 109, 110, 111, 112, 113, 114, 115 Hóa học 11 Cánh diều
- Bài 15: Dẫn xuất halogen trang 100, 101, 102, 103, 104, 105, 106 Hóa học 11 Cánh diều
- Bài 19: Carboxylic acid trang 132, 133, 134, 135, 136, 137, 138, 139 Hóa học 11 Cánh diều
- Bài 18: Hợp chất carbonyl trang 122, 123, 124, 125, 126, 127, 128, 129, 130, 131 Hóa học 11 Cánh diều
- Bài 17: Phenol trang 116, 117, 118, 119, 120, 121 Hóa học 11 Cánh diều
- Bài 16: Alcohol trang 107, 108, 109, 110, 111, 112, 113, 114, 115 Hóa học 11 Cánh diều
- Bài 15: Dẫn xuất halogen trang 100, 101, 102, 103, 104, 105, 106 Hóa học 11 Cánh diều












Danh sách bình luận