Bài 3. pH của dung dịch - Chuẩn độ acid - base trang 20, 21, 22, 23, 24, 25 Hóa học 11 Cánh diều
Các acid như acetic acid trong giấm ăn, citric acid trong quả chanh, oxalic acid trong quả khế đều tan và phân li trong nước. Chẳng hạn, acetic acid (CH3COOH) phân li theo phương trình sau: a) Em hãy dự đoán vị chua của các acid trên được gây ra bởi ion nào. b) Trong chế biến nước chấm, càng cho nhiều giấm ăn thì nước chấm càng chua. Khi đó, nồng độ của ion nào tăng lên? c) Làm thế nào để xác định được nồng độ ion H+ trong dung dịch acid?
CH tr 20 MĐ
Video hướng dẫn giải
| Các acid như acetic acid trong giấm ăn, citric acid trong quả chanh, oxalic acid trong quả khế đều tan và phân li trong nước. Chẳng hạn, acetic acid (CH3COOH) phân li theo phương trình sau:
a) Em hãy dự đoán vị chua của các acid trên được gây ra bởi ion nào.
b) Trong chế biến nước chấm, càng cho nhiều giấm ăn thì nước chấm càng chua. Khi đó, nồng độ của ion nào tăng lên? c) Làm thế nào để xác định được nồng độ ion H+ trong dung dịch acid? |
Phương pháp giải:
- pH là đại lượng đặc trưng cho mức độ acid, base của một dung dịch.
- Người ta sử dụng các thiết bị, dụng cụ để xác định pH của dung dịch acid, base.
Lời giải chi tiết:
a) Vị chua của các acid trên được gây ra bởi ion H+.
b) Trong chế biến nước chấm, càng cho nhiều giấm ăn thì nước chấm càng chua. Khi đó, nồng độ của ion H+ tăng lên.
c) Để xác định được nồng độ ion H+ trong dung dịch acid, người ta thực hiện phương pháp chuẩn độ hoặc sử dụng giấy chỉ thị pH vạn năng, máy đo pH,…
CH tr 21 CH1
Video hướng dẫn giải
Giải thích vì sao nước nguyên chất có môi trường trung tính.
Phương pháp giải:
- pH là đại lượng đặc trưng cho mức độ acid, base của một dung dịch.
pH = -lg[H+]
- pH < 7: Dung dịch có tính acid.
pH = 7: Dung dịch có môi trường trung tính.
pH > 7: Dung dịch có tính kiềm.
Lời giải chi tiết:
Phương trình điện li của nước: H2O ⇌ H+ + OH‑
[H+] = [OH-] = 10-7 (M) (25 oC)
Vì nước có nồng độ ion H+ bằng nồng ion OH- nên nước có môi trường trung tính.
CH tr 21 CH2
Giải thích vì sao khi thêm HCl vào nước nguyên chất thì dung dịch thu được có [H+] >10-7 M.
Phương pháp giải:
Nồng độ ion H+ và OH- trong nước ở 25 °C: [H+] = [OH-] = 10-7 (M)
|
[H+] (mol.L-1) |
> 10-7 |
10-7 |
< 10-7 |
|
pH |
< 7 |
7 |
> 7 |
|
Môi trường |
Acid |
Trung tính |
Base |
Lời giải chi tiết:
HCl → H+ + Cl-
Nồng độ ion H+ và OH- trong nước ở 25 °C: [H+] = [OH-] = 10-7 (M)
Khi thêm HCl vào nước, HCl phân li ra ion H+, dung dịch có thêm một lượng H+. Do đó, trong dung dịch có
[H+] > [OH-]; nên [H+] > 10-7 M.
CH tr 21 LT
Sử dụng máy tính cầm tay để tính:
a) pH của các dung dịch có nồng độ H+ lần lượt là: 0,01 M; 0,5 M và 0,08 M.
b) Nồng độ H+ của các dung dịch có pH lần lượt là: 2,0; 7,4 và 14.
Phương pháp giải:
pH là đại lượng đặc trưng cho mức độ acid, base của một dung dịch.
pH = -lg[H+]
[H+] = 10-pH
Lời giải chi tiết:
a) Dung dịch có [H+] = 0,01 M pH = -lg(0,01) = 2
Dung dịch có [H+] = 0,5 M pH = -lg(0,5) = 0,3
Dung dịch có [H+] = 1 M pH = -lg(0,08) = 1,1
b) Dung dịch có pH = 2 --> [H+] = 10-2 = 0,01 (M)
Dung dịch có pH = 7,4--> [H+] = 10-7,4 (M)
Dung dịch có pH = 14 --> [H+] = 10-14 (M)
CH tr 22 LT1
Video hướng dẫn giải
Giải thích vì sao việc thiếu acid trong dạ dày là một nguyên nhân gây nên bệnh nhiễm khuẩn đường tiêu hoá.
Phương pháp giải:
- pH là đại lượng đặc trưng cho mức độ acid, base của một dung dịch.
- pH < 7: Dung dịch có tính acid.
pH = 7: Dung dịch có môi trường trung tính.
pH > 7: Dung dịch có tính kiềm.
Lời giải chi tiết:
Dịch vị dạ dày của con người có chứa acid HCl với pH dao động khoảng 1,5 – 3,5. Đây là khoảng pH phù hợp để các enzyme tiêu hoá (các chất xúc tác sinh học) hoạt động hiệu quả. Ngoài ra, HCl còn làm nhiệm vụ sát khuẩn, tiêu diệt nhiều loại vi khuẩn có trong thức ăn. Do đó thiếu acid trong dạ dày là một nguyên nhân gây nên bệnh nhiễm khuẩn đường tiêu hoá.
CH tr 22 VD1
Vì sao có thể dùng thuốc muối NaHCO3, khi điều trị bệnh thừa acid trong dạ dày?
Phương pháp giải:
pH là đại lượng đặc trưng cho mức độ acid, base của một dung dịch.
Lời giải chi tiết:
Khi dùng thuốc muối NaHCO3, trong dạ dày diễn ra phản ứng:
Phản ứng trên diễn ra làm lượng acid trong dạ dày giảm.
CH tr 22 LT2
Đất nhiễm phèn có pH trong khoảng 4,5 - 5,0. Hãy giải thích vì sao người ta thường bón vôi bột (CaO) để cải tạo loại đất này.
Phương pháp giải:
- pH là đại lượng đặc trưng cho mức độ acid, base của một dung dịch.
- pH < 7: Dung dịch có tính acid.
pH = 7: Dung dịch có môi trường trung tính.
pH > 7: Dung dịch có tính kiềm.
Lời giải chi tiết:
Đất nhiễm phèn có pH trong khoảng 4,5 - 5,0; Do đó đất nhiễm phèn có môi trường acid. Người ta rắc vôi bột (CaO) xuống để: Vôi bột tan tạo Ca(OH)2, Ca(OH)2 phân li ra OH- trung hòa bớt H+ trong đất. Độ pH của đất tăng.
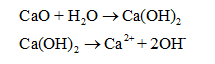
CH tr 22 VD2
Em hãy tìm hiểu giá trị và ý nghĩa của chỉ số pH ở một số bộ phận trong cơ thể con người.
Phương pháp giải:
pH là đại lượng đặc trưng cho mức độ acid, base của một dung dịch.
Lời giải chi tiết:
- Nồng độ pH là một trong những yếu tố vô cùng quan trọng ảnh hưởng đến sức khỏe của con người. Độ pH của cơ thể có khả năng ảnh hưởng đến mọi tế bào trong cơ thể. Bộ não, hệ tuần hoàn, thần kinh, hệ cơ, hệ tiêu hoá, hệ hô hấp làm việc tốt ở mức độ pH thích hợp.
- Chỉ số pH của một số bộ phận trong cơ thể con người:
+ Dạ dày có độ pH từ 1,5 đến 3,5. Trong dạ dày có acid HCl, nếu thiếu acid cơ thể bị nhiễm khuẩn đường tiêu hoá, nếu dư acid sẽ bị đau dạ dày.
+ Chỉ số pH của nước tiểu ở người dao động trong khoảng 4,5 – 8,0. Nếu pH của nước tiểu giảm xuống dưới 4,5 thì có nghĩa là bị dư acid, còn cao hơn 8,0 thì có nghĩa là bị dư kiềm. Một trong các dấu hiệu của bệnh sỏi thận là nước tiểu bị dư acid hoặc dư kiềm.
CH tr 24 CH
Video hướng dẫn giải
Để trung hoà 10 mL dung dịch HCl nồng độ x M cần 50 mL dung dịch NaOH 0,5 M. Xác định giá trị của x.
Phương pháp giải:
pH là đại lượng đặc trưng cho mức độ acid, base của một dung dịch.
pH = -lg[H+]
Lời giải chi tiết:
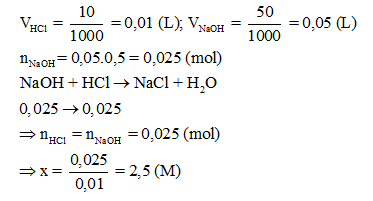
CH tr 24 CH
Chuẩn độ dung dịch NaOH chưa biết chính xác nồng độ (biết nồng độ trong khoảng gần với 0,1 M) bằng dung dịch chuẩn HCI 0,1 M với chất chỉ thị phenolphthalein.
Chuẩn bị: Dung dịch HCl 0,1 M, dung dịch NaOH (chưa biết chính xác nồng độ, khoảng 0,1 M), phenolphatalein, burette, bình tam giác 100 mL.
Tiến hành: Burette (loại 25 mL) đã được đổ đầy đến vạch 0 bằng dung dịch NaOH và chắc chắn không còn bọt khí trong burette. Cho 10 mL dung dịch chuẩn HCl vào bình tam giác (loại 100 mL), thêm 2 giọt chỉ thị phenolphthalein (loại 1% pha trong cồn).
Mở khoá burette để nhỏ từ từ từng giọt dung dịch NaOH vào bình tam giác, đồng thời lắc đều bình. Tiếp tục nhỏ dung dịch NaOH (vẫn duy trì lắc đều bình) tới khi dung dịch trong bình chuyển từ không màu sang màu hồng và bền trong ít nhất 20 giây thì kết thúc chuẩn độ (khoá burette). Ghi lại thể tích NaOH đã dùng. Lặp lại thí nghiệm ít nhất 3 lần.
Yêu cầu: Quan sát hiện tượng, viết phương trình hoá học và xác định nồng độ dung dịch NaOH.
Phương pháp giải:
Chuẩn độ là một phương pháp dùng để xác định nồng độ của một chất trong dung dịch bằng một dung dịch đã biết nồng độ.
Lời giải chi tiết:

CH tr 24 LT1
Giải thích vì sao trong thí nghiệm chuẩn độ dung dịch NaOH bằng dung dịch HCl, ta kết thúc chuẩn độ ngay khi dung dịch trong bình tam giác chuyển từ không màu sang hồng (bền trong ít nhất 20 giây).
Phương pháp giải:
Chuẩn độ là một phương pháp dùng để xác định nồng độ của một chất trong dung dịch bằng một dung dịch đã biết nồng độ.
Điểm tương đương là thời điểm chất cần chuẩn độ phản ứng hết.
Lời giải chi tiết:
Khi nhỏ NaOH dung dịch trong bình tam giác chứa phenolphthalein sẽ hóa hồng, rồi dung dịch lại mất màu khi NaOH hết vì phản ứng với HCl, việc để dung dịch hóa hồng bền ít nhất 20 giây nhằm đảm bảo HCl được NaOH trung hòa hết, kết thúc chuẩn độ tại đúng điểm tương đương.
CH tr 24 LT2
Giả sử khi kết thúc chuẩn độ, thể tích dung dịch NaOH (tính trung bình sau 3 lần chuẩn độ) đã sử dụng ở burette là 10,27 mL. Tính nồng độ của dung dịch NaOH.
Phương pháp giải:
Chuẩn độ là một phương pháp dùng để xác định nồng độ của một chất trong dung dịch bằng một dung dịch đã biết nồng độ.
Lời giải chi tiết:
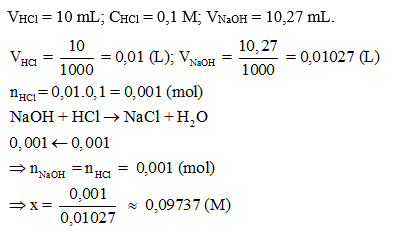
CH tr 24 VD
Nước ép bắp cải tím có màu sắc phụ thuộc vào pH. Em hãy thiết lập bảng màu của nước ép bắp cải tím theo pH bằng cách sử dụng giấy chỉ thị pH và acid, base thích hợp.
Phương pháp giải:
pH là đại lượng đặc trưng cho mức độ acid, base của một dung dịch.
Lời giải chi tiết:
* Chuẩn bị:
- Bắp cải tím thái nhỏ (khoảng 100 g).
- Cốc thuỷ tinh 250 mL, nước sôi, đũa thuỷ tinh, lưới/ vải lọc.
- Các cốc (đã được dán nhãn) đựng các acid và base thích hợp.
- Giấy pH hoặc máy đo pH.
* Tiến hành:
- Ngâm khoảng 100 g bắp cải tím đã được chuẩn bị vào 100 mL nước sôi trong khoảng 10 phút. Lọc bằng lưới lọc hoặc vải lọc, thu được dung dịch. Dung dịch này được sử dụng làm chất chỉ thị.
- Dùng máy đo pH (hoặc giấy pH) xác định pH của các dung dịch acid, base đã chuẩn bị.
- Cho vài giọt chất chỉ thị lần lượt vào các dung dịch acid, base đã chuẩn bị và khuấy đều. Quan sát sự đổi màu của các dung dịch.
* Từ đó thiết lập được bảng màu của nước ép bắp cải tím theo pH như sau:
|
pH |
2 |
4 |
6 |
8 |
10 |
12 |
|
Màu |
Đỏ |
Đỏ tía |
Tím |
Xanh dương |
Xanh lục |
Vàng |
CH tr 25 CH1
Video hướng dẫn giải
Để xác định nồng độ của một dung dịch NaOH, người ta đã tiến hành chuẩn độ bằng dung dịch HCl 0,1M. Để chuẩn độ 10 mL dung dịch NaOH này cần 12 mL dung dịch HCl. Xác định nồng độ của dung dịch NaOH trên.
Phương pháp giải:
Chuẩn độ là một phương pháp dùng để xác định nồng độ của một chất trong dung dịch bằng một dung dịch đã biết nồng độ.
Lời giải chi tiết:
V HCl = 12 mL; V NaOH = 10mL
n HCl = CM.V = 12.0,1 = 1,2 mmol.
NaOH + HCl NaCl + H2O
n NaOH = 1,2 mmol.
CM NaOH = 1,2 : 10 = 0,12M.
CH tr 25 CH2
Sưu tầm thông tin về ý nghĩa thực tiễn của pH trong đời sống và trong sản xuất nông nghiệp, công nghiệp.
Phương pháp giải:
pH là đại lượng đặc trưng cho mức độ acid, base của một dung dịch.
Lời giải chi tiết:
- Trong sản xuất:
+ Độ pH trong đất được dùng làm cơ sở cho việc sử dụng đất, sử dụng phân bón một cách hợp lí và hiệu quả nhằm bảo vệ chất lượng môi trường đất và phòng tránh ô nhiễm nguồn nước.
+ Mỗi loại cây trồng sẽ phát triển tốt nhất trong một khoảng pH của đất xác định: cà chua, xà lách cần giá trị pH khoảng 6,0 – 7,0; cải bắp cần giá trị pH khoảng 6,5 – 7,0; khoai tây cần giá trị pH khoảng 5,0 – 6,0; khoai lang cần giá trị pH khoảng 5,5 – 6,8;... Việc theo dõi và điều chỉnh pH thích hợp có ý nghĩa quan trọng trong việc nâng cao năng suất cây trồng.
- Trong đời sống: Quy chuẩn kĩ thuật quốc gia về chất lượng nước sạch sử dụng cho mục đích sinh hoạt được Bộ Y tế quy định mức giới hạn các thông số chất lượng đối với nước, trong đó ngưỡng giới hạn cho phép đối với độ pH trong khoảng 6,0 – 8,5. Quy chuẩn này cũng áp dụng cho nước hồ bơi.
CH tr 25 CH3
Trong môi trường acid, diệp lục có màu vàng đến đỏ; còn trong môi trường kiềm, diệp lục có màu xanh.
a) Giải thích vì sao khi vắt chanh vào nước luộc rau muống thì màu xanh của nước lại bị nhạt đi.
b*) Vì sao khi luộc bánh chưng, cho thêm một chút thuốc muối (NaHCO3) sẽ làm lá dong gói bánh có màu xanh đẹp hơn?
Phương pháp giải:
- pH là đại lượng đặc trưng cho mức độ acid, base của một dung dịch.
- pH < 7: Dung dịch có tính acid.
pH = 7: Dung dịch có môi trường trung tính.
pH > 7: Dung dịch có tính kiềm.
Lời giải chi tiết:

CH tr 25 CH4
Bình thường, chỉ số pH của nước tiểu ở người dao động trong khoảng 4,5 – 8,0. Nếu pH của nước tiểu giảm xuống dưới 4,5 thì có nghĩa là bị dư acid, còn cao hơn 8,0 thì có nghĩa là bị dư kiềm. Sỏi thận là khối chất rắn hình thành trong thận, gây đau khi ngăn cản dòng nước tiểu từ thận xuống niệu quản. Một trong các dấu hiệu của bệnh sỏi thận là nước tiểu bị dư acid hoặc dư kiềm. Đề xuất cách làm đơn giản để có thể tiên lượng bệnh sỏi thận.
Phương pháp giải:
- pH là đại lượng đặc trưng cho mức độ acid, base của một dung dịch.
- pH < 7: Dung dịch có tính acid.
pH = 7: Dung dịch có môi trường trung tính.
pH > 7: Dung dịch có tính kiềm.
Lời giải chi tiết:
Cách làm đơn giản để có thể tiên lượng bệnh sỏi thận: sử dụng giấy chỉ thị pH để kiểm tra pH của nước tiểu.

+ pH 4,5: Giấy pH có màu vàng cam đến đỏ.
+ pH 8: Giấy pH có xanh nhạt đến tím.
Nếu pH của nước tiểu giảm xuống dưới 4,5 hoặc cao hơn 8,0 thì có dấu hiệu của bệnh sỏi thận.
Lý thuyết
>> Xem chi tiết: Lý thuyết pH của dung dịch. Chuẩn độ acid - base - Hóa học 11 - Cánh diều
Các bài khác cùng chuyên mục
- Bài 19: Carboxylic acid trang 132, 133, 134, 135, 136, 137, 138, 139 Hóa học 11 Cánh diều
- Bài 18: Hợp chất carbonyl trang 122, 123, 124, 125, 126, 127, 128, 129, 130, 131 Hóa học 11 Cánh diều
- Bài 17: Phenol trang 116, 117, 118, 119, 120, 121 Hóa học 11 Cánh diều
- Bài 16: Alcohol trang 107, 108, 109, 110, 111, 112, 113, 114, 115 Hóa học 11 Cánh diều
- Bài 15: Dẫn xuất halogen trang 100, 101, 102, 103, 104, 105, 106 Hóa học 11 Cánh diều
- Bài 19: Carboxylic acid trang 132, 133, 134, 135, 136, 137, 138, 139 Hóa học 11 Cánh diều
- Bài 18: Hợp chất carbonyl trang 122, 123, 124, 125, 126, 127, 128, 129, 130, 131 Hóa học 11 Cánh diều
- Bài 17: Phenol trang 116, 117, 118, 119, 120, 121 Hóa học 11 Cánh diều
- Bài 16: Alcohol trang 107, 108, 109, 110, 111, 112, 113, 114, 115 Hóa học 11 Cánh diều
- Bài 15: Dẫn xuất halogen trang 100, 101, 102, 103, 104, 105, 106 Hóa học 11 Cánh diều












