Bài 2. Sự điện li trong dung dịch nước. Thuyết Brønsted - Lowry về acid - base trang 15, 16, 17, 18, 19 Hóa học 11 Cánh diều
Quan sát Hình 2.1, em hãy nêu những sự khác nhau giữa chất điện li và chất không điện li.
CH tr 15
Video hướng dẫn giải
| Câu hỏi mở đầu: Quan sát Hình 2.1, em hãy nêu những sự khác nhau giữa chất điện li và chất không điện li. |
Phương pháp:
Quá trình phân li các chất khi tan trong nước thành các ion được gọi là sự điện li. Chất điện li là chất khi tan trong nước phân li thành các ion. Chất không điện li là chất khi tan trong nước không phân li thành các ion.
Lời giải chi tiết:
a) Trong dung dịch chất điện li có các hạt ion âm và ion dương.
b) Trong dung dịch chất không điện li có phân tử chất.
CH tr 16
Video hướng dẫn giải
| Câu hỏi 1: Trong thí nghiệm trên, đèn sáng hay không sáng chứng tỏ tính chất vật lí nào của dung dịch chất tan? |
Phương pháp:
Bản chất của dòng điện là dòng chuyển dời có hướng của các hạt mang điện như electron (ví dụ trong kim loại) hoặc ion (ví dụ trong dung dịch, trong muối nóng chảy,...).
Lời giải chi tiết:
Trong thí nghiệm trên, đèn sáng hay không sáng chứng tỏ tính chất dẫn điện của dung dịch chất tan.
Trong dung dịch chất chất tan có ion, dung dịch đó có khả năng dẫn điện.
Trong dung dịch chất chất tan không có ion, dung dịch đó không có khả năng dẫn điện.
| Câu hỏi 2: Dự đoán trong thí nghiệm trên, cốc thuỷ tinh chứa nước nguyên chất thì đèn sáng hay không. |
Phương pháp:
Bản chất của dòng điện là dòng chuyển dời có hướng của các hạt mang điện như electron (ví dụ trong kim loại) hoặc ion (ví dụ trong dung dịch, trong muối nóng chảy,...).
Quá trình phân li các chất khi tan trong nước thành các ion được gọi là sự điện li. Chất điện li là chất khi tan trong nước phân li thành các ion. Chất không điện li là chất khi tan trong nước không phân li thành các ion.
Lời giải chi tiết:
Trong nước nguyên chất có cân bằng hóa học:
Tuy nhiên lượng ion H+ và OH- quá nhỏ, không đủ khả năng tạo nên dòng điện. Do đó trong thí nghiệm trên, cốc thuỷ tinh chứa nước nguyên chất thì đèn không sáng.
| Câu hỏi 3: Tìm hiểu và cho biết những chất nào sau đây thuộc loại chất điện li: HCl, Fe, BaCl2, Ca(OH)2, CH3COOH, O2. |
Phương pháp:
Quá trình phân li các chất khi tan trong nước thành các ion được gọi là sự điện li. Chất điện li là chất khi tan trong nước phân li thành các ion. Chất không điện li là chất khi tan trong nước không phân li thành các ion.
Hầu hết các acid, base và muối tan được trong nước thuộc loại chất điện li.
Rất nhiều chất hữu cơ tan được trong nước như đường saccharose (C12H22O11), ethanol, glycerol,... là những chất không điện li
Lời giải chi tiết:
Hầu hết các acid, base và muối tan được trong nước thuộc loại chất điện li.
Chất điện li: HCl, BaCl2, Ca(OH)2, CH3COOH.
CH tr 17
Video hướng dẫn giải
| Câu hỏi 1: Ở quá trình (3b), nước đóng vai trò là acid hay base? Vì sao? |
Phương pháp:
Thuyết Bronsted – Lowry về acid – base: Acid là những chất có khả năng cho H+, base là những chất có khả năng nhận H+.
Lời giải chi tiết:
HCl + H2O → H3O+ + Cl- (3b)
H2O nhận H+ từ HCl nên H2O là base.
| Câu hỏi 2: Trong cân bằng (4), hãy chỉ ra hai acid và hai base. Giải thích. |

| Câu hỏi 3: Dựa vào cân bằng (4) và (5), hãy giải thích vì sao H2O được cho là chất có tính lưỡng tính (là chất vừa có tính acid, vừa có tính base). |

CH tr 18
Video hướng dẫn giải
| Câu hỏi 1: Cho các chất sau: HBr, HI, H2S, KOH, NH3. Hãy phân loại chúng thành acid mạnh, base mạnh, acid yếu và base yếu. |
Phương pháp
Acid mạnh và base mạnh phân li hoàn toàn trong nước (nên không tồn tại dạng phân tử trong nước). Acid yếu và base yếu phân li một phần trong nước.
Lời giải chi tiết
\(\begin{array}{l}HBr \to {H^ + } + B{r^ - }\\HI \to {H^ + } + {I^ - }\\{H_2}S \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H^ + } + H{S^ - }\\HS - \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H^ + } + {S^{2 - }}\\KOH \to {K^ + } + O{H^ - }\\N{H_3} + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_4}^ + + O{H^ - }\end{array}\)
Acid mạnh: HBr, HI
Acid yếu: H2S
Base mạnh: KOH
Base yếu: NH3
Câu hỏi 2: Trong các cân bằng (7), (8a), (8b) xác định acid và các base

CH tr 19
Video hướng dẫn giải
| Câu hỏi 1: Tương tự Ví dụ 5, hãy cho biết dung dịch phèn sắt (NH4 Fe(SO4)2.12H2O) có môi trường acid hay base. Giải thích. Vì sao người ta có thể dùng phèn sắt để loại bỏ các chất lơ lửng trong nước? |

| Bài tập 1: Nếu dòng điện chạy qua được dung dịch nước của một chất X, những phát biểu nào sau đây sai?
a) Chất X là chất điện li. b) Trong dung dịch chất X có các ion dương và ion âm. c) Chất X ở dạng rắn khan cũng dẫn điện. d) Trong dung dịch chất X có electron tự do. |
Phương pháp:
Bản chất của dòng điện là dòng chuyển dời có hướng của các hạt mang điện như electron (ví dụ trong kim loại) hoặc ion (ví dụ trong dung dịch, trong muối nóng chảy,...).
Quá trình phân li các chất khi tan trong nước thành các ion được gọi là sự điện li. Chất điện li là chất khi tan trong nước phân li thành các ion. Chất không điện li là chất khi tan trong nước không phân li thành các ion.
Lời giải chi tiết:
Nếu dòng điện chạy qua được dung dịch nước của một chất X thì chất X là một chất điện li, trong dung dịch X chứa ion âm và ion dương → Phát biểu a, b đúng.
Chất X ở dạng rắn khan không dẫn được điện vì ở dạng rắn khan, X không có các hạt mang điện (ion hoặc electron) → Phát biểu c sai.
Trong dung dịch chất X có các ion, không có electron tự do → Phát biểu d sai.
| Bài tập 2: Giải thích vì sao dung dịch HCl dẫn diện tốt hơn dung dịch CH3COOH có cùng nồng độ. |
Phương pháp:
Acid mạnh và base mạnh phân li hoàn toàn trong nước (nên không tồn tại dạng phân tử trong nước). Acid yếu và base yếu phân li một phần trong nước.
Lời giải chi tiết:
HCl là một acid mạnh, trong dung dịch, HCl phân li hoàn toàn: HCl + H2O → H3O+ + Cl-
CH3COOH là một acid yếu, trong dung dịch, CH3COOH phân li không hoàn toàn:
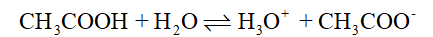
Do đó tuy cùng nồng độ dung dịch HCl dẫn diện tốt hơn dung dịch CH3COOH.
| Bài tập 3: Giải thích vai trò của nước trong sự điện li của HCl và NaOH. |
Phương pháp:
Quá trình phân li các chất khi tan trong nước thành các ion được gọi là sự điện li. Chất điện li là chất khi tan trong nước phân li thành các ion. Chất không điện li là chất khi tan trong nước không phân li thành các ion.
Lời giải chi tiết:
Nước là phân tử phân cực (các nguyên tử H mang một phần diện tích dương và nguyên tử O mang một phần diện tích âm) nên khi hoà tan NaOH và HCl vào nước, xuất hiện tương tác của nước với các ion. Tương tác này sẽ bứt các ion Na+ và OH- khỏi tinh thể NaOH và bứt các ion H+, Cl- ra khỏi phân tử HCl để tan vào nước.
Các bài khác cùng chuyên mục
- Bài 19: Carboxylic acid trang 132, 133, 134, 135, 136, 137, 138, 139 Hóa học 11 Cánh diều
- Bài 18: Hợp chất carbonyl trang 122, 123, 124, 125, 126, 127, 128, 129, 130, 131 Hóa học 11 Cánh diều
- Bài 17: Phenol trang 116, 117, 118, 119, 120, 121 Hóa học 11 Cánh diều
- Bài 16: Alcohol trang 107, 108, 109, 110, 111, 112, 113, 114, 115 Hóa học 11 Cánh diều
- Bài 15: Dẫn xuất halogen trang 100, 101, 102, 103, 104, 105, 106 Hóa học 11 Cánh diều
- Bài 19: Carboxylic acid trang 132, 133, 134, 135, 136, 137, 138, 139 Hóa học 11 Cánh diều
- Bài 18: Hợp chất carbonyl trang 122, 123, 124, 125, 126, 127, 128, 129, 130, 131 Hóa học 11 Cánh diều
- Bài 17: Phenol trang 116, 117, 118, 119, 120, 121 Hóa học 11 Cánh diều
- Bài 16: Alcohol trang 107, 108, 109, 110, 111, 112, 113, 114, 115 Hóa học 11 Cánh diều
- Bài 15: Dẫn xuất halogen trang 100, 101, 102, 103, 104, 105, 106 Hóa học 11 Cánh diều












