Lý thuyết Mở đầu về cân bằng hóa học - Hóa học 11 - Cánh diều
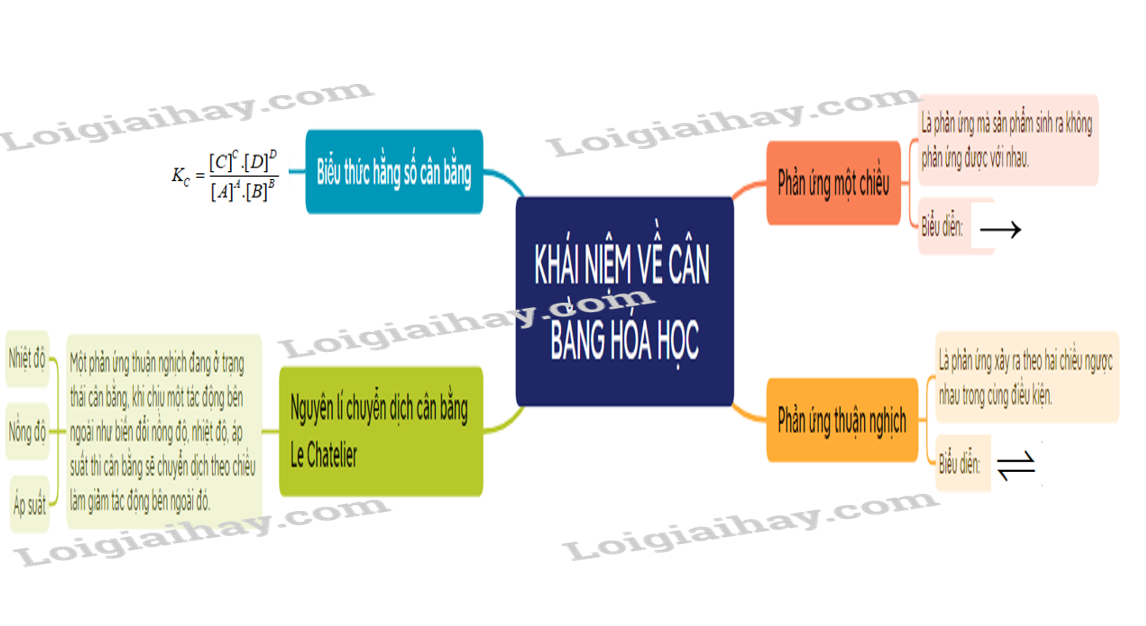
- Phản ứng thuận nghịch là phản ứng trong đó ở cùng điều kiện, xảy ra đồng thời sựu chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng.
I. Khái niệm phản ứng thuận nghịch và trạng thái cân bằng
- Phản ứng thuận nghịch là phản ứng trong đó ở cùng điều kiện, xảy ra đồng thời sựu chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng.
- Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái mà tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
II. Biểu thức hằng số cân bằng và ý nghĩa
1. Biểu thức hằng số cân bằng
- Xét phản ứng thuận nghịch tổng quát: aA + bB cC + dD.
Ở trạng thái cân bằng, hằng số cân bằng (KC) được xác định theo biểu thức:
\({K_C} = \frac{{{{[C]}^C}.{{[D]}^D}}}{{{{[A]}^A}.{{[B]}^B}}}\)
Trong đó:
+ [A], [B], [C], [D] là nồng độ mol của các chất A, B, C, D ở trạng thái cân bằng.
+ a, b, c, d là hệ số tỉ lượng của các chất trong phương trình hóa học của phản ứng.
- Ví dụ: Xét phản ứng: C(s) + CO2(g) 2CO(g)
\({K_C} = \frac{{{{[CO]}^2}}}{{[C{O_2}]}}\)
2. Ý nghĩa của biểu thức hằng số cân bằng
- Hằng số cân bằng KC phụ thuộc vào bản chất của phản ứng và nhiệt độ.
- KC càng lớn thì phản ứng thuận càng chiếm ưu thế và ngược lại.
III. Ảnh hưởng của nhiệt độ, nồng độ và áp suất đến cân bằng hóa học
1. Ảnh hưởng của nhiệt độ tới cân bằng hóa học
- Khi nhiệt độ tăng, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ, tức là chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của tăng nhiệt độ và ngược lại.
2. Nguyên lí chuyển dịch cân bằng Le Chatelier
- Khi tăng nồng độ một chất trong phản ứng thì cân bằng hóa học bị phá vỡ và chuyển dịch theo chiều làm giảm nồng độ của chất đó và ngược lại.
- Khi tăng áp suất chung của hệ, thì cân bằng chuyển dịch theo chiều làm giảm áp suất, tức là chiều làm giảm số mol khí và ngược lại.
- Nguyên lí chuyển dịch cân bằng Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động bên ngoài như biến đổi nồng độ, nhiệt độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
SƠ ĐỒ TƯ DUY
Các bài khác cùng chuyên mục
- Bài 19: Carboxylic acid trang 132, 133, 134, 135, 136, 137, 138, 139 Hóa học 11 Cánh diều
- Bài 18: Hợp chất carbonyl trang 122, 123, 124, 125, 126, 127, 128, 129, 130, 131 Hóa học 11 Cánh diều
- Bài 17: Phenol trang 116, 117, 118, 119, 120, 121 Hóa học 11 Cánh diều
- Bài 16: Alcohol trang 107, 108, 109, 110, 111, 112, 113, 114, 115 Hóa học 11 Cánh diều
- Bài 15: Dẫn xuất halogen trang 100, 101, 102, 103, 104, 105, 106 Hóa học 11 Cánh diều
- Bài 19: Carboxylic acid trang 132, 133, 134, 135, 136, 137, 138, 139 Hóa học 11 Cánh diều
- Bài 18: Hợp chất carbonyl trang 122, 123, 124, 125, 126, 127, 128, 129, 130, 131 Hóa học 11 Cánh diều
- Bài 17: Phenol trang 116, 117, 118, 119, 120, 121 Hóa học 11 Cánh diều
- Bài 16: Alcohol trang 107, 108, 109, 110, 111, 112, 113, 114, 115 Hóa học 11 Cánh diều
- Bài 15: Dẫn xuất halogen trang 100, 101, 102, 103, 104, 105, 106 Hóa học 11 Cánh diều












Danh sách bình luận