Bài 17. Tính chất vật lí và hóa học các đơn chất nhóm VIIA trang 75, 76, 77 SBT Hóa 10 Chân trời sáng tạo
Trong bảng tuần hoàn các nguyên tố hoá học, halogen thuộc nhóm A. IA. B. IIA. C. VIIA. D. VIIIA. Halogen tồn tại thể lỏng ở điều kiện thường là A. fluorine. B. bromine. C. iodine. D. chlorine.
17.1
Trong bảng tuần hoàn các nguyên tố hoá học, halogen thuộc nhóm
A. IA.
B. IIA.
C. VIIA.
D. VIIIA.
Lời giải chi tiết:
- Đáp án: C
17.2
Halogen tồn tại thể lỏng ở điều kiện thường là
A. fluorine.
B. bromine.
C. iodine.
D. chlorine.
Phương pháp giải:
Dựa vào trạng thái tồn tại của các halogen trong điều kiện thường:
- Fluorine và chlorine tồn tại ở trạng thái khí
- Bromine tồn tại ở trạng thái lỏng
- Iodine tồn tại ở trạng thái rắn
Lời giải chi tiết:
- Đáp án: B
17.3
Đơn chất halogen ở thể khí, màu vàng lục là
A. chlorine.
B. iodine.
C. bromine.
D. fluorine.
Phương pháp giải:
- Fluorine: màu lục nhạt
- Chlorine: màu vàng lục
- Bromine: màu nâu đỏ
- Iodine: màu đen tím
Lời giải chi tiết:
- Đáp án: A
17.4
Nguyên tố có tính oxi hoá yếu nhất thuộc nhóm VIIA là
A. chlorine.
B. iodine.
C. bromine.
D. fluorine.
Phương pháp giải:
Dựa vào theo chiều tăng dần của điện tích hạt nhân, tính oxi hóa của các nguyên tố trong cùng 1 nhóm giảm dần: F2 > Cl2 > Br2 > I2
Lời giải chi tiết:
- Đáp án: B
17.5
Cấu hình electron nguyên tử thuộc nguyên tố halogen là
A. ns2np2.
B. ns2np3.
C. ns2np5.
D. ns2np6.
Phương pháp giải:
Dựa vào các nguyên tố halogen thuộc nhóm VIIA => có 7 electron ở lớp ngoài cùng
Lời giải chi tiết:
- Đáp án: C
17.6
Ứng dụng nào sau đây không phải của Cl2?
A. Xử lí nước bể bơi.
B. Sát trùng vết thương trong y tế.
C. Sản xuất nhựa PVC.
D. Sản xuất bột tẩy trắng.
Lời giải chi tiết:
- Đáp án: B vì đây là ứng dụng của iodine
17.7
Halogen nào được dùng trong sản xuất nhựa Teflon?
A. Chlorine.
B. Iodine.
C. Fluorine.
D. Bromine.
Phương pháp giải:
Dựa vào công thức của nhựa Teflon là -(CF2-CF2)-n
Lời giải chi tiết:
- Đáp án: C
17.8
Nguyên tố halogen được dùng trong sản xuất nhựa PVC là
A. chlorine.
B. bromine.
C. phosphorus.
D. carbon.
Phương pháp giải:
Dựa vào công thức của nhựa PVC là -(CH2-CH(Cl))-n
Lời giải chi tiết:
- Đáp án: A
17.9
Halogen được điều chế bằng cách điện phân có màng ngăn dung dịch muối ăn là
A. fluorine.
B. chlorine.
C. bromine.
D. iodine.
Phương pháp giải:
Dựa vào công thức của muối ăn là NaCl
Lời giải chi tiết:
- Đáp án: B
17.10
Nguyên tố halogen dùng làm gia vị, cần thiết cho tuyến giáp và phòng ngừa khuyết tật trí tuệ là
A. chlorine.
B. iodine.
C. bromine.
D. fluorine.
Lời giải chi tiết:
- Đáp án: B
17.11
Halogen nào tạo liên kết ion bền nhất với sodium?
A. Chlorine.
B. Bromine.
C. Iodine.
D. Fluorine.
Phương pháp giải:
Dựa vào bán kính nguyên tử của các nguyên tố, nguyên tố nào có bán kính nguyên tử càng nhỏ " Khoảng cách giữa tâm hai nguyên tử trong hợp chất càng ngắn => Liên kết bền càng bền
Lời giải chi tiết:
- Trong nhóm VIIA, bán kính nguyên tử tăng dần theo thứ tự: F2 < Cl2 < Br2 < I2
=> Đáp án: D
17.12
Liên kết trong phân tử đơn chất halogen là
A. liên kết van der Waals.
B. liên kết cộng hoá trị.
C. liên kết ion.
D. liên kết cho nhận.
Phương pháp giải:
Dựa vào đặc điểm của liên kết cộng hóa trị: hình thành dựa trên các nguyên tố giống hoặc gần giống nhau về mặt hóa học
Lời giải chi tiết:
- Đáp án: B
17.13
Theo chiều từ F → Cl → Br → I, bán kính của nguyên tử
A. tăng dần.
B. giảm dần.
C. không thay đổi.
D. không có quy luật.
Phương pháp giải:
Dựa vào trong nhóm VIIA, bán kính nguyên tử tăng dần theo thứ tự: F2 < Cl2 < Br2 < I2
Lời giải chi tiết:
- Đáp án: A
17.14
Đặc điểm của halogen là
A. nguyên tử chỉ nhận thêm 1 electron trong các phản ứng hoá học.
B. tạo liên kết cộng hoá trị với nguyên tử hydrogen.
C. nguyên tử có số oxi hoá –1 trong tất cả hợp chất.
D. nguyên tử có 5 electron hoá trị.
Lời giải chi tiết:
- Đáp án: B
- Giải thích:
+ Đáp án A sai ở “chỉ nhận thêm 1 electron” sửa thành “Fluorine chỉ nhận thêm 1 electron”
+ Đáp án C sai ở “có số oxi hoá –1 trong tất cả hợp chất” sửa thành “Fluorine chỉ có số oxi hoá –1 trong tất cả hợp chất”
+ Đáp án D sai ở “5 electron hoá trị” sửa thành “7 electron hoá trị”
17.15
Phát biểu nào sau đây là không đúng?
A. Trong tự nhiên, không tồn tại đơn nhất halogen.
B. Tính oxi hoá của đơn chất halogen giảm dần từ F2 đến I2.
C. Khí chlorine ẩm và nước chlorine đều có tính tẩy màu.
D. Fluorine có tính oxi hoá mạnh hơn chlorine, oxi hoá Cl- trong dung dịch NaCl thành Cl2.
Lời giải chi tiết:
- Đáp án: D, sai ở “dung dịch NaCl” sửa thành “NaCl khan”. Vì Fluorine sẽ phản ứng mãnh liệt với nước trong dung dịch NaCl trước khi phản ứng với NaCl
17.16
Giá trị độ âm điện của halogen và hydrogen trong bảng sau:
|
Nguyên tố |
H |
F |
Cl |
Br |
I |
|
Giá trị độ âm điện |
2,20 |
3,98 |
3,16 |
2,96 |
2,66 |
Dựa vào giá trị độ âm điện, sắp xếp theo thứ tự giảm dần khả năng liên kết của halogen với hydrogen. So sánh độ phân cực của các phân tử hydrogen halide.
Phương pháp giải:
- Công thức tính hiệu độ âm điện: \(\Delta \chi = \left| {{\chi _2} - {\chi _1}} \right|\)
- Hiệu độ âm điện càng lớn thì liên kết phân cực càng lớn
Lời giải chi tiết:
- Từ Fluorine đến Iodine, độ âm điện giảm dần => Khả năng liên kết với nguyên tử hydrogen giảm dần => Thứ tự giảm dần khả năng liên kết: F2 > Cl2 > Br2 > I2
|
Hydrogen halide |
HF |
HCl |
HBr |
HI |
|
\(\Delta \chi = \left| {{\chi _2} - {\chi _1}} \right|\) |
3,98 - 2,20 = 1,78 |
3,16 - 2,20 = 0,96 |
2,96 - 2,20 = 0,76 |
2,66 - 2,20 = 0,46 |
=> Độ phân cực của phân tử hydrogen halide giảm dần theo thứ tự: HF > HCl > HBr > HI
17.17
Cho phương trình hoá học của 2 phản ứng như sau:
Cl2 + 2NaBr -> 2NaCl + Br2
Br2 + 2Nal -> 2NaBr + I2
Phương trình chứng minh tính chất nào của halogen?
Phương pháp giải:
Dựa vào theo chiều tăng dần của điện tích hạt nhân, tính oxi hóa của các nguyên tố trong cùng 1 nhóm giảm dần: F2 > Cl2 > Br2 > I2
Lời giải chi tiết:
- Cl2 có tính oxi hóa mạnh hơn Br2 nên Cl2 oxi hóa được ion Br- trong dung dịch muối tạo thành Br2
- Br2 có tính oxi hóa mạnh hơn I2 nên Br2 oxi hóa được ion I- trong dung dịch muối tạo thành I2
=> Các phương trình chứng minh tính oxi hóa của nhóm halogen giảm dần theo thứ tự: Cl2 > Br2 > I2
17.18
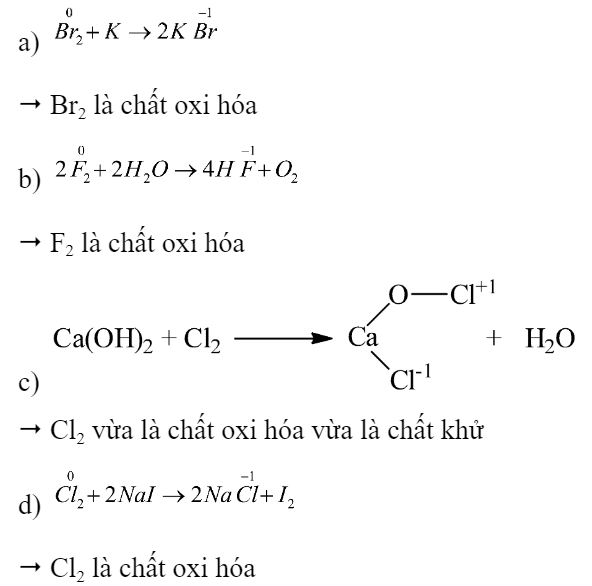
Hoàn thành phương trình hoá học của các phản ứng chứng minh tính chất halogen:
a) Br2 + K →
b) F2 + H2O →
c) Cl2 + Ca(OH)2 →
d) Cl2 + NaI →
Nhận xét vai trò của halogen trong các phản ứng trên.
Phương pháp giải:
Xác định số oxi hóa của các nguyên tố halogen trước và sau phản ứng từ đó nhận xét vai trò
Lời giải chi tiết:
17.19
Muối NaCl có lẫn một ít NaI. Nhận biết sự có mặt của muối NaI có trong hỗn hợp.
Phương pháp giải:
- Tính oxi hóa của Cl2 mạnh hơn I2
- Cách nhận biết I2 là sử dụng hồ tinh bột " Dung dịch màu xanh đen
Lời giải chi tiết:
Cách nhận biết sự có mặt của muối NaI có trong hỗn hợp
- Bước 1: Hòa tan mẫu muối vào nước và cho thêm vài giọt hồ tinh bột => Dung dịch không màu
- Bước 2: Nhỏ từ từ nước chlorine vào dung dịch muỗi đã hòa tan => Dung dịch xuất hiện màu xanh đen
Cl2 + 2NaI -> 2NaCl + I2
(I2 kết hợp hồ tinh bột -> Dung dịch màu xanh đen)
17.20
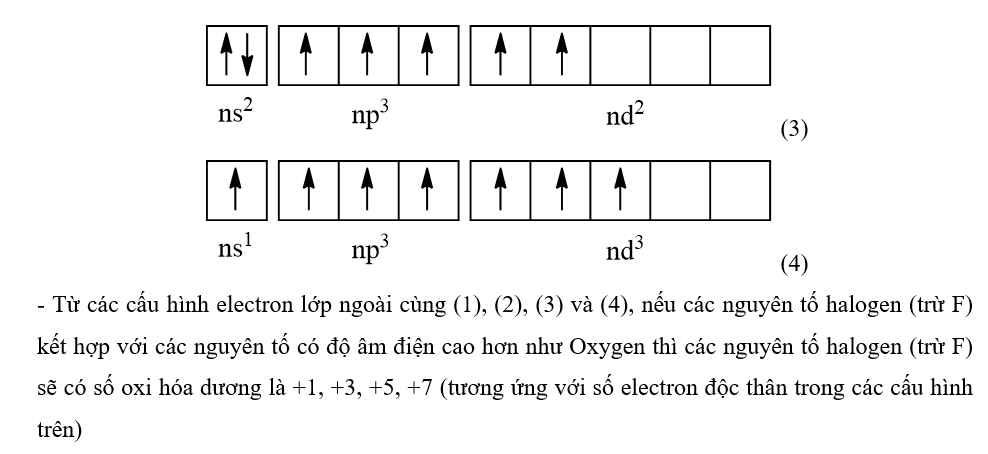
Trong hợp chất, số oxi hoá của halogen (trừ F) thường là −1, +1, +3, +5, +7. Tại sao các số oxi hoá chẵn không đặc trưng đối với halogen trong hợp chất?
Phương pháp giải:
Dựa vào cấu hình electron lớp ngoài cùng theo ô lượng tử để giải thích
Lời giải chi tiết:

17.21
Tại sao trong hợp chất của halogen, nguyên tố fluorine chỉ thể hiện số oxi hoá −1, còn các nguyên tố chlorine, bromine, iodine là −1, +1, +3, +5, +7?
Phương pháp giải:
Dựa vào độ âm điện của fluorine để giải thích
Lời giải chi tiết:
- Nguyên tố fluorine có độ âm điện lớn nhất trong bảng tuần hoàn: 3,98 -> Trong hợp chất, fluorine sẽ chỉ hút electron về phía nguyên tử này -> Do đó fluorine chỉ có số oxi hóa -1
- Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm halogen là ns2np5
- Ngoài ra (trừ F), các nguyên tố nhóm halogen còn có phân lớp d
-> Cấu hình electron lớp ngoài cùng theo ô lượng tử của các nguyên tố nhóm halogen (trừ F) là
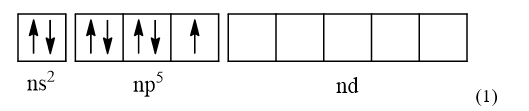
- Khi ở trạng thái kích thích, các electron ở phân lớp ns và np sẽ tách ra và chuyên sang phân lớp nd để tạo thành các cấu hình electron lớp ngoài cùng:
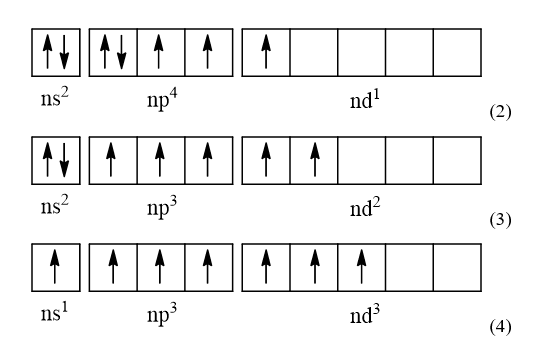
- Từ các cấu hình electron lớp ngoài cùng (1), (2), (3) và (4), nếu các nguyên tố halogen (trừ F) kết hợp với các nguyên tố có độ âm điện cao hơn như Oxygen thì các nguyên tố halogen (trừ F) sẽ có số oxi hóa dương là +1, +3, +5, +7 (tương ứng với số electron độc thân trong các cấu hình trên)
17.22
Tại sao đơn chất halogen ít tan trong nước, tan nhiều trong dung môi hữu cơ không phân cực như hexane (C6H14), carbon tetrachloride (CCl4)?
Phương pháp giải:
- Chất phân cực dễ tan trong dung môi phân cực
- Chất không phân cực dễ tan trong dung môi không phân cực
Lời giải chi tiết:
- Các halogen tồn tại ở trạng thái X2 => Các đơn chất halogen không phân cực
=> Các đơn chất halogen ít tan trong dung môi phân cực (nước) và tan nhiều trong dung môi hữu cơ không phân cực như hexane (C6H14), carbon tetrachloride (CCl4)
17.23
Tại sao chỉ có tên gọi nước chlorine, bromine, iodine nhưng không có nước fluorine?
Phương pháp giải:
Dựa vào tính chất hóa học của Fluorine phản ứng mãnh liệt với nước
Lời giải chi tiết:
- Do ở nhiệt độ thường, Fluorine phản ứng mãnh liệt với nước:
2F2 + 2H2O -> 4HF + O2
=> Không tồn tại nước Fluorine
- Các halogen còn lại chỉ tan 1 phần trong nước nên được gọi là nước halogen tương ứng
17.24
Một học sinh thực hiện thí nghiệm và cho kết quả như sau:
- Bước 1: Lấy 2 mL dung dịch NaBr vào ống nghiệm, dung dịch không màu.
- Bước 2: Lấy tiếp 1 mL hexane vào ống nghiệm, lắc mạnh để quan sát khả năng hoà tan của 2 chất lỏng. Nhận thấy 2 chất lỏng không tan vào nhau và phân tách lớp.
- Bước 3: Thêm 1 mL nước Cl2 vào ống nghiệm, lắc đều rồi để yên. Quan sát thấy lớp chất lỏng phía trên có màu da cam.
Viết phương trình hoá học của phản ứng. Thí nghiệm trên chứng minh tính chất vật lí và hoá học nào của halogen tương ứng?
Phương pháp giải:
Dựa vào
- Tính oxi hóa của nhóm halogen giảm dần theo thứ tự: F2 > Cl2 > Br2 > I2
- Tính chất vật lý của các đơn chất halogen: ít tan trong nước, tan nhiều trong dung môi hữu cơ không phân cực như hexane (C6H14), carbon tetrachloride (CCl4)…
Lời giải chi tiết:
- Phương trình hóa học: Cl2 + 2NaBr " 2NaCl + Br2
- Thí nghiệm trên chứng minh
+ Tính chất hóa học: tính oxi hóa của Cl2 mạnh hơn Br2
+ Tính chất vật lý:
· NaBr là hợp chất ion, phân cực mạnh " tan tốt trong nước, dung dịch đồng nhất
· Hexane là chất hữu cơ không phân cực " không tan trong nước và NaBr " dung dịch phân lớp. Hexane nhẹ hơn nên nổi lên trên
· Br2 tan trong dung môi không phân cực là hexane " Lớp chất lỏng phía trên có màu da cam
17.25
Xác nhận đúng, sai cho các phát biểu trong bảng sau:
|
|
|
Xác nhận |
|
|
STT |
Phát biểu |
Đúng |
Sai |
|
1 |
Halogen vừa có tính oxi hoá, vừa có tính khử |
|
|
|
2 |
Nước chlorine và Javel đều có tính tẩy màu |
|
|
|
3 |
Halogen tồn tại cả đơn chất và hợp chất trong tự nhiên |
|
|
|
4 |
Cl2 có tính oxi hoá mạnh hơn Br2 |
|
|
|
5 |
Cl2 khử được I- trong dung dịch NaI thành I2 |
|
|
|
6 |
Nhỏ nước iodine vào mặt cắt củ khoai, xuất hiện màu xanh đen |
|
|
|
7 |
Hợp chất của fluorine làm thuốc chống sâu răng, chất dẻo Teflon |
|
|
Lời giải chi tiết:
|
|
|
Xác nhận |
|
|
STT |
Phát biểu |
Đúng |
Sai |
|
1 |
Halogen vừa có tính oxi hoá, vừa có tính khử |
|
x |
|
2 |
Nước chlorine và Javel đều có tính tẩy màu |
x |
|
|
3 |
Halogen tồn tại cả đơn chất và hợp chất trong tự nhiên |
|
x |
|
4 |
Cl2 có tính oxi hoá mạnh hơn Br2 |
x |
|
|
5 |
Cl2 khử được I- trong dung dịch NaI thành I2 |
|
x |
|
6 |
Nhỏ nước iodine vào mặt cắt củ khoai, xuất hiện màu xanh đen |
x |
|
|
7 |
Hợp chất của fluorine làm thuốc chống sâu răng, chất dẻo Teflon |
x |
|
- Giải thích:
+ 1) Fluorine chỉ có tính oxi hóa
+ 3) Halogen chỉ tồn tại ở trạng thái hợp chất trong tự nhiên
+ 5) Cl2 oxi hóa được I- trong dung dịch NaI thành I2
17.26
Các hợp chất hypochlorite hay Chlorine (NaClO, Ca(ClO)2) là các hoá chất có tính oxi hoá rất mạnh, có khả năng sát trùng, sát khuẩn, làm sạch nguồn nước (Chlonine được nhắc đến là tên thương mại, không phải đơn chất Cl2). Chlorine ở nồng độ xác định có khả năng tiêu diệt một số mầm bệnh như:
|
Mầm bệnh |
Thời gian tiêu diệt |
|
E. coli O157: H7 (gây tiêu chảy ra máu, suy thận) |
<1 phút |
|
Hepatilis A virus (gây bệnh viêm gan siêu vi A) |
16 phút |
|
Kí sinh trùng Giardia (gây tiêu chảy, đau bụng và sụt cân) |
45 phút |
Chlorine cần dùng là tổng lượng chlorine cần thiết để tiêu diệt mầm bệnh và oxi hoá các chất khử trong nước như iron, manganese, hydrogen sulfide và lượng chlorine tự do còn lại sau khoảng thời gian nhất định. Một nhà máy xử lí nước muốn làm sạch 1 lít nước thì lượng chlorine cần dùng trong 1 ngày là 11 mg để duy trì lượng chlorine tự do từ 0,1 đến 0,2 mg/L tại vòi sử dụng. Một ngày, nhà máy phải cung cấp 3000 m3 nước xử lí, thì lượng chlorine cần dùng là bao nhiêu?
Lời giải chi tiết:
- Đổi 1 m3 = 1000 lít
- Để xử lý 1 lít nước cần 11 mg chlorine => Để xử lý 3000 m3 nước thì cần lượng chlorine là: 3000.1000.11 = 33.106 mg = 33 kg
17.27
Việt Nam là nước xuất khẩu thuỷ sản thứ 3 trên thế giới, sau Na Uy và Trung Quốc (Theo Bộ Nông nghiệp và Phát triển nông thôn Việt Nam, tháng 12/2021), xuất khẩu tới hơn 170 nước trên thế giới, trong đó có thị trường lớn như Mỹ và Châu Âu, được xem là thị trường khó tính, nên tiêu chuẩn chất lượng được kiểm soát chặt chẽ trước khi nhập nguyên liệu và sau khi thành phẩm, đóng gói. Trong danh mục tiêu chuẩn chất lượng sản phẩm có chỉ tiêu về dư lượng chlorine không vượt quá 1 mg/L (chlorine sử dụng trong quá trình sơ chế nguyên liệu để diệt vi sinh vật).
Phương pháp chuẩn độ iodine-thiosulfate được dùng để xác định dư lượng chlorine trong thực phẩm theo phương trình: Cl2 + 2KI → 2KCl + I2.
I2 được nhận biết bằng hồ tinh bột, I2 bị khử bởi dung dịch chuẩn sodium thiosulfate theo phương trình: I2 + 2Na2S2O3 → 2NaI + Na2S4O6.
Dựa vào thể tích dung dịch Na2S2O3 phản ứng, tính được dư lượng chlorine trong dung dịch mẫu.
Tiến hành chuẩn độ 100 mL dung dịch mẫu bằng dung dịch Na2S2O3 0,01 M, thể tích Na2S2O3 dùng hết 0,28 mL (dụng cụ chứa dung dịch chuẩn Na2S2O3 là loại microburet 1 mL, vạch chia 0,01 mL). Mẫu sản phẩm trên đủ tiêu chuẩn về dư lượng chlorine cho phép để xuất khẩu không? Giải thích.
Phương pháp giải:
- Tính số mol Na2S2O3 -> số mol Cl2 -> khối lượng Cl2 có trong 100ml dung dịch mẫu -> khối lượng Cl2 có trong 1 lít dung dịch mẫu -> So sánh với tiêu chuẩn
Lời giải chi tiết:
- \({n_{N{a_2}{S_2}{O_3}}} = 0,01.0,28 = 2,{8.10^{ - 3}}\) mol
- Theo phương trình:
Cl2 + 2KI → 2KCl + I2
\(1,{4.10^{ - 3}}\) <- \(1,{4.10^{ - 3}}\)
I2 + 2Na2S2O3 → 2NaI + Na2S4O6.
\(1,{4.10^{ - 3}}\) <- \(2,{8.10^{ - 3}}\)
=> \({m_{C{l_2}}} = 1,{4.10^{ - 3}}.71 = 0,0994\) mg/100ml
=> \({m_{C{l_2}}} = 0,0994.10 = 0,994\) mg/1L < 1 mg/L
=> Mẫu sản phẩm trên đủ tiêu chuẩn để xuất khẩu.
Luyện Bài Tập Trắc nghiệm Hóa 10 - Chân trời sáng tạo - Xem ngay
Các bài khác cùng chuyên mục
- Ôn tập chương 7 trang 83, 84 SBT Hóa 10 Chân trời sáng tạo
- Bài 18. Hydrogen halide và một số phản ứng của ion halide trang 79, 80, 81 SBT Hóa 10 Chân trời sáng tạo
- Bài 17. Tính chất vật lí và hóa học các đơn chất nhóm VIIA trang 75, 76, 77 SBT Hóa 10 Chân trời sáng tạo
- Ôn tập chương 6 trang 73, 74 SBT Hóa 10 Chân trời sáng tạo
- Bài 16. Các yếu tố ảnh hường đến tốc độ phản ứng hóa học trang 67, 68, 69 SBT Hóa 10 Chân trời sáng tạo
- Ôn tập chương 7 trang 83, 84 SBT Hóa 10 Chân trời sáng tạo
- Bài 18. Hydrogen halide và một số phản ứng của ion halide trang 79, 80, 81 SBT Hóa 10 Chân trời sáng tạo
- Bài 17. Tính chất vật lí và hóa học các đơn chất nhóm VIIA trang 75, 76, 77 SBT Hóa 10 Chân trời sáng tạo
- Ôn tập chương 6 trang 73, 74 SBT Hóa 10 Chân trời sáng tạo
- Bài 16. Các yếu tố ảnh hường đến tốc độ phản ứng hóa học trang 67, 68, 69 SBT Hóa 10 Chân trời sáng tạo













Danh sách bình luận