25 bài tập vận dụng về muối có lời giải
Làm đề thiCâu hỏi 1 :
Khi cho 200g dung dịch Na2CO3 10,6% vào dung dịch HCl dư, khối lượng khí sinh ra:
- A 4,6 g
- B 8 g
- C 8,8 g
- D 10 g
Đáp án: C
Phương pháp giải:
Viết PTHH xảy ra, đổi số mol Na2CO3. Dựa vào PTHH, tính toán số mol khí sinh ra theo mol Na2CO3
Lời giải chi tiết:
mdd Na2CO3 = m dd Na2CO3 . C% = 200 . 10,6% = 21,2g
=> n Na2CO3 = m Na2CO3 : M Na2CO3 = 21,2 : 106 = 0,2 mol
PTHH:Na2CO3 + 2HCl→ 2NaCl + H2O + CO2↑
Tỉ lệ:1 1
Pứ: 0,2 mol ? mol
Từ PTHH ta có nCO2 = nNa2CO3 = 0,2 mol
=> mCO2 = nCO2 . MCO2 = 0,2 . (12 + 2 . 16) = 8,8g
Đáp án C
Câu hỏi 2 :
Cho 200g dung dịch KOH 5,6% vào dung dịch CuCl2 dư, sau phản ứng thu được lượng chất kết tủa là:
- A 19,6 g
- B 9,8 g
- C 4,9 g
- D 17,4 g
Đáp án: B
Phương pháp giải:
Viết PTHH xảy ra, đổi số mol KOH. Dựa vào PTHH, tính toán số mol kết tủa Cu(OH)2 theo mol KOH
Lời giải chi tiết:
mdd KOH = m dd KOH . C% = 200 . 5,6% = 11,2g
=> n KOH= m KOH: M KOH = 11,2 : 56 = 0,2 mol
PTHH: 2KOH+ CuCl2→ Cu(OH)2 ↓+ 2KCl
Tỉ lệ: 2 1
Pứ: 0,2 mol ? mol
Từ PTHH ta có nCu(OH)2= ½ nKOH = 0,1 mol
=> mCu(OH)2= n Cu(OH)2 . M Cu(OH)2 = 0,1 . (64 + 2 . 16 + 2) = 9,8g
Đáp án B
Câu hỏi 3 :
Khi phân hủy bằng nhiệt 14,2 g CaCO3 và MgCO3 ta thu được 3,36 lít CO2 ở đktc. Thành phần phần trăm về khối lượng các chất trong hỗn hợp đầu là:
- A 29,58% và 70,42%
- B 70,42% và 29,58%
- C 65% và 35%
- D 35% và 65%
Đáp án: B
Phương pháp giải:
Gọi số mol của CaCO3 và MgCO3 lần lượt là x và y
Lập hệ phương trình với khối lượng hỗn hợp muối và số mol CO2 sẽ tìm ra được x, y. Từ đó tính được phần trăm mỗi muối.
Lời giải chi tiết:
Gọi số mol của CaCO3 và MgCO3 lần lượt là x và y
CaCO3 \(\xrightarrow{{{t^o}}}\) CO2 + CaO (1)
x x
MgCO3 \(\xrightarrow{{{t^o}}}\) CO2 + MgO (2)
y y
mhh = mCaCO3 + mMgCO3 = 100x + 84y = 14,2g (1)
nCO2 = VCO2 : 22,4 = 3,36 : 22,4 = 0,15 mol
nCO2 = nCO2 (1) + nCO2(2) = x + y = 0,15 mol (2)
Giải hệ pt (1) và (2) ta có x = 0,1 mol và y = 0,05 mol
=> mCaCO3 = nCaCO3 . MCaCO3 = 0,1.(40 + 12 + 48) = 10g
=> %mCaCO3 = \(\frac{{{m_{CaC{O_3}}}}}{{{m_{hh}}}}.100\% = \frac{{10}}{{14,2}}.100\% = 70,42\% \)
=> %mMgCO3 = 100% - %mCaCO3 = 29,58%
Đáp án B
Câu hỏi 4 :
Cho 500 ml dung dịch NaCl 2M tác dụng với 600 ml dung dịch AgNO3 2M. Khối lượng kết tủa thu được là:
- A 143,5 g
- B 14,35 g
- C 157,85 g
- D 15,785 g
Đáp án: A
Phương pháp giải:
Bài toán cho số liệu 2 chất tham gia phản ứng => đây là bài toán lượng chất hết dư
Viết PTHH xảy ra, xét xem chất nào phản ứng hết. Mọi tính toán theo số mol của chất phản ứng hết.
Lời giải chi tiết:
nNaCl = VNaCl . CM NaCl = 0,5 . 2 = 1 mol
n AgNO3 = VAgNO3 . CM AgNO3 = 0,6 . 2 = 1,2 mol
PTHH: NaCl + AgNO3 → NaNO3 + AgCl↓
Tỉ lệ: 1 1 1
Pứ: 1mol 1,2 mol ? mol
Ta có \({{{n_{NaCl}}} \over 1} < {{{n_{AgN{O_3}}}} \over 1}(1 < 1,2)\)
=> AgNO3 dư
=> nAgCl = nNaCl = 1 mol
=> mAgCl = nAgCl . MAgCl = 1 . (108 + 35,5) = 143,5g
Đáp án A
Câu hỏi 5 :
Cho 20 gam CaCO3 vào 200 ml dung dịch HCl 3M. Số mol chất còn dư sau phản ứng là:
- A 0,4 mol
- B 0,2 mol
- C 0,3 mol
- D 0,25 mol
Đáp án: B
Phương pháp giải:
Bài toán cho số liệu 2 chất tham gia phản ứng => đây là bài toán lượng chất hết dư
Viết PTHH xảy ra, xét xem chất nào phản ứng hết. Mọi tính toán theo số mol của chất phản ứng hết.
Lời giải chi tiết:
n CaCO3 = m CaCO3 : M CaCO3 = 20 : 100 = 0,2 mol
nHCl = VHCl . CM HCl = 0,2 . 3 = 0,6 mol
PTHH: CaCO3 + 2HCl→ CaCl2 + H2O + CO2↑
Tỉ lệ: 1 2
Pứ: 0,2 mol 0,6 mol
Ta có \({{{n_{CaC{O_3}}}} \over 1} < {{{n_{HCl}}} \over 2}(0,2 < 0,3)\)
=> CaCO3 phản ứng hết và HCl còn dư
nHCl phản ứng = 2nCaCO3 = 0,4 mol
=> nHCl dư = nHCl – nHCl phản ứng = 0,6 – 0,4 = 0,2 mol
Đáp án B
Câu hỏi 6 :
Cho 1,84g hỗn hợp 2 muối ACO3 và BCO3 tác dụng hết với dung dịch HCl thu được 0,672 lít CO2 ở đktc và dung dịch X. Khối lượng muối trong dung dịch X là:
- A 1,17(g)
- B 3,17(g)
- C 2,17(g)
- D 4,17(g)
Đáp án: C
Phương pháp giải:
Gọi số mol của ACO3 và BCO3 lần lượt là x và y
Lập hệ phương trình với khối lượng hỗn hợp muối và số mol CO2 sẽ tìm ra được x, y. Từ đó tính được phần trăm mỗi muối.
Lời giải chi tiết:
nCO2 = VCO2 : 22,4 = 0,672 : 22,4 = 0,03 mol
Gọi số mol của ACO3 và BCO3 lần lượt là x và y
ACO3 + 2HCl→ ACl2 + H2O + CO2↑ (1)
x →2x → x → x
BCO3 + 2HCl→ BCl2 + H2O + CO2↑ (2)
y →2y → y → y
Từ pt dễ dàng thấy nH2O (1) + nH2O (2) = nCO2 (1) + n CO2 (2) = x + y = nCO2 = 0,03 mol
nHCl (1) + nHCl (2) = 2nCO2 (1) + 2n CO2 (2) = 2 (x + y) = 2nCO2 = 0,06 mol
Áp dụng định luật bảo toàn khối lượng ta có
m ACO3 + mBCO3 + mHCl = mACl2 + mBCl2 + mH2O + mCO2
=> mACl2 + mBCl2 = m ACO3 + mBCO3 + mHCl – (mH2O + mCO2)
= 1,84 + 0,06 . 36,5 – (0,03 . 18 + 0,03 . 44) = 2,17g
Đáp án C
Câu hỏi 7 :
Để hòa tan hết 5,1 g M2O3 phải dùng 43,8 g dung dịch HCl 25%. Phân tử khối của M2O3 là:
- A 160
- B 102
- C 103
- D 106
Đáp án: B
Phương pháp giải:
Viết PTHH xảy ra. Tính số mol M2O3 theo số mol HCl. Có số mol M2O3 và khối lượng sẽ tìm ra được phân tử khối của M2O3 theo công thức: M = m : n
Lời giải chi tiết:
\(\eqalign{
& {m_{HCl}} = {{{m_{ddHCl}}} \over {100\% }}.C\% = {{43,8} \over {100\% }}.25\% = 10,95\,(g) \cr
& \Rightarrow {n_{HCl}} = {{{m_{HCl}}} \over {{M_{HCl}}}} = {{10,95} \over {36,5}} = 0,3\,(mol) \cr} \)
PTHH: M2O3 + 6HCl → 2MCl3 + 3H2O
0,05 ← 0,3 (mol)
Theo PTHH: nM2O3 = 1/6. nHCl = 0,3/6 = 0,05 (mol)
\( \Rightarrow {M_{{M_2}O}}_{_3} = {{{m_{{M_2}O}}_{_3}} \over {{n_{{M_2}O}}_{_3}}} = {{5,1} \over {0,05}} = 102\,(g/mol)\)
Đáp án B
Câu hỏi 8 :
Trộn dung dịch có chứa 0,1mol CuSO4 và một dung dịch chứa 0,3 mol NaOH, lọc kết tủa, rửa sạch rồi đem nung đến khối lượng không đổi thu được m g chất rắn. Giá trị m là:
- A 8 g
- B 4 g
- C 6 g
- D 12 g
Đáp án: A
Phương pháp giải:
Bài toán cho số liệu 2 chất tham gia phản ứng => đây là bài toán lượng chất hết dư
Viết PTHH xảy ra, xét xem chất nào phản ứng hết. Mọi tính toán theo số mol của chất phản ứng hết.
Lời giải chi tiết:
PTHH: 2NaOH+ CuSO4 → Cu(OH)2 ↓+ 2Na2SO4
Tỉ lệ: 2 1 1
Pứ: 0,3 mol 0,1 mol ? mol
Ta có \({{{n_{NaOH}}} \over 2} > {{{n_{Cu{O_4}}}} \over 1}(0,15 > 0,1)\)
=> nCu(OH)2 = nCuSO4 = 0,1 mol
PTHH: Cu(OH)2 \(\buildrel {{t^o}} \over\longrightarrow \) CuO + H2O
Tỉ lệ: 1 1
Pứ: 0,1 ? mol
Từ PTHH ta có nCuO = nCu(OH)2 = 0,1 mol
=> mCuO = nCuO . MCuO = 0,1 . (64 + 16) = 8g
Đáp án A
Câu hỏi 9 :
Cho 1,84 hỗn hợp 2 muối ACO3 và BCO3 tác dụng hết với dung dịch HCl thu được 0,672 lit CO2 (đktc) và dung dịch X. Khối lượng muối trong dung dịch X là:
- A 1,17g
- B 3,17g
- C 2,17g
- D 4,17g
Đáp án: C
Phương pháp giải:
PTHH : ACO3 + 2HCl → ACl2 + H2O + CO2
BCO3 + 2HCl → BCl2 + H2O + CO2
Ta thấy : nH2O = nCO2 = ? (mol)
nHCl = 2nCO2 = ? (mol)
Sử dụng bảo toàn khối lượng:
mhh đầu + mHCl = mmuối + mCO2 + mH2O
Lời giải chi tiết:
Số mol của CO2 là \({n_{C{O_2}}} = \frac{{0,672}}{{22,4}} = 0,03\,(mol)\)
PTHH : ACO3 + 2HCl → ACl2 + H2O + CO2
BCO3 + 2HCl → BCl2 + H2O + CO2
Ta thấy
nHCl = 2nCO2 = 2.0,03= 0,06 mol
Bảo toàn khối lượng cho 2 phương trình trên thì
mhh đầu + mHCl = mmuối + mCO2 + mH2O
=> 1,84 + 0,06.36,5 = mmuối +0,03.44+0,03.18
=> mmuối = 2,17 gam
Đáp án C
Câu hỏi 10 :
Trộn dung dịch có chứa 0,1mol CuSO4 và một dung dịch chứa 0,3 mol NaOH, lọc kết tủa, rửa sạch rồi đem nung đến khối lượng không đổi thu được m g chất rắn. Giá trị m là:
- A 12 g
- B 4 g
- C 6 g
- D 8 g
Đáp án: D
Phương pháp giải:
Viết phương trình hóa học xảy ra, tính toán theo phương trình hóa học
Lời giải chi tiết:
Phương trình hóa học
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
0,1 0,2 0,1 (mol)
Cu(OH)2 → CuO + H2O
0,1 0,1 (mol)
m = mCuO = 0,1 . 80 = 8g
Đáp án D
Câu hỏi 11 :
Cho 73 gam dung dịch HCl nồng độ 10% tác dụng vừa đủ với 127 gam dung dịch AgNO3.
a) Viết phương trình hóa học xảy ra.
b) Tính nồng độ phần trăm của dung dịch AgNO3 đã tham gia phản ứng?
c) Tính nồng độ phần trăm của dung dịch thu được sau phản ứng? (sau khi loại bỏ kết tủa)
Phương pháp giải:
Khối lượng của HCl là: \({m_{HCl}} = \frac{{m{\,_{dd\,HCl}}}}{{100\% }}.C\% = ?(g)\)
Số mol của HCl là: \({n_{HCl}} = \frac{{m{\,_{HCl}}}}{{{M_{HCl}}}} = ?\,(mol)\)
a. PTHH
HCl + AgNO3 → AgCl↓ + HNO3
b. Theo PTHH: nAgNO3 = nHCl = ? (mol)
Khối lượng của AgNO3 là: mAgNO3=? (g)
Nồng độ phần trăm dung dịch AgNO3 đã tham gia phản ứng là: \(C\% \,AgN{O_3} = \frac{{{m_{AgN{O_3}}}}}{{m{\,_{dd\,AgN{O_3}}}}}.100\% = ?\% \)
c. Dung dịch thu được sau khi loại bỏ kết tủa chứa HNO3
Theo PTHH: nHNO3 = nHCl = ? (mol)
=> Khối lượng HNO3 thu được là: ? (g)
Khối lượng dung dịch sau là:
mdd sau = m dd HCl + m dd AgNO3 - mAgCl
Nồng độ dung dịch của HNO3 thu được là: \(C\% \,HN{O_3} = \frac{{{m_{HN{O_3}}}}}{{m{\,_{dd\,sau}}}}.100\% = ?\,\% \)
Lời giải chi tiết:
Khối lượng của HCl là:\({m_{HCl}} = \frac{{m{\,_{dd\,HCl}}}}{{100\% }}.C\% = \frac{{73}}{{100\% }}.10\% = 7,3(g)\)
Số mol của HCl là:\({n_{HCl}} = \frac{{m{\,_{HCl}}}}{{{M_{HCl}}}} = \frac{{7,3}}{{36,5}} = 0,2\,(mol)\)
a. PTHH
HCl + AgNO3 → AgCl↓ + HNO3
b. Theo PTHH: nAgNO3 = nHCl = 0,2 (mol)
Khối lượng của AgNO3 là: mAgNO3=0,2. 170 = 34 (g)
Nồng độ phần trăm dung dịch AgNO3 đã tham gia phản ứng là:
\(C\% \,AgN{O_3} = \frac{{{m_{AgN{O_3}}}}}{{m{\,_{dd\,AgN{O_3}}}}}.100\% = \frac{{34}}{{127}}.100\% = 26,77\% \)
c. Dung dịch thu được sau khi loại bỏ kết tủa chứa HNO3
Theo PTHH: nHNO3 = nHCl = 0,2 (mol)
Khối lượng HNO3 thu được là: 0,2 × 63= 12,6 (g)
Theo PTHH: nAgCl = nHCl = 0,2 (mol)
Khối lượng của AgCl là: 0,2 × 143,5 = 28,7 (g)
Khối lượng dung dịch sau là:
mdd sau = m dd HCl + m dd AgNO3 - mAgCl
= 73 + 127 – 28,7
= 171,3 (g)
Nồng độ dung dịch của HNO3 thu được là: \(C\% \,HN{O_3} = \frac{{{m_{HN{O_3}}}}}{{m{\,_{dd\,sau}}}}.100\% = \frac{{12,6}}{{171,3}}.100\% = 7,36\% \)
Câu hỏi 12 :
Cho 41,95 g hỗn hợp gồm 2 muối KCl và K2CO3 tác dụng vừa đủ với dung dịch axitclohiđric 0,1M.Sau phản ứng thu được 5,6 lit khí ở đktc.
Câu 1: Tính khối lượng mỗi muối trong hỗn hợp
- A 7,45 g và 34,5g
- B 7,54 g và 34,5g
- C 7,45 g và 35,4g
- D 5,45 g và 34,5g
Đáp án: A
Phương pháp giải:
a. Cho hh KCl và K2CO3 tác dụng với dd HCl chỉ có K2CO3 pư.
Viết PTHH xảy ra, tính mol K2CO3 theo mol CO2. Từ đó tính được khối lượng của K2CO3 và KCl.
Lời giải chi tiết:
a.
K2CO3 + 2HCl 2KCl + H2O + CO2.
0,25 0,5 0,5 0,25
Số mol CO2 : n = 5,6 / 22,4 = 0,25 mol
Số gam K2CO3 : m = 0,25 x 138 = 34,5 g
Số gam có lúc ban đầu KCl : m = 41,95 – 34,5 = 7,45 g
Số mol KCl lúc ban đầu: n = 7,45: 74,5 = 0,1
Đáp án A
Câu 2: Xác định nồng độ mol của dung dịch thu được sau phản ứng? ( Cho rằng sự thay đổi thể tích dd sau phản ứng là không đáng kể )
- A 0,12M
- B 0,1M
- C 0,2M
- D 0,21M
Đáp án: A
Phương pháp giải:
b. Xác định thể tích ban đầu của HCl. Từ đó tính được thể tích dd sau pư (do đề cho coi như thể tích không đổi)
Tính tổng số mol KCl thu được sau pư. Từ đó suy ra CM KCl = nKCl : Vsau = ?
Lời giải chi tiết:
b.
Thể tích dung dịch HCl cần dùng là : 0,5 : 0,1 = 5(l)
Số mol KCl có trong dd sau phản ứng: 0,5 + 0,1 = 0,6 (mol)
Nồng độ mol của dd KCl ( ddB) sau phản ứng 0,6 : 5 = 0,12 (M)
Đáp án A
Câu hỏi 13 :
Hòa tan 25,9g hỗn hợp hai muối khan gồm NaCl và Na2SO4 vào nước thì thu được 200g dung dịch A. Cho dung dịch A vào dung dịch Ba(OH)2 20% vừa đủ, thấy xuất hiện 23,3g kết tủa, lọc bỏ kết tủa thu được dung dịch B.
a) Viết các phương trình hóa học.
b) Tính khối lượng mỗi muối khan trong hỗn hợp ban đầu.
c) Tính nồng độ phần trăm các chất có trong dung dịch B
Phương pháp giải:
a) muối + bazo → muối mới + bazo mới ( điều kiện có chất kết tủa hoặc bay hơi)
b) Tính toán theo phương trình hóa học
c) Tính khối lượng Ba(OH)2 từ đó tính được khối lượng dd Ba(OH)2
Tính khối lượng dd B theo công thức: mdd B = mddA + mddBa(OH)2 – mBaSO4
Sử dụng công thức tính phần trăm: \(C\% = & \frac{{m\,chat\,\tan }}{{m\,dd\,B}}.100\% \)
Lời giải chi tiết:
a) Khi cho hh muối khan gồm NaCl và Na2SO4 vào nước ta thu được dd A chứa chất tan là NaCl và Na2SO4.
Cho dd A tác dụng với dd Ba(OH)2 chỉ có dd Na2SO4 pư còn dd NaCl không phản ứng.
PTHH: Na2SO4 + Ba(OH)2 → BaSO4↓ + 2NaOH (1)
b) Kết tủa thu được là BaSO4 có khối lượng 23,3 gam
\({n_{BaS{O_4}}} = \frac{{{m_{BaS{O_4}}}}}{{{M_{BaS{O_4}}}}} = \frac{{23,3}}{{137 + 32 + 16.4}} = 0,1\,(mol)\)
Theo PTHH (1): nNa2SO4 = nBaSO4 = 0,1 (mol)
→ mNa2SO4 = nNa2SO4×MNa2SO4 = 0,1×142 = 14,2 (g)
→ mNaCl = mhh – mNa2SO4 = 25,9 – 14,2 = 11,7 (g)
c) Theo PTHH (1): nNaOH = 2nBaSO4 = 2.0,1 = 0,2 (mol)
→ mNaOH = nNaOH×MNaOH = 0,2×40= 8 (g)
Theo PTHH (1): nBa(OH)2 = nBaSO4 = 0,1 (mol)
→ mBa(OH)2 = nBa(OH)2×MBa(OH)2 = 0,1×171 = 17,1 (g)
Khối lượng dd Ba(OH)2 20% cần dùng là: \({m_{ddBa{{(OH)}_2}}} = \frac{{{m_{Ba{{(OH)}_2}}}}}{{C\% }}.100\% = \frac{{17,1}}{{20\% }}.100\% = 85,5\,(g)\)
Khối lượng dd B thu được là:
mddB = mddA + mdd Ba(OH)2 – mBaSO4↓ = 200 + 85,5 – 23,3=262,2 (g)
dd B chứa các chất tan là: NaCl: 11,7 gam và NaOH: 8 (g)
Nồng độ phần trăm các chất tan có trong dd B là:
\(\left\{ \begin{array}{l}C\% NaCl = \frac{{{m_{NaCl}}}}{{{m_{dd\,B}}}}.100\% = \frac{{11,7}}{{262,2}}.100\% = 4,46\% \\C\% NaOH = \frac{{{m_{NaOH}}}}{{{m_{dd\,B}}}}.100\% = \frac{8}{{262,2}}.100\% = 3,05\% \end{array} \right.\)
Câu hỏi 14 :
Cho 20 gam CaCO3 tác dụng vừa đủ với dung dịch axit HCl 3,65%.
a/ Viết phương trình hóa học.
b/ Tính thể tích khí CO2 sinh ra (đktc).
c/ Tính khối lượng dung dịch axit HCl 3,65% cần dùng.
d/ Tính nồng độ phần trăm của dung dịch muối sau phản ứng.
(Cho biết: Ca = 40; C = 12; O = 16; Cl = 35,5)
Phương pháp giải:
a/ Viết PTHH.
b/ - Theo phương trình hóa học, tính số mol CO2 theo số mol CaCO3
- Áp dụng công thức: V = n.22,4
c/ - Theo phương trình hóa học, tính số mol HCl theo số mol CaCO3
- Áp dụng công thức tính khối lượng HCl, m = n.M
- Áp dụng công thức tính khối lượng dung dịch HCl, \({m_{dd}} = \frac{{{m_{ct}}}}{{C\% }}.100\% \)
d/ - Tính khối lượng dung dịch sau phản ứng
- Theo phương trình, tính số mol CaCl2 theo CaCO3
- Áp dụng công thức tính khối lượng của CaCl2: m = n.M
- Áp dụng công thức tính nồng độ dung dịch CaCl2: \(C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100\% \)
Lời giải chi tiết:
\({n_{CaC{{\rm{O}}_3}}} = \frac{{20}}{{100}} = 0,2\,\,mol\)
a/ \(CaC{{\rm{O}}_3} + 2HCl \to CaC{l_2} + C{O_2} + {H_2}O\)
b/ Theo phương trình hóa học, \({n_{C{O_2}}} = {n_{CaC{{\rm{O}}_3}}} = 0,2\,\,mol\)
\( \to {V_{C{O_2}}} = 0,2.22,4 = 4,48\,\,lit\)
c/ Theo phương trình hóa học: \({n_{HCl}} = 2{n_{CaC{O_3}}} = 2.0,2 = 0,4\,\,mol\)
\( \to {m_{HCl}} = 0,4.36,5 = 14,6\,\,gam\)
\( \to {m_{dd\,\,HCl}} = \frac{{14,6}}{{3,65\% }}.100\% = 400\,\,gam\)
d/ Ta có: mdd spu = \({m_{CaC{{\rm{O}}_3}}} + {m_{dd\,\,HCl}} - {m_{C{O_2}}} = 20 + 400 - 0,2.44 = 411,2\,\,gam\)
Theo phương trình, \({n_{CaC{l_2}}} = {n_{CaC{{\rm{O}}_3}}} = 0,2\,\,mol\)
\( \to {m_{CaC{l_2}}} = 0,2.111 = 22,2\,\,gam\)
\( \to C{\% _{CaC{l_2}}} = \frac{{22,2}}{{411,2}}.100\% = 5,4\% \)
Câu hỏi 15 :
Cho 2,791 g hỗn hợp rắn chứa hai chất Na2SO4 và Pb(NO3)2 trong nước, đun nóng nhẹ, thu được kết tủa. Sau khi lọc, rửa và sấy khô thu được 1,515 g chất rắn. Dung dịch qua lọc thấy có tạo kết tủa với dung dịch Pb(NO3)2 0,5 M, trái lại không cho kết tủa với dung dịch Na2SO4 0,5 M.
(a) Viết phương trình phản ứng và phương trình ion rút gọn.
(b) Tính thành phần % khối lượng mỗi chất trong hỗn hợp.
Phương pháp giải:
a) Viết phương trình hóa học xảy ra
Chuyển tất cả các chất dễ tan, điện li mạnh thành ion, các chất khí, kết tủa, điện li yếu để nguyên dạng phân tử.
Lược bỏ những ion không tham gia phản ứng, ta được phương trình ion rút gọn
b) Tính toán theo phương trình hóa học, mọi số mol của các chất trong phương trình tính theo số mol của chất phản ứng hết.
Lời giải chi tiết:
(a)
Phương trình hóa học: Na2SO4 + Pb(NO3)2 → PbSO4 ↓ + 2NaNO3
Phương trình ion thu gọn: Pb2+ + SO42- → PbSO4 ↓
(b) Do dung dịch qua lọc thấy có tạo kết tủa với dung dịch Pb(NO3)2 0,5 M, trái lại không cho kết tủa với dung dịch Na2SO4 0,5 M nên Pb(NO3)2 phản ứng hết, Na2SO4 còn dư
Số mol của kết tủa: \({n_{PbS{O_4}}} = \frac{{{m_{PbS{O_4}}}}}{{{M_{PbS{O_4}}}}} = \frac{{1,515}}{{303}} = 0,005(mol)\)
Theo PTHH ta có: \({n_{Pb{{(N{O_3})}_2}ban\,dau}} = {n_{Pb{{(N{O_3})}_2}pu}} = {n_{PbS{O_4}}} = 0,005(mol)\)
Khối lượng của Pb(NO3)2 trong hỗn hợp ban đầu là:
Thành phần phần trăm về khối lượng của Pb(NO3)2 trong hỗn hợp ban đầu là: \(\% {m_{Pb{{(N{O_3})}_2}}} = \frac{{1,655}}{{2,791}}.100\% = 59,3\% \)
Thành phần phần trăm về khối lượng Na2SO4 trong hỗn hợp ban đầu là: \(\% {m_{Na2{{(S{O_4})}_2}}} = 100\% - 59,3\% = 40,7\% \)
Câu hỏi 16 :
Để nhận biết 3 chất rắn NH4NO3 , Ca3 (PO4)2, KCl người ta dùng dung dịch :
- A NaOH
- B Ba(OH)2
- C KOH
- D Na2CO3
Đáp án: B
Lời giải chi tiết:
Lấy mẫu thử của 3 chất rắn
Nhỏ từ từ dd Ba(OH)2 vào từng mẫu thử
+ Chất rắn tan và xuất hiện khí có mùi khai là NH4NO3
Ba(OH)2 + 2NH4NO3 → Ba(NO3)2 + 2NH3 + 2H2O
+ Chất rắn không tan là Ca3 (PO4)2
+ Chất rắn tan không có hiện tượng là KCl(KCl chỉ tan vào nước có trong dd Ba(OH)2 chứ không xảy ra phản ứng hóa học).
Đáp án: B
Câu hỏi 17 :
Để nhận biết 3 dung dịch bị mất nhãn : Na2SO4 , HCl , H2SO4 loãng , người ta dùng :
- A Qùi tím
- B Qùi tím và dd BaCl2
- C Qùi tím và Fe
- D dd BaCl2 và dd AgNO3
Đáp án: B
Lời giải chi tiết:
Lấy mẫu thử của 3 dung dịch
Dùng quì tím
+ Na2SO4 không làm quì đổi màu
+ HCl và H2SO4 làm quì hóa đỏ
Dùng BaCl2 nhận biết HCl và H2SO4
+ không có hiện tượng là HCl
+ Xuất hiện kết tủa trắng là H2SO4
BaCl2 + H2SO4 → BaSO4+ 2HCl
=> Đáp án B
Câu hỏi 18 :
Hòa tan 10 gam hỗn hợp muối XCO3 và Y2(CO3)3 bằng dd HCl dư thư được dd A và 0,672 lít khí ở đktc.Khối lượng muối khan thu được sau phản ứng là
- A 10,3 gam
- B 10,33 gam
- C 30 gam
- D 13 gam
Đáp án: B
Lời giải chi tiết:
Câu hỏi 19 :
Trình bày phương pháp hóa học phân biệt các chất đựng trong lọ riêng biệt sau: NaNO3, Cu(NO3)2, Fe(NO3)3, Ba(NO3)2
Phương pháp giải:
Dùng dd NaOH và dd H2SO4
Lời giải chi tiết:
Trích mẫu thử của từng chất vào các ống nghiệm riêng biệt và đánh dấu tương ứng
- Cho dung dịch NaOH dư vào 4 ống nghiệm trên
+ống nghiệm nào xuất hiện kết tủa màu xanh thì ống nghiệm đó chứ Cu(NO3)2
3NaOH + Cu(NO3)2 → Cu(OH)2↓ + 2NaNO3
+ ống nghiệm nào xuất hiện kết tủa màu nâu đỏ thì ống nghiệm đó chứa Fe(NO3)3
3NaOH + Fe(NO3)3 → Fe(OH)3↓ + 3NaNO3
+ ống nghiệm nào không có hiện tượng hig chứa NaNO3 và Ba(NO3)2
- Cho H2SO4 dư vào 2 dung dịch chưa phân biệt được NaNO3 và Ba(NO3)2
+ ống nghiệm xuất hiện kết tủa màu trắng là Ba(NO3)2
H2SO4 + Ba(NO3)2 → BaSO4↓ + 2HNO3
+ ống nghiệm không có hiện tượng gì là NaNO3
Câu hỏi 20 :
Súc miệng bằng dung dịch nước muối 0,9% có tác dụng bảo vệ niêm mạc và sát khuẩn. Số gam NaCl cần lấy để pha 300 gam dung dịch nước muối 0,9% là:
- A 5,4g
- B 0,9g
- C 0,27g
- D 2,7g
Đáp án: D
Phương pháp giải:
Lời giải chi tiết:
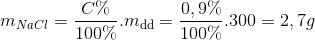
Câu hỏi 21 :
Cho 200ml dung dịch KOH 1M tác dụng vừa đủ dung dịch MgSO4 2M
a. Tính khối lượng kết tủa thu được.
b. Tính thể tích dung dịch MgSO4 2M cần dùng
c. Tính nồng độ mol/lit dung dịch sau phản ứng.
(Biết thể tích dung dịch thay đổi không đáng kể)
Phương pháp giải:
Tính theo phương trình hóa học: 2KOH + MgSO4→ Mg(OH)2↓ + K2SO4
Đổi mol KOH, tính toán các dữ liệu cần tìm còn lại dựa vào PTHH trên và số mol KOH đề bài cho
Lời giải chi tiết:
Đổi 200 ml = 0,2 (lít)
nKOH = VKOH. CM KOH = 0,2.1 = 0,2 (mol)
PTHH: 2KOH + MgSO4→ Mg(OH)2↓ + K2SO4
a. Theo PTHH: nMg(OH)2 = 1/2 nKOH = 1/2. 0,2 = 0,1 (mol)
→ Khối lượng kết tủa thu được là: mMg(OH)2 = nMg(OH)2. MMg(OH)2 = 0,1.58 = 5,8 (g)
b. Theo PTHH: nMgSO4 = 1/2 nKOH = 1/2. 0,2 = 0,1 (mol)
→ Thể tích dung dịch MgSO4 2M cần dùng là: VMgSO4 = nMgSO4: CM = 0,1 : 2 = 0,05 (lít)
c. Dung dịch sau phản ứng thu được chứa K2SO4
Theo PTHH: nK2SO4 = 1/2 nKOH = 1/2. 0,2 = 0,1 (mol)
Thể tích dung dịch thay đổi không đáng kể nên:
Vsau = VKOH + VMgSO4 = 0,2 + 0,05 = 0,25 (lít)
Nồng độ mol/lít của dd K2SO4 thu được sau phản ứng là: CM K2SO4 = nK2SO4 : Vsau = 0,1 : 0,25 = 0,4 (M)
Câu hỏi 22 :
Cho 500 ml dung dịch Ba(OH)2 0,1M vào V ml dung dịch Al2(SO4)3 0,1M; sau khi các phản ứng kết thúc thu được 12,045 gam kết tủa. Giá trị của V là:
- A 75
- B 150
- C 300
- D 200
Đáp án: B
Phương pháp giải:
Ta có: nBa(OH)2= 0,05 mol; nAl2(SO4)3= V.0,1/1000 (mol)
3Ba(OH)2+ Al2(SO4)3 → 3BaSO4+ 2Al(OH)3
0,3V/1000 mol← 0,1V/1000 mol 0,3V/1000 0,2V/1000 mol
Ba(OH)2+ 2Al(OH)3 → Ba(AlO2)2 + 4H2O
x 2x mol
Sau phản ứng thu được 0,3V/1000 mol BaSO4 và (0,2V/1000-2x) mol Al(OH)3
Và nBa(OH)2= 0,3V/1000 + x = 0,05
Giải hệ trên ta có: V
Lời giải chi tiết:
Ta có: nBa(OH)2= 0,05 mol; nAl2(SO4)3= V.0,1/1000 (mol)
3Ba(OH)2+ Al2(SO4)3 → 3BaSO4+ 2Al(OH)3
0,3V/1000 mol← 0,1V/1000 mol 0,3V/1000 0,2V/1000 mol
Ba(OH)2+ 2Al(OH)3 → Ba(AlO2)2 + 4H2O
x 2x mol
Sau phản ứng thu được 0,3V/1000 mol BaSO4 và (0,2V/1000-2x) mol Al(OH)3
→ 233. 0,3V/1000 + 78. (0,2V/1000-2x)= 12,045
Và nBa(OH)2= 0,3V/1000 + x = 0,05
Giải hệ trên ta có: V=150 ml; x= 0,005 mol
Đáp án B
Câu hỏi 23 :
Cho 26,91 gam kim loại M vào 700 ml dung dịch AlCl3 0,5M, sau khi phản ứng xảy ra hoàn toàn thu được V lít khí H2 (đktc) và 17,94 gam kết tủa. Xác định giá trị của V?
- A V = 7,728 lít hoặc V = 13,104 lít
- B V = 7,952 lít hoặc V = 12,88 lít
- C V = 7,728 lít hoặc V = 12,88 lít
- D V = 7,952 lít hoặc V = 13,104 lít
Đáp án: A
Phương pháp giải:
Các phương trình hóa học:(n là hoá trị của R; Đặt khối lượng mol của M là M).
2M + 2n H2O →2M(OH)n + nH2 (1)
3M(OH)n + n AlCl3 → n Al(OH)3 + 3MCln (2)
Có thể: M(OH)n + n Al(OH)3→ M(AlO2)n + 2n H2O (3)
= 0,7.0,5 = 0,35 (mol), \({n_{Al{{(OH)}_3}}}\) = \(\frac{{17,94}}{{78}}\)= 0,23 (mol)
Bài toán phải xét 2 trường hợp:
TH1: AlCl3 chưa bị phản ứng hết ở (2) \( \leftrightarrow \) không có phản ứng (3)
TH2: AlCl3 phản ứng hết ở (2), M(OH)n dư \( \leftrightarrow \) có phản ứng (3)
Lời giải chi tiết:
Các phương trình hóa học:(n là hoá trị của R; Đặt khối lượng mol của M là M).
2M + 2n H2O →2M(OH)n + nH2 (1)
3M(OH)n + n AlCl3 → n Al(OH)3 + 3MCln (2)
Có thể: M(OH)n + n Al(OH)3→ M(AlO2)n + 2n H2O (3)
= 0,7.0,5 = 0,35 (mol), \({n_{Al{{(OH)}_3}}}\) = \(\frac{{17,94}}{{78}}\)= 0,23 (mol)
Bài toán phải xét 2 trường hợp:
TH1: AlCl3 chưa bị phản ứng hết ở (2) \( \leftrightarrow \) không có phản ứng (3)
Từ (2): \({n_{M{{(OH)}_n}}} = \frac{3}{n}.{n_{Al{{(OH)}_3}}} = \frac{3}{n}.0,23 = \frac{{0,69}}{n}\)
Từ (1): \({n_M} = {n_{M{{(OH)}_n}}} = \frac{{0,69}}{n}\)
ta có pt: \(\frac{{0,69}}{n}.M = 26,91 \to \frac{M}{n} = 39\)
Với n = 1 → M = 39 → M là: K
Với n = 2 → M = 78 → loại
Theo (1): \({n_{{H_2}}} = \frac{1}{2}.{n_K} = \frac{1}{2}.0,69 = 0,345\) (mol) → V = 7,728 lít
TH2: AlCl3 phản ứng hết ở (2), M(OH)n dư -> có phản ứng (3)
Từ (2): \({n_{Al{{(OH)}_3}}} = {n_{AlC{l_3}}} = 0,35\) (mol)
Từ (2): \({n_{M{{(OH)}_n}}}\) đã phản ứng \(= \frac{3}{n}.{n_{AlC{l_3}}} = \frac{{3.0,35}}{n} = \frac{{1,05}}{n}\)
Theo bài ra bị tan ở (3) = 0,35 – 0,23 = 0,12 (mol)
Từ (3): \({n_{M{{(OH)}_n}}}\) dư \(= \frac{1}{n}.{n_{Al{{(OH)}_3}}} = \frac{1}{n}.0,12 = \frac{{0,12}}{n}\) (mol)
→Tổng \({n_{M{{(OH)}_n}}} = \frac{{0,12}}{n} + \frac{{1,05}}{n} = \frac{{1,17}}{n}\) (mol)
→ta có pt: \(\frac{{1,17}}{n}.M = 26,91 \to \frac{M}{n} = 23\)
→n = 1→ M = 23 → M là Na
n = 2 → M = 46 → loại
Theo (1): \( {n_{{H_2}}} = \frac{1}{2}.{n_{Na}} = \frac{1}{2}.1,17 = 0,585\) → V = 13,104 lít
Đáp án A
Câu hỏi 24 :
Trộn lẫn 400 ml dung dịch Al2(SO4)3 0,1M với 200 ml dung dịch HCl aM thu được dung dịch A. Cho 0,24 mol Ba(OH)2 vào dung dịch A, lọc kết tủa nung trong không khí đến khối lượng không đổi thu được 30 gam chất rắn. Giá trị của a là?
- A 1,0 hoặc 1,2M
- B 1,0 hoặc 1,8M
- C 1,2 hoặc 1,8 M
- D 1,5M hoặc 1,6 M
Đáp án: B
Phương pháp giải:
Ta có: nAl2(SO4)3= 0,04 mol; nHCl= 0,2a mol
Ba(OH)2+ 2HCl → BaCl2+ 2H2O (1)
0,1a 0,2a mol
3Ba(OH)2+ Al2(SO4)3 →3BaSO4+ 2Al(OH)3 (2)
Ba(OH)2+ 2Al(OH)3 → Ba(AlO2)2+4 H2O (3)
Kết tủa thu được có chứa BaSO4 và Al(OH)3
2Al(OH)3 \(\xrightarrow{{{t^0}}}\) Al2O3+ H2O (4)
Xét 2 trường hợp:
-TH1: Al(OH)3 không bị hòa tan: chỉ xảy ra PT 1, 2, 4
-TH2: Al(OH)3 bị hòa tan 1 phần: xảy ra cả PT 1, 2, 3, 4
Lời giải chi tiết:
Ta có: nAl2(SO4)3= 0,04 mol; nHCl= 0,2a mol
Ba(OH)2+ 2HCl → BaCl2+ 2H2O (1)
0,1a 0,2a mol
3Ba(OH)2+ Al2(SO4)3 →3BaSO4+ 2Al(OH)3 (2)
Ba(OH)2+ 2Al(OH)3 → Ba(AlO2)2+4 H2O (3)
Kết tủa thu được có chứa BaSO4 và Al(OH)3
2Al(OH)3 \(\xrightarrow{{{t^0}}}\) Al2O3+ H2O (4)
Xét 2 trường hợp:
-TH1: Al(OH)3 không bị hòa tan: chỉ xảy ra PT 1, 2, 4
Ta có: nBaSO4= 0,12 mol
→mAl2O3=30- mBaSO4= 30- 0,12.233=2,04 gam → nAl2O3=0,02 mol → nAl(OH)3= 0,04 mol
nBa(OH)2 PT2= 1,5. nAl(OH)3= 0,06 mol;
Ta có; nBa(OH)2= 0,1a+ 0,06= 0,24 → a= 1,8M
-TH2: Al(OH)3 bị hòa tan 1 phần: xảy ra cả PT 1, 2, 3, 4
Ba(OH)2+ 2HCl → BaCl2+ 2H2O (1)
0,1a 0,2a mol
3Ba(OH)2+ Al2(SO4)3 →3BaSO4+ 2Al(OH)3 (2)
0,12 0,04 0,12 0,08
Ba(OH)2+ 2Al(OH)3 → Ba(AlO2)2+4 H2O (3)
0,02 0,04
2Al(OH)3 \(\xrightarrow{{{t^0}}}\) Al2O3+ H2O (4)
nBaSO4= 0,12 mol
→mAl2O3=30- mBaSO4= 30- 0,12.233=2,04 gam → nAl2O3=0,02 mol → nAl(OH)3 sau pứ (3)= 0,04 mol
Ta có nBa(OH)2= 0,1a+ 0,02 + 0,12= 0,24 → a= 1M
Đáp án B
Câu hỏi 25 :
Tiến hành hai thí nghiệm:
-Thí nghiệm 1: Cho 650 ml dung dịch NaOH 2M vào 400 ml dung dịch AlCl3 aM thu được 3b gam kết tủa.
-Thí nghiệm 2: Cho 700 ml dung dịch NaOH 2M vào 400 ml dung dịch AlCl3 aM thu được 2b gam kết tủa.
Giá trị của a, b là:
- A a=1(M); b = 15,6(g)
- B a=2(M); b = 7,8(g)
- C a=2(M); b = 15,6(g)
- D a=1(M); b = 7,8(g)
Đáp án: D
Phương pháp giải:
3NaOH + AlCl3 → Al(OH)3+ 3NaCl (1)
Có thể có: NaOH + Al(OH)3 → NaAlO2 + 2H2O (2)
nNaOH (TN1) = 0,65.2=1,3(mol)
nNaOH (TN2) = 0,7.2=1,4(mol)
nNaOH (TN1) = 1,3<nNaOH (TN2) = 1,4; lượng AlCl3 là như nhau;
mà \({m_{Al{{(OH)}_3}(TN1)}} = 3b > {m_{Al{{(OH)}_3}(TN2)}} = 2b\)
Nên xảy ra 2 trường hợp sau:
Trường hợp 1: Ở thí nghiệm 1 chỉ xảy ra pư (1): NaOH hết, AlCl3 dư.
Ở thí nghiệm 2 xảy ra 2 pư (1), (2): kết tủa Al(OH)3 tan một phần.
Trường hợp 2: Cả 2 thí nghiệm kết tủa Al(OH)3 đều tan một phần.
Lời giải chi tiết:
3NaOH + AlCl3 → Al(OH)3+ 3NaCl (1)
Có thể có: NaOH + Al(OH)3 → NaAlO2 + 2H2O (2)
nNaOH (TN1) = 0,65.2=1,3(mol)
nNaOH (TN2) = 0,7.2=1,4(mol)
nNaOH (TN1) = 1,3<nNaOH (TN2) = 1,4; lượng AlCl3 là như nhau;
mà \({m_{Al{{(OH)}_3}(TN1)}} = 3b > {m_{Al{{(OH)}_3}(TN2)}} = 2b\)
Nên xảy ra 2 trường hợp sau:
Trường hợp 1: Ở thí nghiệm 1 chỉ xảy ra pư (1): NaOH hết, AlCl3 dư.
Ở thí nghiệm 2 xảy ra 2 pư (1), (2): kết tủa Al(OH)3 tan một phần.
+ Xét TN1: \({n_{NaOH}} = 3{n_{Al{{(OH)}_3}}} \to 3.\frac{{3b}}{{78}} = 1,3 \to b = \frac{{169}}{{15}}\)
+ Xét TN2:
Theo (1): \({n_{NaOH}} = 3{n_{AlC{l_3}}} = 3.0,4a = 1,2a\)
Theo (2): \({n_{NaOH}} = {n_{Al{{(OH)}_3}}} = 0,4a - \frac{{2b}}{{78}} \to 1,2a + 0,4a - \frac{{2b}}{{78}} = 1,4\)
→ a= 19/18
Ta thấy: \({n_{AlC{l_3}}} = 0,4a = 0,422(mol);{n_{Al{{(OH)}_3}}} = \frac{{3b}}{{78}} = 0,433(mol) > {n_{AlC{l_3}}} = 0,422(mol)\) → Loại
Trường hợp 2: Cả 2 thí nghiệm kết tủa Al(OH)3 đều tan một phần.
+ Xét TN1:
\(\begin{gathered}
{n_{NaOH(1)}} = 1,2a(mol) \hfill \\
{n_{NaOH(2)}} = {n_{Al{{(OH)}_3}}} = 0,4a - \frac{{3b}}{{78}} \to 1,2a + 0,4a - \frac{{3b}}{{78}} = 1,3 \hfill \\
\to 1,6a - \frac{{3b}}{{78}} = 1,3(I) \hfill \\
\end{gathered} \)
+ Xét TN2:
Theo (1): \({n_{NaOH}} = 3{n_{AlC{l_3}}} = 3.0,4a = 1,2a\)
Theo (2): \({n_{NaOH}} = {n_{Al{{(OH)}_3}}} = 0,4a - \frac{{2b}}{{78}} \to 1,2a + 0,4a - \frac{{2b}}{{78}} = 1,4\)
\( \to 1,6a - \frac{{2b}}{{78}} = 1,4(II)\)
Giải (I), (II) ta được a=1(M); b = 7,8(g)
Đáp án D
>> Học trực tuyến lớp 9 và Lộ trình UP10 trên Tuyensinh247.com Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Lộ trình học tập 3 giai đoạn: Học nền tảng lớp 9, Ôn thi vào lớp 10, Luyện Đề. Bứt phá điểm lớp 9, thi vào lớp 10 kết quả cao. Hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 20 bài tập vận dụng áp dụng định luật bảo toàn khối lượng có lời giải
- 15 bài tập áp dụng định luật tăng giảm khối lượng có lời giải
- 10 bài tập vận dụng áp dụng phương pháp tương đương (công thức trung bình) có lời giải
- 10 câu hỏi vận dụng áp dụng phương pháp biện luận có lời giải
- 10 bài tập vận dụng áp dụng phương pháp bảo toàn nguyên tố có lời giải
- 10 bài tập vận dụng về phương pháp qui đổi có lời giải
- 10 bài tập vận dụng áp dụng phương pháp bảo toàn nguyên tố có lời giải
- 10 câu hỏi vận dụng áp dụng phương pháp biện luận có lời giải
- 10 bài tập vận dụng áp dụng phương pháp tương đương (công thức trung bình) có lời giải
- 15 bài tập áp dụng định luật tăng giảm khối lượng có lời giải








