15 bài tập áp dụng định luật tăng giảm khối lượng có lời giải
Làm đề thiCâu hỏi 1 :
Cho thanh kẽm nhúng vào trong 100ml dung dịch FeSO4 1M. Sau một thời gian lấy đinh sắt lau khô thấy khối lượng thanh kẽm giảm 0,09 gam. Tính CM của dung dịch sau phản ứng coi như thể tích dung dịch thay đổi không đáng kể.
- A CM ZnSO4 = 0,1M
- B CM ZnSO4 = 0,9M
- C CM ZnSO4 = 0,1M và CM FeSO4 = 0,9M
- D
CM ZnSO4 = 0,9M và CM FeSO4 = 0,1M
Đáp án: C
Phương pháp giải:
Zn + FeSO4 → ZnSO4 + Fe
Cứ 1 mol Zn p/u với 1 mol FeSO4 sinh ra 1 mol Fe => mthanh Zn giảm = 9gam
x mol x mol x mol => giảm 0,09 g
=> 9x = 0,09
=> x
Câu hỏi 2 :
Cho một luồng khí clo dư tác dụng với 9,2g kim loại sinh ra 23,4g muối kim loại hoá trị I. Hãy xác định kim loại hoá trị I và muối kim loại đó.
- A Na và NaCl.
- B K và NaCl.
- C K và KCl.
- D Li và LiCl.
Đáp án: A
Phương pháp giải:
Đặt M là kim loại hoá trị I.
PTHH: 2M + Cl2 \(\xrightarrow{{}}\) 2MCl
ĐLBTKL mM + mCl2 = mmuối
=> mCl2 = mmuối - mM
=> nCl2 = ? mol
2M + Cl2 2MCl
nM = 2 nCl2 = ? (mol)
\( = > M = \frac{{9,2}}{{{n_M}}}\)
Lời giải chi tiết:
Đặt M là kim loại hoá trị I.
PTHH: 2M + Cl2 \(\xrightarrow{{}}\) 2MCl
ĐLBTKL mM + mCl2 = mmuối
=> mCl2 = 23,4 - 9,2 =14,2
=> nCl2= 14,2: 71 = 0,2 mol
2M + Cl2 \(\xrightarrow{{}}\) 2MCl
0,4 0,2
=> M = 9,2: 0,4= 23 (Na)
=> muối : NaCl
Đáp án A
Câu hỏi 3 :
Nhúng 1 thanh nhôm nặng 45 gam vào 400 ml dung dịch CuSO4 0,5M. Sau một thời gian lấy thanh nhôm ra cân nặng 46,38 gam. Khối lượng Cu thoát ra là bao nhiêu?
- A 6,4 (g).
- B 1,38 (g).
- C 3,84 (g).
- D 1,92 (g).
Đáp án: D
Phương pháp giải:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
Cứ 2 mol Al p/u với 3 mol CuSO4 sinh ra 3 mol Cu => mthanh Al tăng = 3.64-2.27=138 gam
x mol 1,5x mol 1,5x mol => mthanh Al tăng = 1,5x.64-27x=69x gam
Theo bài khối lượng tăng là 46,38 - 45 = 1,38gam
=> 69x= 1,38
=>x=? => mCu = ?
Lời giải chi tiết:
Đặt số mol Al pư là x (mol)
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
Cứ 2 mol Al p/u với 3 mol CuSO4 sinh ra 3 mol Cu => mthanh Al tăng = 3.64-2.27=138 gam
x mol 1,5x mol 1,5x mol => mthanh Al tăng = 1,5x.64-27x=69x gam
Theo bài khối lượng tăng là 46,38 - 45 = 1,38gam
=> 69x= 1,38
=> x= 0,02
=> nCu = 1,5x = 1,5.0,02 = 0,03 (mol)
=> mCu = 0,03.64= 1,92 gam
Đáp án D
Câu hỏi 4 :
Cho 24,4 gam hỗn hợp Na2CO3, K2CO3 tác dụng vừa đủ với dung dịch BaCl2. Sau phản ứng thu được 39,4 gam kết tủa. Lọc tách kết tủa, cô cạn dung dịch thu được m gam muối clorua. Tính giá trị của m?
- A 26,6 (g).
- B 13,3 (g).
- C 38,6 (g).
- D
19,3 (g).
Đáp án: A
Phương pháp giải:
\({n_{BaC{l_2}}} = {n_{BaC{{\text{O}}_3}}} = \frac{{m \downarrow }}{{197}} = ?mol\)
M2CO3 + BaCl2 →2MCl + BaCO3
ĐLBTKL
mhh + mBaCl2 = mkết tủa + m
=> m
Lời giải chi tiết:
\({n_{BaC{l_2}}} = {n_{BaC{{\text{O}}_3}}} = \frac{{39,4}}{{197}} = 0,2mol\)
M2CO3 + BaCl2 →2MCl + BaCO3
ĐLBTKL
mhh + mBaCl2 = mkết tủa + m
24,4 + 0,2.208 = 39,4 + m
=> m= 24,4 + 0,2.208 – 39,4 = 26,6 gam
Đáp án A
Câu hỏi 5 :
Nhúng một thanh sắt và một thanh kẽm vào cùng một cốc chứa 500 ml dung dịch CuSO4. Sau một thời gian lấy hai thanh kim loại ra khỏi cốc thì mỗi thanh có thêm Cu bám vào, khối lượng dung dịch trong cốc bị giảm mất 0,22g. Trong dung dịch sau phản ứng, nồng độ mol của ZnSO4 gấp 2,5 lần nồng độ mol của FeSO4. Thêm dung dịch NaOH dư vào cốc, lọc lấy kết tủa rồi nung ngoài không khí đến khối lượng không đổi , thu được 14,5g chất rắn. Số gam Cu bám trên mỗi thanh kim loại và nồng độ mol của dung dịch CuSO4 ban đầu là bao nhiêu?
- A 6,4 (g) và 0,5625 M.
- B 3,2 (g) và 0,28125 M.
- C 6,4 (g) và 1,125 M.
- D
3,2 (g) và 0,5625 M.
Đáp án: A
Phương pháp giải:
Fe + CuSO4 \(\xrightarrow{{}}\) FeSO4 + Cu (1)
Zn + CuSO4 \(\xrightarrow{{}}\) ZnSO4 + Cu (2)
Gọi a là số mol của FeSO4 => nZnSO4 = 2,5 a
mthanh Fe tăng= (64 - 56)a = 8a (g)
mthanh Zn giảm = (65 - 64)2,5a = 2,5a (g)
m2 thanh tăng= 8a - 2,5a = 5,5a = 0,22 gam a = ? (mol)
=> mCu trên thanh Fe = 64.0,04 = 2,56 g
mCu trên thanh Zn = 64.2,5.0,04 = 6,4 g
Dung dịch sau phản ứng : FeSO4 :0,04 mol
ZnSO4 : 0,1 mol
CuSO4
FeSO4 \(\xrightarrow{{NaOH\,du}}\) Fe(OH)2 \(\xrightarrow{{t0,\,kk}}\) Fe2O3
a a \(\frac{a}{2}\) (mol)
CuSO4 \(\xrightarrow{{}}\) Cu(OH)2 \(\xrightarrow{{}}\) CuO
b b b (mol)
moxit = 14,5, a=0,04 => b => CM (CuSO4)
Lời giải chi tiết:
Fe + CuSO4 \(\xrightarrow{{}}\) FeSO4 + Cu (1)
Zn + CuSO4 \(\xrightarrow{{}}\) ZnSO4 + Cu (2)
Gọi a là số mol của FeSO4 => nZnSO4 = 2,5 a
mthanh Fe tăng=(64 - 56)a = 8a (g)
mthanh Zn giảm = (65 - 64)2,5a = 2,5a (g)
m2 thanh tăng= 8a - 2,5a = 5,5a =0,22 gam a = 0,04 (mol)
=> mCu trên thanh Fe = 64.0,04 = 2,56 g
mCu trên thanh Zn = 64.2,5.0,04 = 6,4 g
Dung dịch sau phản ứng : FeSO4 :0,04 mol
ZnSO4 : 0,1 mol
CuSO4
FeSO4 \(\xrightarrow{{NaOH\,du}}\) Fe(OH)2 \(\xrightarrow{{t0,\,kk}}\) \(\frac{1}{2}\) Fe2O3
a a \(\frac{a}{2}\) (mol)
\({m_{F{e_2}{O_3}}} = \,\,160.0,04.\frac{a}{2}\,\, = \,\,3,2\,\,(g)\)
CuSO4 \(\xrightarrow{{NaOH\,\,du}}\) Cu(OH)2 \(\xrightarrow{{{t^0}}}\) CuO
b b b (mol)
mCuO = 80b = 14,5 - 3,2 = 11,3 (g) b = 0,14125 (mol)
Vậy ∑ nCuSO4 ban đầu = a + 2,5a + b = 0,28125 (mol)
=> CM CuSO4 = \(\frac{{0,28125}}{{0,5}}\) = 0,5625 M
Đáp án A
Câu hỏi 6 :
Nhúng một thanh sắt nặng 16 gam vào 500 ml dung dịch CuSO4 2M. Sau một thời gian lấy lá sắt ra cân lại thấy nặng 17,6 gam. Xem thể tích dung dịch không thay đổi thì nồng độ mol/lit của CuSO4 trong dung dịch sau phản ứng là bao nhiêu?
- A 0,8 M.
- B 1,6 M.
- C 2,0 M.
- D 3,2 M.
Đáp án: B
Phương pháp giải:
Tính nCuSO4 ban đầu = ? (mol)
Tính mFe tăng = mFe sau – mFe bđ = 1,6 gam
Fe + CuSO4 \(\xrightarrow{{}}\) FeSO4 + Cu (1)
1 mol 1 mol => mFe tăng = 64-56= 8gam
x mol x mol => mFe tăng = 64x - 56x = 8x = 1,6g
=> x
Lời giải chi tiết:
nCuSO4 ban đầu = 0,5.2= 1 (mol)
mFe tăng = 17,6- 16= 1,6 gam
Fe + CuSO4 \(\xrightarrow{{}}\) FeSO4 + Cu (1)
1 mol 1 mol => mFe tăng = 64-56= 8gam
x mol x mol => mFe tăng = 64x -56x = 8x = 1,6g
=> x= 0,2 ( mol)
=> nCuSO4 (p/u) = 0,2 (mol)
=> nCuSO4 dư = 1-0,2 =0,8 mol
=> CM CuSO = M
Đáp án B
Câu hỏi 7 :
Nhúng một thanh kim loại M hoá trị II vào 0,5 lit dd CuSO4 0,2M. Sau một thời gian phản ứng, khối lượng thanh M tăng lên 0,40g trong khi nồng độ CuSO4 còn lại là 0,1M.
Câu 1:
a. Xác định kim loại M.
- A Zn .
- B Mg.
- C Fe.
- D Ba.
Đáp án: C
Phương pháp giải:
a. nCuSO4 (p/u) = 0,5.(0,2-0,1)= 0,05 mol
M + CuSO4 \(\xrightarrow{{}}\) MSO4 + Cu
0,05 0,05 0,05
m thanh M tăng = mCu - mM = 0,05.64 –0,05. M = 0,40 gam
=> M=?
Lời giải chi tiết:
a. nCuSO4 (p/u) = 0,5.(0,2 - 0,1)= 0,05 mol
M + CuSO4 → MSO4 + Cu
0,05 0,05 0,05
m thanh M tăng = mCu - mM = 0,05.64 –0,05. M = 0,40 gam
=> M=56 (Fe)
Đáp án C
Câu 2:
b. Lấy m(g) kim loại M cho vào 1 lit dd chứa AgNO3 và Cu(NO3)2 , nồng độ mỗi muối là 0,1M. Sau phản ứng ta thu được chất rắn A khối lượng 15,28g và dd B. Tính m(g)?
- A 6,72 (g).
- B 2,88 (g).
- C 7,8 (g).
- D 5,6 (g).
Đáp án: A
Phương pháp giải:
nAgNO3 = 0,1.1=0,1 mol
nCu(NO3)2 = 0,1.1=0,1 mol
ta chỉ biết số mol của AgNO3 và số mol của Cu(NO3)2. Nhưng không biết số mol của Fe
Ag Có Tính oxi hoá mạnh hơn Cu nên muối AgNO3 tham gia phản ứng với Fe trước.
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (1)
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu (2)
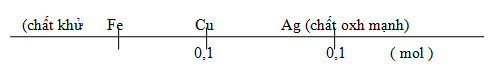
+ Giả sử xảy ra phản ứng (1): Ag kết tủa hết, Fe tan hết, Cu(NO3)2 chưa phản ứng.
Chất rắn A là Ag thì ta có: mA = 0,1 . 108 = 10,8 g
+ Giả sử xảy ra cả phản ứng (1) và (2) thì khi đó chất rắn A gồm: 0,1 mol Ag và 0,1 mol Cu
mA = 0,1 ( 108 + 64 ) = 17,2 g
theo đề cho mA = 15,28 g ta có: 10,8 < 15,28 < 17,2
=> AgNO3 phản ứng hết, Cu(NO3)2 phản ứng một phần và Fe tan hết.
Lời giải chi tiết:
b.
nAgNO3 = 0,1.1=0,1 mol
nCu(NO3)2 = 0,1.1=0,1 mol
ta chỉ biết số mol của AgNO3 và số mol của Cu(NO3)2. Nhưng không biết số mol của Fe
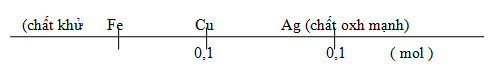
Ag Có Tính oxi hoá mạnh hơn Cu nên muối AgNO3 tham gia phản ứng với Fe trước.
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (1)
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu (2)
+ Giả sử xảy ra phản ứng (1): Ag kết tủa hết, Fe tan hết, Cu(NO3)2 chưa phản ứng.
Chất rắn A là Ag thì ta có: mA = 0,1 . 108 = 10,8 g
+ Giả sử xảy ra cả phản ứng (1) và (2) thì khi đó chất rắn A gồm: 0,1 mol Ag và 0,1 mol Cu
mA = 0,1 ( 108 + 64 ) = 17,2 g
theo đề cho mA = 15,28 g ta có: 10,8 < 15,28 < 17,2
=> AgNO3 phản ứng hết, Cu(NO3)2 phản ứng một phần và Fe tan hết.
mCu tạo ra = mA – mAg = 15,28 – 10,80 = 4,48 g => nCu = 4,48:64 = 0,07 mol.
nFe p/u = nFe (1) + nFe (2) = 0,05 + 0,07 =0,12 mol
=> mFe ban đầu = 6,72 gam
Đáp án A
Câu hỏi 8 :
2 thanh kim loại giống nhau đều tạo bởi nguyên tố R(II) và có cùng khối lượng. Cho thanh thứ nhất vào dung dịch Cu(NO3)2 và thanh thứ 2 Pb (NO3)2 . Sau một thời gian, khi số mol hai muối phản ứng bằng nhau. Lấy 2 thanh kim loại ấy ra khỏi dung dịch thấy khối lượng thanh thứ nhất giảm 0,2 % còn khối lượng thanh thứ 2 tăng 28,4%. tìm nguyên tố R
- A Zn.
- B Mg.
- C Fe.
- D
Ba.
Đáp án: A
Phương pháp giải:
Giả sử khối lượng thanh kim loại là 100 g
m thanh R giảm = \(\frac{{0,2}}{{100}}.100 = 0,2\) gam
m thanh R tăng = \(\frac{{28,4}}{{100}}.100 = 28,4\) gam
R + Cu(NO3)2 → R(NO3)2 + Cu
x mol x mol => mgiảm = Rx-64x =0,2 nH2SO4
R + Pb(NO3)2 → R(NO3)2 + Pb
x mol x mol => mtăng = 207x-Rx =28,4
\(\left\{ \begin{gathered}
R{\text{x}} - 64x = 0,2 \hfill \\
207{\text{x}} - R{\text{x}} = 28,4 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
R{\text{x}} - 64x = 0,2 \hfill \\
- R{\text{x + 207x}} = 28,4 \hfill \\
\end{gathered} \right.\)
=> x, R
Lời giải chi tiết:
Giả sử khối lượng thanh kim loại là 100 g
m thanh R giảm = \(\frac{{0,2}}{{100}}.100 = 0,2\) gam
m thanh R tăng = \(\frac{{28,4}}{{100}}.100 = 28,4\) gam
R + Cu(NO3)2 → R(NO3)2 + Cu
x mol x mol => mgiảm = Rx-64x =0,2 nH2SO4
R + Pb(NO3)2 → R(NO3)2 + Pb
x mol x mol => mtăng = 207x-Rx =28,4
\(\left\{ \begin{gathered}
R{\text{x}} - 64x = 0,2 \hfill \\
207{\text{x}} - R{\text{x}} = 28,4 \hfill \\
\end{gathered} \right. \to \left\{ \begin{gathered}
R{\text{x}} - 64x = 0,2 \hfill \\
- R{\text{x + 207x}} = 28,4 \hfill \\
\end{gathered} \right.\)
Cộng 2 phương trình => 207x- 64x = 28,6
=> 143x= 28,6
=> x= 0,2 mol
=> R= 65 (Zn)
Đáp án A
Câu hỏi 9 :
Nhúng một thanh sắt nặng 16 gam vào 500 ml dung dịch CuSO4 2M. Sau một thời gian lấy lá sắt ra cân lại thấy nặng 17,6 gam. Xem thể tích dung dịch không thay đổi thì nồng độ mol/lit của CuSO4 trong dung dịch sau phản ứng là bao nhiêu?
- A 0,8 M.
- B 1,6 M.
- C 2,0 M.
- D 3,2 M.
Đáp án: B
Phương pháp giải:
Tính nCuSO4 ban đầu = ? (mol)
Tính mFe tăng = mFe sau – mFe bđ = 1,6 gam
Fe + CuSO4 \(\xrightarrow{{}}\) FeSO4 + Cu (1)
1 mol 1 mol => mFe tăng = 64-56= 8gam
x mol x mol => mFe tăng = 64x - 56x = 8x = 1,6g
=> x
Lời giải chi tiết:
nCuSO4 ban đầu = 0,5.2= 1 (mol)
mFe tăng = 17,6- 16= 1,6 gam
Fe + CuSO4 \(\xrightarrow{{}}\) FeSO4 + Cu (1)
1 mol 1 mol => mFe tăng = 64-56= 8gam
x mol x mol => mFe tăng = 64x -56x = 8x = 1,6g
=> x= 0,2 ( mol)
=> nCuSO4 (p/u) = 0,2 (mol)
=> nCuSO4 dư = 1-0,2 =0,8 mol
=> CM CuSO = M
Đáp án B
Câu hỏi 10 :
Cho hiđrocacbon X có công thức phân tử CnH2n+2 (có tính chất tương tự metan) tác dụng với clo (ánh sáng) thu được 15,75 gam hỗn hợp các sản phẩm thế monoclo và điclo. Khí HCl sinh ra được hấp thụ hoàn toàn bằng nước sau đó trung hòa bằng dung dịch NaOH thấy tốn hết 250 ml dung dịch NaOH 1,2M. Xác định công thức phân tử của X
- A CH4
- B C2H6
- C C3H8
- D C4H10
Đáp án: B
Phương pháp giải:
nNaOH= CM.V = 1,2.0,25= 0,3 mol
CnH2n+2 + Cl2 \(\xrightarrow{{{\text{askt}}}}\) CnH2n+1Cl + HCl
CnH2n+2 + 2Cl2 \(\xrightarrow{{{\text{askt}}}}\) CnH2nCl2 + 2HCl
HCl + NaOH → NaCl + H2O
0,3 0,3
nNaOH= nHCl= nCl2 = 0,3 mol
Theo ĐLBTKL:
mankan = msản phẩm thế + mHCl - mCl2
= 15,75 + 36,5.0,3 – 71,0,3 = 5,4 gam
=> 0,15 < nankan < 0,3
=> 5,4/0,3 < Mankan < 5,4/0,15
=> 18 < 14n + 2 < 36
=> n
Lời giải chi tiết:
nNaOH= CM.V = 1,2.0,25= 0,3 mol
CnH2n+2 + Cl2 \(\xrightarrow{{{\text{askt}}}}\) CnH2n+1Cl + HCl
CnH2n+2 + 2Cl2 \(\xrightarrow{{{\text{askt}}}}\) CnH2nCl2 + 2HCl
HCl + NaOH → NaCl + H2O
0,3 0,3
nNaOH= nHCl= nCl2 = 0,3 mol
Theo ĐLBTKL:
mankan = msản phẩm thế + mHCl - mCl2
= 15,75 + 36,5.0,3 – 71,0,3 = 5,4 gam
=> 0,15 < nankan < 0,3
=> 5,4/0,3 < Mankan < 5,4/0,15
=> 18 < 14n + 2 < 36
=> 1,14 < n < 2,43 → n = 2
→ CTPT ankan: C2H6
Đáp án B
Câu hỏi 11 :
Thổi rất chậm 0,224 lít khí (đktc) CO qua một ống sứ đựng hỗn hợp bột Al2O3, CuO, Fe3O4, Fe2O3 có khối lượng 2,4 gam nung nóng. Hỗn hợp khí thoát ra khỏi ống sứ hấp thụ hoàn toàn bởi dung dịch Ca(OH)2 dư thì thu được 0,5 g kết tủa. Khối lượng chất rắn còn lại trong ống sứ là:
- A 2,32 gam.
- B 2,46 gam.
- C 0,8 gam.
- D 1,6 gam.
Đáp án: A
Phương pháp giải:
nCO pư = nCO2 = nCaCO3 = ?
Bảo toàn khối lượng ta có: mCO pư + mOxit = mrắn + mCO2
Lời giải chi tiết:
nCO(đktc) ban đầu = VCO : 22,4 = 0,224 : 22,4 = 0,01 (mol)
Cho CO vào hh các oxit trên chỉ có CuO, Fe3O4, Fe2O3 bị khử, còn Al2O3 không bị khử.
PTHH có thể xảy ra là: CO + CuO \(\xrightarrow{{{t^0}}}\)Cu + CO2 (1)
4CO + Fe3O4 \(\xrightarrow{{{t^0}}}\)3Fe + 4CO2 (2)
3CO + Fe2O3 \(\xrightarrow{{{t^0}}}\) 2Fe + 3CO2 (3)
Hỗn hợp khí thoát ra gồm CO2 và CO dư. Cho hh khí hấp thụ vào Ca(OH)2 dư chỉ có CO2 hấp thụ
CO2 + Ca(OH)2 → CaCO3 + H2O (4)
0,005 ← 0,005
nCaCO3 = mCaCO3 : MCaCO3 = 0,5 : 100 = 0,005 (mol)
Theo PTHH (4): nCO2 = nCaCO3 = 0,005 (mol)
Theo PTHH (1), (2), (3): nCO pư = nCO2 = 0,005 (mol)
Bảo toàn khối lượng ta có:
mCO pư + mOxit = mrắn + mCO2
→ 0,005.28 + 2,4 = mrắn + 0,005.44
→ mrắn = 2,32 (g)
Đáp án A
Câu hỏi 12 :
Hai cốc thủy tinh A, B đựng dung dịch HCl dư đặt trên hai đĩa cân, thấy cân ở trạng thái thăng bằng. Cho 5 gam CaCO3 vào cốc A và 4,79 gam M2CO3 (M là kim loại) vào cốc B. Sau khi các muối đã hòa tan hoàn toàn thấy cân trở lại vị trí thăng bằng. Hãy xác định M.
- A K
- B Na
- C Li
- D Ag
Đáp án: B
Phương pháp giải:
nCaCO3 = 5/100= 0,05 mol
CaCO3 + 2HCl → CaCl2 + H2O + CO2
0,05 0,05
M2CO3 + 2HCl → 2 MCl + H2O + CO2
\(\frac{{4,79}}{{2M + 60}}\) \(\frac{{4,79}}{{2M + 60}}\)
mcốc A tăng = mCaCO3 - mCO2 = 5-0,05.44= 2,8 gam
mcốc B tăng = \(\frac{{(2M + 60 - 44).4,79}}{{2M + 60}} = \frac{{(2M + 16).4,79}}{{2M + 60}} = 2,8\)
Lời giải chi tiết:
nCaCO3 = 5/100= 0,05 mol
CaCO3 + 2HCl → CaCl2 + H2O + CO2
0,05 0,05
M2CO3 + 2HCl → 2 MCl + H2O + CO2
\(\frac{{4,79}}{{2M + 60}}\) \(\frac{{4,79}}{{2M + 60}}\)
mcốc A tăng = mCaCO3 - mCO2 = 5-0,05.44= 2,8 gam
mcốc B tăng = \(\frac{{(2M + 60 - 44).4,79}}{{2M + 60}} = \frac{{(2M + 16).4,79}}{{2M + 60}} = 2,8\)
=> M = 23 (Na)
Đáp án B
Câu hỏi 13 :
Cho một luồng khí clo dư tác dụng với 9,2g kim loại sinh ra 23,4g muối kim loại hoá trị I. Hãy xác định kim loại hoá trị I và muối kim loại đó.
- A Na và NaCl.
- B K và NaCl.
- C K và KCl.
- D Li và LiCl.
Đáp án: A
Phương pháp giải:
Đặt M là kim loại hoá trị I.
PTHH: 2M + Cl2 \(\xrightarrow{{}}\) 2MCl
ĐLBTKL mM + mCl2 = mmuối
=> mCl2 = mmuối - mM
=> nCl2 = ? mol
2M + Cl2 2MCl
nM = 2 nCl2 = ? (mol)
\( = > M = \frac{{9,2}}{{{n_M}}}\)
Lời giải chi tiết:
Đặt M là kim loại hoá trị I.
PTHH: 2M + Cl2 \(\xrightarrow{{}}\) 2MCl
ĐLBTKL mM + mCl2 = mmuối
=> mCl2 = 23,4 - 9,2 =14,2
=> nCl2= 14,2: 71 = 0,2 mol
2M + Cl2 \(\xrightarrow{{}}\) 2MCl
0,4 0,2
=> M = 9,2: 0,4= 23 (Na)
=> muối : NaCl
Đáp án A
Câu hỏi 14 :
Thổi một luồng khí CO dư qua ống sứ đựng m gam hỗn hợp gồm CuO, Fe2O3, FeO, Al2O3 nung nóng thu được 2,5 gam chất rắn. Toàn bộ khí thoát ra sục vào nước vôi trong dư thấy có 15 gam kết tủa trắng. Tính khối lượng của hỗn hợp oxit kim loại ban đầu .
- A 9,4(g).
- B 3,7(g).
- C 4,9 (g).
- D 7,3 (g).
Đáp án: C
Phương pháp giải:
nCaCO3 = m↓/100 = ? mol
CO2 + Ca(OH)2 → CaCO3 + H2O
nCO2 = nCa(OH)2 = ? (mol)
Oxit + CO → Chất rắn + CO2
nCO = nCO2 = ? mol
ĐLBTKL
moxit + mCO = mchất rắn + mCO2
=> moxit
Câu hỏi 15 :
Chia 5,1 gam hỗn hợp hai kim loại có hóa trị không đổi thành 2 phần bằng nhau:
- Phần 1: Bị oxi hóa hoàn toàn thu được 4,55 gam hỗn hợp oxit
- Phần 2: tan hoàn toàn trong dung dịch HCl dư thu được V lít khí H2 (đktc). Cô cạn dung dịch thu được m gam muối khan
Tính V, m
- A V= 2,8 lít và m = 5,6 (g).
- B V=2,8 lít và m = 11,452 (g).
- C V=2,8 lít và m = 11,425 (g).
- D
V=5,6 lít và m = 11,425 (g).
Đáp án: C
Phương pháp giải:
4M +x O2 →2M2Ox
2,55 + mO2 = 4,55
=> nO2
4M + 4xHCl → 4MClx + 2x H2
=> nH2 = 2nO2 => VH2
4M + 4xHCl → 4MClx + 2x H2
BTKL
mKl + mHCl = m + mH2
=> m= ? g
Lời giải chi tiết:
4M +x O2 →2M2Ox
2,55 + mO2 = 4,55
=> nO2 = 0,0625 mol
4M + 4xHCl → 4MClx + 2xH2
=> nH2 = 2nO2 = 2.0,0625=0,125 mol
=> VH2 = 22,4.0,125= 2,8 lít
4M + 4xHCl → 4MClx + 2xH2
0,25 0,125
BTKL:
mKl + mHCl = m + mH2
2,55 + 0,25.36,5= m + 0,125.2
=> m= 11,425 g
Đáp án C
>> Học trực tuyến lớp 9 và Lộ trình UP10 trên Tuyensinh247.com Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Lộ trình học tập 3 giai đoạn: Học nền tảng lớp 9, Ôn thi vào lớp 10, Luyện Đề. Bứt phá điểm lớp 9, thi vào lớp 10 kết quả cao. Hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 20 bài tập vận dụng áp dụng định luật bảo toàn khối lượng có lời giải
- 15 bài tập áp dụng định luật tăng giảm khối lượng có lời giải
- 10 bài tập vận dụng áp dụng phương pháp tương đương (công thức trung bình) có lời giải
- 10 câu hỏi vận dụng áp dụng phương pháp biện luận có lời giải
- 10 bài tập vận dụng áp dụng phương pháp bảo toàn nguyên tố có lời giải
- 10 bài tập vận dụng về phương pháp qui đổi có lời giải
- 10 bài tập vận dụng áp dụng phương pháp bảo toàn nguyên tố có lời giải
- 10 câu hỏi vận dụng áp dụng phương pháp biện luận có lời giải
- 10 bài tập vận dụng áp dụng phương pháp tương đương (công thức trung bình) có lời giải
- 15 bài tập áp dụng định luật tăng giảm khối lượng có lời giải







