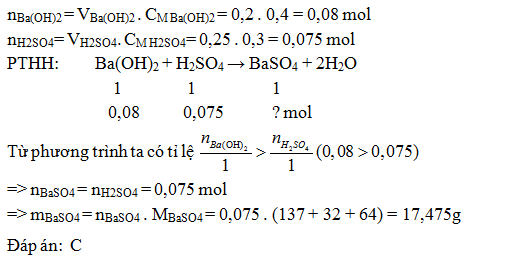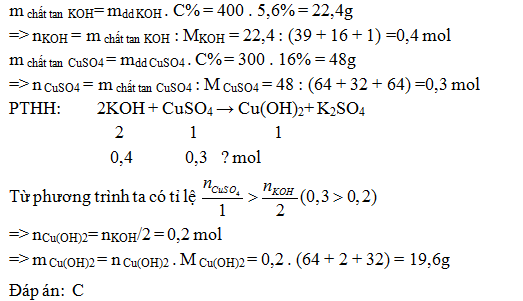20 bài tập về tính chất hóa học của bazo có lời giải
Làm đề thiCâu hỏi 1 :
Sục 2,24 lít khí CO2 vào dung dịch chứa 0,2 mol NaOH. Dung dịch thu được sau phản ứng chứa:
- A NaHCO3
- B Na2CO3
- C Na2CO3 và NaOH
- D NaHCO3 và NaOH
Đáp án: B
Phương pháp giải:
Đổi số mol CO2: nCO2 = VCO2 : 22,4 = ?
So sánh số mol CO2 với số mol NaOH => kết luận tạo thành muối gì?
Lời giải chi tiết:
nCO2 = VCO2 : 22,4 = 2,24 : 22,4 = 0,1 mol
PTHH: 2NaOH + CO2 → Na2CO3 + H2O
PT 2 1
ĐB 0,2 0,1
Từ PTHH ta có CO2 phản ứng vừa đủ với NaOH => dd chỉ chứa Na2CO3
Đáp án B
Câu hỏi 2 :
Cho 100ml dung dịch Ba(OH)2 0,1M vào 100ml dung dịch HCl 0,1M. Dung dịch thu được sau phản ứng:
- A Làm quỳ tím hoá xanh
- B Làm quỳ tím hoá đỏ
- C Phản ứng được với magiê giải phóng khí hidrô
- D Không làm đổi màu quỳ tím
Đáp án: A
Phương pháp giải:
Đổi số mol : nBa(OH)2 = VBa(OH)2 . CM Ba(OH)2 = ? mol
nHCl= VHCl. CM HCl = ? mol
Viết PTHH xảy ra:
Ba(OH)2 + 2HCl → BaCl2 + H2O
So sánh Ba(OH)2 và HCl xem chất nào phản ứng hết, chất nào phản ứng dư
=> Từ đó đưa ra được kết luận đúng
Lời giải chi tiết:
nBa(OH)2 = VBa(OH)2 . CM Ba(OH)2 = 0,1 . 0,1 = 0,01 mol
nHCl= VHCl. CM HCl = 0,1 . 0,1 = 0,01 mol
PTHH: Ba(OH)2 + 2HCl → BaCl2 + H2O
1 2
0,01 0,01
Từ phương trình ta có tỉ lệ \(\frac{{{n_{Ba{{(OH)}_2}}}}}{1} > \frac{{{n_{HCl}}}}{2}(0,01 > 0,005)\)
=> Ba(OH)2 dư => dd có môi trường bazo
=> dd sau phản ứng làm quỳ hóa xanh
Đáp án A
Câu hỏi 3 :
Dẫn 1,68 lít khí CO2 (đktc) vào x g dung dịch KOH 5,6%. Để thu được muối KHCO3 duy nhất thì x có giá trị là:
- A 75g
- B 150 g
- C 225 g
- D 300 g
Đáp án: A
Phương pháp giải:
Đổi số mol : nCO2 = VCO2 : 22,4 = ? mol
Viết PTHH xảy ra: CO2 + KOH → KHCO3
Tính toán số mol của KOH theo mol CO2 => x = ?
Lời giải chi tiết:
nCO2 = 0,075 mol
Để phản ứng chỉ thu được muối KHCO3 duy nhất thì chỉ có phản ứng dưới đây xảy ra
CO2 + KOH → KHCO3
Tỉ lệ 1 1
Phản ứng 0,075 ? mol
Từ phương trình => nKOH = nCO2 = 0,075 mol
=> mKOH = nKOH . MKOH = 0,075 . (39 + 16 + 1) = 4,2g
C% = \(\frac{{{m_{ctKOH}}}}{{{m_{{\text{dd}}KOH}}}}.100\% = > {m_{{\text{dd}}KOH}} = \frac{{{m_{ctKOH}}}}{{C\% }} = \frac{{4,2}}{{5,6\% }} = 75g\)
Đáp án A
Câu hỏi 4 :
Dùng 400ml dung dịch Ba(OH)2 0,1M hấp thụ hoàn toàn V lít khí SO2 (đktc). Sau phản ứng thu được muối BaSO3 không tan. Giá trị bằng số của V là:
- A 0,896 lít
- B 0,448 lít
- C 8,960 lít
- D 4,480 lít
Đáp án: A
Phương pháp giải:
Đổi số mol : nBa(OH)2 = VBa(OH)2. CM Ba(OH)2 = ? mol
Viết PTHH xảy ra: SO2 + Ba(OH)2 → BaSO3↓ + H2O
Tính toán số mol của SO2 theo mol Ba(OH)2
Lời giải chi tiết:
nBa(OH)2 = 0,04 mol
SO2 + Ba(OH)2 → BaSO3 + H2O
Tỉ lệ 1 1
Phản ứng ?mol 0,04 mol
Từ phương trình => nSO2= n Ba(OH)2 = 0,04 mol
=> VSO2 = nCO2 . 22,4 = 0,04 . 22,4 = 0,896 lít
Đáp án A
Câu hỏi 5 :
Nhiệt phân hoàn toàn 19,6g Cu(OH)2 thu được một chất rắn màu đen, dùng khí H2 dư khử chất rắn màu đen đó thu được một chất rắn màu đỏ có khối lượng là:
- A 6,4 g
- B 9,6 g
- C 12, 8 g
- D 16 g
Đáp án: C
Phương pháp giải:
Đổi số mol : nCu(OH)2 = mCu(OH)2/ MCu(OH)2 =
Tính toán số mol các chất theo phương trình sau:
\(\begin{gathered}
Cu{(OH)_2}\xrightarrow{{{t^0}}}CuO + {H_2}O \hfill \\
CuO + {H_2}\xrightarrow{{{t^0}}}Cu + {H_2}O \hfill \\
\end{gathered} \)
Lời giải chi tiết:
nCu(OH)2 = mCu(OH)2/ MCu(OH)2 = 19,6 : (64 + 2 + 32) = 0,2 mol
Cu(OH)2 \(\xrightarrow{{{t^0}}}\)CuO + H2O
Tỉ lệ 1 1
Pứ 0,2 ? mol
Từ pt => nCuO = nCu(OH)2 = 0,2 mol
CuO + H2 \(\xrightarrow{{{t^0}}}\) Cu + H2O
Tỉ lệ 1 1
Pứ 0,2 ? mol
Từ pt => nCu = nCuO= 0,2 mol
=> mCu = nCu . MCu = 0,2 . 64 = 12,8g
Đáp án C
Câu hỏi 6 :
Cho 200ml dung dịch Ba(OH)2 0,4M vào 250ml dung dịch H2SO4 0,3M. Khối lượng kết tủa thu được là:
- A 17,645 g
- B 16,475 g
- C 17,475 g
- D 18,645 g
Đáp án: C
Phương pháp giải:
Đổi số mol nBa(OH)2 = VBa(OH)2 . CM Ba(OH)2 = ? mol
nH2SO4= VH2SO4. CM H2SO4= ? mol
PTHH: Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
Từ phương trình hóa học xác định xem Ba(OH)2 hay H2SO4 phản ứng hết.
Mọi tính toán theo chất phản ứng hết.
Lời giải chi tiết:
Câu hỏi 7 :
Trộn 400g dung dịch KOH 5,6% với 300g dung dịch CuSO4 16%. Khối lượng kết tủa thu được là:
- A 9,8 g
- B 14,7 g
- C 19,6 g
- D 29,4 g
Đáp án: C
Phương pháp giải:
Đổi số mol của KOH:
m chất tan KOH= mdd KOH . C% :100% = ? g
=> nKOH = m chất tan KOH : MKOH = ? mol
m chất tan CuSO4 = mdd CuSO4 . C%= ? g
=> n CuSO4 = m chất tan CuSO4 : M CuSO4 = ? mol
PTHH: 2KOH + CuSO4 → Cu(OH)2↓+ K2SO4
So sánh xem KOH và CuSO4 chất nào phản ứng hết. Mọi tính toán theo chất phản ứng hết.
Lời giải chi tiết:
Câu hỏi 8 :
Nhiệt phân hoàn toàn x g Fe(OH)3 đến khối lượng không đổi thu được 24g chất rắn. Giá trị bằng số của x là:
- A 16,05g
- B 32,10g
- C 48,15g
- D 72,25g
Đáp án: B
Phương pháp giải:
Đổi số mol : nFe2O3 = m Fe2O3/ M Fe2O3 = ? mol
PTHH: 2Fe(OH)3 \(\xrightarrow{{{t^0}}}\) Fe2O3 + 3H2O
Tính mol Fe2O3 theo số mol của Fe(OH)3
Lời giải chi tiết:
nFe2O3 = m Fe2O3/ M Fe2O3 = 24 : (56 . 2 + 16 . 3) = 0,15 mol
2Fe(OH)3 \(\xrightarrow{{{t^0}}}\) Fe2O3 + 3H2O
Tỉ lệ 2 1
Pứ ?mol 0,15 mol
Từ pt => nFe2O3 = 2. nFe(OH)3= 0,3 mol
mFe(OH)3 = nFe(OH)3 . MFe(OH)3 = 0,3 . (56 + 3 + 16 . 3) = 32,1 g
Đáp án B
Câu hỏi 9 :
Trung hoà hoàn toàn 200ml dung dịch KOH 0,5M bằng 200g dung dịch HCl a%. Nồng độ phần trăm của dung dịch ( a%) là:
- A 1,825%
- B 3,650%
- C 18,25%
- D 36,50%
Đáp án: A
Phương pháp giải:
Đổi số mol: nKOH = V KOH . CM KOH = ? mol
PTHH: KOH + HCl→ KCl+ H2O
1 1
?mol 0,1 mol
Từ phương trình ta có nKOH = nHCl = ? mol
=> m chất tan HCl = n HCl . MHCl = ?
=> a = (mHCl/ mdd HCl).100% = ?
Lời giải chi tiết:
nKOH = V KOH . CM KOH = 0,2 . 0,5 =0,1 mol
m chất tan HCl = mdd HCl . C%= 200 . a% g
PTHH: KOH + HCl→ KCl+ H2O
1 1
?mol 0,1 mol
Từ phương trình ta có nKOH = nHCl = 0,1 mol
=> m chất tan HCl = n HCl . MHCl = 0,1 . (35,5 + 1) = 3,65g = 200 . a% g
=> a = 1,825%
Đáp án A
Câu hỏi 10 :
Trộn 200ml dung dịch NaOH 1M với 300ml dung dịch NaOH 0,5M thì thu được dung dịch mới có nồng độ mol là?
- A 0,5M
- B 1,5M
- C 1M
- D 0,7M
Đáp án: D
Phương pháp giải:
Công thức nồng độ mol: CM NaOH = nNaOH : VNaOH
Lời giải chi tiết:
Tống số mol NaOH có trong cả 2 dung dịch là
nNaOH = 0,2.1+ 0,3.0,5= 0,35 mol
Nồng độ mol của dung dịch thu được là
\({C_M}NaOH = \frac{{0,35}}{{0,5}} = 0,7\,(M)\)
Đáp án D
Câu hỏi 11 :
Cho 200ml dung dịch NaOH 3M tác dụng với 100ml dung dịch FeCl3 1M thu được a gam kết tủa. Giá trị của a là :
- A 5,35g
- B 9,0g
- C 10,7g
- D 21,4g
Đáp án: C
Phương pháp giải:
Đổi số mol NaOH; FeCl3
Viết PTHH xảy ra: 3NaOH + FeCl3 → 3NaCl + Fe(OH)3
Dựa vào PTHH so sánh NaOH và FeCl3 chất nào phản ứng hết, chất nào dư. Mọi tính toán theo số mol của chất phản ứng hết.
Lời giải chi tiết:
Số mol của NaOH là 0,2.3=0,6 mol
số mol của FeCl3 là 0,1.1=0,1mol
Ta có PTHH : 3NaOH + FeCl3 → 3NaCl + Fe(OH)3
Trước PƯ 0,6 mol 0,1 mol
PƯ 0,3 mol 0,1 mol
Sau PƯ 0,3 mol 0 0,1 mol
Kết tủa là 0,1 mol Fe(OH)3 => a= 0,1.107=10,7(g)
Đáp án C
Câu hỏi 12 :
Dẫn 3,36 lít khí CO2(đktc) vào 40g dung dịch NaOH 20%. Sản phẩm thu được sau khi cô cạn dung dịch và khối lượng tương ứng là:
- A 12,6 gam NaHCO3; 2,0 gam NaOH
- B 5,3 gam Na2CO3; 8,4 gam NaHCO3
- C 10,6 gam Na2CO3; 4,2 gam NaHCO3
- D 10,6 gam Na2CO3; 2,0 gam NaOH
Đáp án: B
Phương pháp giải:
Lập tỉ lệ: \(k = \frac{{{n_{NaOH}}}}{{{n_{C{O_2}}}}}\)
CO2 + NaOH → NaHCO3 (1)
CO2 + 2NaOH → Na2CO3 + H2O (2)
Nếu k ≤ 1 thì xảy ra phương trình (1)
Nếu 1 < k < 2 thì xảy ra cả phương trình (1) và (2)
Nếu k ≥ 2 chỉ xảy ra phản ứng (2)
Lời giải chi tiết:
nCO2= vCO2: 22,4= 3,36:22,4=0,15 mol
m NaOH= m dd. C% = 40.20%= 8 gam
nNaOH= 8:40=0,2 mol
Ta có: \(1 < {{nNaOH} \over {nCO2}} = {{0,2} \over {0,15}} < 2\)
=> Tạo 2 muối Na2CO3 và NaHCO3
NaOH + CO2→ NaHCO3
x x ← x(mol)
2NaOH + CO2→Na2CO3+ H2O
2y y ← y(mol)
Có: \(\left\{ \begin{array}{l}\sum {{n_{NaOH}} = x + 2y = 0,2} \\\sum {{n_{C{O_2}}} = x + y = 0,15} \end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,1 = {n_{NaHC{O_3}}}\\y = 0,05 = {n_{N{a_2}C{O_3}}}\end{array} \right.\)
\(\begin{array}{l}\left\{ \begin{array}{l}\sum {{n_{NaOH}} = x + 2y = 0,2} \\\sum {{n_{C{O_2}}} = x + y = 0,15} \end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,1 = {n_{NaHC{O_3}}}\\y = 0,05 = {n_{N{a_2}C{O_3}}}\end{array} \right.\\ \Rightarrow \left\{ \begin{array}{l}{m_{NaHC{O_3}}} = {n_{NaHC{O_3}}}.{M_{NaHC{O_3}}} = 0,1.84 = 8,4\,(g)\\{m_{N{a_2}C{O_3}}} = {n_{N{a_2}C{O_3}}}.{M_{N{a_2}C{O_3}}} = 0,05.106 = 5,3\,(g)\end{array} \right.\end{array}\)
Đáp án B
Câu hỏi 13 :
Cho 23,5 gam K2O tác dụng với nước thu được 0,5 lít dung dịch bazo.
a/ Viết PTHH và tính nồng độ mol của thu bazơ được.
b/ Tính thể tích dung dịch HCl 2M, cần dùng để trung hòa hết bazơ nói trên.
Phương pháp giải:
a.
Viết PTHH xảy ra, sau đó tính số mol của KOH theo K2O
Ghi nhớ công thức tính nồng độ mol: \({C_M} = \frac{{{n_{KOH}}}}{V}\)
b. PTHH: KOH + HCl → KCl + H2O
Tính toán mol KCl theo số mol KOH
Lời giải chi tiết:
a. K2O + H2O → 2KOH
\({n_{{K_2}O}} = {{23,5} \over {94}} = 0,25mol\) , n KOH = 2 n K2O = 0,5 mol
\({C_M} = \frac{{{n_{KOH}}}}{{V(l)}} = \frac{{0,5}}{{0,5}} = 1M\)
b. KOH + HCl → KCl + H2O
nHCl= nKOH= 0,5mol
\( = > {V_{HCl}} = {{{n_{HCl}}} \over {{C_M}}} = {{0.5} \over 2} = 0,25(l)\)
Câu hỏi 14 :
Dẫn từ từ 3,136 lít khí CO2 (đktc) vào một dung dịch có hòa tan 12,8 gam NaOH sản phẩm thu được là muối Na2CO3. Khối lượng muối Na2CO3 thu được là:
- A 14,84 gam
- B 18, 96 gam
- C 16,96 gam
- D 16,44 gam
Đáp án: A
Phương pháp giải:
Phương pháp :
Ban đầu xảy ra phản ứng CO2 + 2NaOH → Na2CO3+ H2O
Nếu CO2 dư thì CO2 + Na2CO3 +H2O → 2NaHCO3
Lời giải chi tiết:
Hướng dẫn giải :
nCO2 =0,14 mol
nNaOH =0,32 mol
→ pư (1) có dư NaOH → nNa2CO3 = nCO2 =0,14 mol
→mNa2CO3 = 14,84 g
Đáp án A
Câu hỏi 15 :
Cho 200 ml dung dịch CuCl2 0,15M với dung dịch NaOH vừa đủ, sau phản ứng lọc kết tủa, nung đến khối lượng không đổi thu được m gam chất rắn. Giá trị của m là:
- A 1,2 gam
- B 2,4 gam
- C 4 gam
- D 8 gam
Đáp án: B
Phương pháp giải:
Phương pháp :
PTHH : CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Cu(OH)2 → CuO + H2O
Lời giải chi tiết:
Hướng dẫn giải :
nCuCl2 =0,2.0,15 =0,03 mol → nCu(OH)2 = 0,03 mol
→ nCuO =0,03 mol→ m=2,4 g
Đáp án B
Câu hỏi 16 :
Biết 2,24 lít khí Cacbonic (đktc) tác dụng hết với 200 ml dung dịch Ba(OH)2, sản phẩm thu được là muối trung hòa và nước.
a. Viết phương trình xảy ra.
b. Tính nồng độ mol của dung dịch Ba(OH)2 cần dùng.
c. Tính khối lượng kết tủa thu được.
Phương pháp giải:
\({n_{C{O_2}}} = \frac{{2,24}}{{22,4}} = 0,1\,(mol);\)
a. PTHH:
CO2 + Ba(OH)2 → BaCO3↓ + H2O
b. Theo PTHH: nBaCO3 = nCO2 = ?
Nồng độ mol của dung dịch Ba(OH)2 là: CM Ba(OH)2 = nBa(OH)2 : VBa(OH)2 = ? (M)
c. Theo PTHH: nBaCO3 = nCO2 = ? (mol)
=> Khối lượng kết tủa BaCO3 thu được là: mBaCO3 = nBaCO3.197 = ? (g)
Lời giải chi tiết:
\({n_{C{O_2}}} = \frac{{2,24}}{{22,4}} = 0,1\,(mol);\)
a. PTHH:
CO2 + Ba(OH)2 → BaCO3↓ + H2O (0,5 điểm)
b. Theo PTHH: nBaCO3 = nCO2 = 0,1 (mol) (0,5 điểm)
Nồng độ mol của dung dịch Ba(OH)2 là: CM Ba(OH)2 = nBa(OH)2 : VBa(OH)2 = 0,1 : 0,2 = 0,5 (M) (0,5 điểm)
c. Theo PTHH: nBaCO3 = nCO2 = 0,1 (mol) (0,5 điểm)
Khối lượng kết tủa BaCO3 thu được là: 0,1. 197 = 19,7 (g) (0,5 điểm)
Câu hỏi 17 :
Để trung hòa hoàn toàn 100ml dung dịch NaOH 1M cần vừa đủ V ml dung dịch H2SO4 2M. Giá trị của V là:
- A 25ml.
- B 50ml.
- C 100ml.
- D 200ml.
Đáp án: A
Phương pháp giải:
Sử dụng phương pháp tăng giảm khối lượng
Gọi số mol của CuSO4 phản ứng là x (mol)
PTPƯ: Fe + CuSO4 → FeSO4 + Cu↓
x ← x → x (mol)
Khối lượng tăng: mtăng = mCu - mFe => 1,6 = 64x – 56x => x = ?=l (mol)
Lời giải chi tiết:
nNaOH = 0,1.1 = 0,1 (mol)
PTPƯ: 2NaOH + H2SO4 → Na2SO4 + H2O
0,1 → 0,05 (mol)
=> VH2SO4 = nH2SO4 : CM = 0,05 : 2 = 0,025 (lít) = 25 (ml)
Đáp án A
Câu hỏi 18 :
Dẫn từ từ 4,48 lít khí CO2 (đktc) tác dụng vào một dung dịch có hòa tan 28 g KOH, sản phẩm là muối K2CO3.
a/ Chất nào là dư và dư bao nhiêu (lít hoặc gam)?
b/ Hãy xác định khối lượng muối thu được sau phản ứng.
Phương pháp giải:
a. PTHH xảy ra: CO2 + 2KOH → K2CO3 + H2O
Đặt số mol CO2, KOH vào phương trình trên => xác định được chất phản ứng hết, chất dư. Mọi tính toán theo chất phản ứng hết.
b. Dựa vào phương trình hóa học. Tính số mol K2CO3 theo số mol chất phản ứng hết.
Lời giải chi tiết:
a/
\({n_{CO2}} = {{4,48} \over {22,4}} = 0,2mol\)
\({n_{KOH}} = {{28} \over {56}} = 0,5mol \Rightarrow {n_{KOH}} > 2{n_{CO2}}\)
=> CO2 phản ứng hết. KOH dư. Mọi tính toán theo CO2
CO2 + 2KOH → K2CO3 + H2O
Bđ 0,2 0,5 (mol)
Pư 0,2 0,4 0,2 (mol)
Sau - 0,1 0,2 (mol)
a/ mKOHdư = 0,1 . 56 = 5,6(gam)
b/ mK2CO3 =0,2 . 138 = 27,6(gam)
Câu hỏi 19 :
Cho từ từ đến hết 3,36 lít khí CO2(đktc) vào 200ml dung dịch Ca(OH)2 C(M). Sau phản ứng thu được 10gam kết tủa.
a/ Viết PTPHH có thể xảy ra.
b/ Tính nồng độ mol của Ca(OH)2 đã dung.
Phương pháp giải:
PTHH có thể xảy ra:
CO2 + Ca(OH)2 → CaCO3↓ + H2O (1)
2CO2 + Ca(OH)2 → Ca(HCO3)2 (2)
Chia 2 trường hợp để giải:
TH1 : Chỉ xảy ra phản ứng (1); CO2 hết, mọi tính toán theo CO2 và CaCO3
TH2: xảy ra cả (1) và (2) cả CO2 và Ca(OH)2 đều hết.
Lời giải chi tiết:
nCO2 = 3,36 : 22,4 = 0,15(mol)
nCaCO3↓= 10 : 100 = 0,1(mol)
a/ Có thể xảy ra các pư sau:
CO2 + Ca(OH)2→ CaCO3↓( trắng) + H2O (1)
2CO2 + Ca(OH)2→ Ca(HCO3)2 (2)
b/ TH1: chỉ xảy ra pư (1). CO2 hết, mọi tính toán theo CO2 và CaCO3
Theo PTHH (1): nCaCO3 = nCO2 = 0,15 (mol) → mCaCO3 = nCaCO3. MCaCO3 = 0,15.100 = 15 (g) khác với đề cho thu được 10 gam kết tủa
→ TH này loại
TH2: xảy ra cả pư (1) và (2). CO2 và Ca(OH)2 đều hết
Theo pư(1) : nCO2 = nCa(OH)2 = nCaCO3 = 0,1(mol)
Theo pư (2): nCO2(2) = 0,15- nCO2(1)= 0,15-0,1 = 0,05(mol)
nCa(OH)2= nCO2(2)=.0,05=0,025(mol)
\( \Rightarrow \sum {{n_{Ca{{(OH)}_2}}}} = 0,1 + 0,025 = 0,125(mol)\)
\( \Rightarrow {C_M}Ca{(OH)_2} = \frac{{{n_{Ca{{(OH)}_2}}}}}{{V(l)}} = \frac{{0,125}}{{0,2}} = 0,625(M)\)
Câu hỏi 20 :
Cho 23,5 gam K2O tác dụng với nước thu được 0,5 lít dung dịch bazo.
a/ Viết PTHH và tính nồng độ mol của thu bazơ được.
b/ Tính thể tích dung dịch HCl 2M, cần dùng để trung hòa hết bazơ nói trên.
Phương pháp giải:
a.
Viết PTHH xảy ra, sau đó tính số mol của KOH theo K2O
Ghi nhớ công thức tính nồng độ mol: \({C_M} = \frac{{{n_{KOH}}}}{V}\)
b. PTHH: KOH + HCl → KCl + H2O
Tính toán mol KCl theo số mol KOH
Lời giải chi tiết:
a. K2O + H2O → 2KOH
\({n_{{K_2}O}} = {{23,5} \over {94}} = 0,25mol\) , n KOH = 2 n K2O = 0,5 mol
\({C_M} = \frac{{{n_{KOH}}}}{{V(l)}} = \frac{{0,5}}{{0,5}} = 1M\)
b. KOH + HCl → KCl + H2O
nHCl= nKOH= 0,5mol
\( = > {V_{HCl}} = {{{n_{HCl}}} \over {{C_M}}} = {{0.5} \over 2} = 0,25(l)\)
>> Học trực tuyến lớp 9 và Lộ trình UP10 trên Tuyensinh247.com Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Lộ trình học tập 3 giai đoạn: Học nền tảng lớp 9, Ôn thi vào lớp 10, Luyện Đề. Bứt phá điểm lớp 9, thi vào lớp 10 kết quả cao. Hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 20 bài tập vận dụng áp dụng định luật bảo toàn khối lượng có lời giải
- 15 bài tập áp dụng định luật tăng giảm khối lượng có lời giải
- 10 bài tập vận dụng áp dụng phương pháp tương đương (công thức trung bình) có lời giải
- 10 câu hỏi vận dụng áp dụng phương pháp biện luận có lời giải
- 10 bài tập vận dụng áp dụng phương pháp bảo toàn nguyên tố có lời giải
- 10 bài tập vận dụng về phương pháp qui đổi có lời giải
- 10 bài tập vận dụng áp dụng phương pháp bảo toàn nguyên tố có lời giải
- 10 câu hỏi vận dụng áp dụng phương pháp biện luận có lời giải
- 10 bài tập vận dụng áp dụng phương pháp tương đương (công thức trung bình) có lời giải
- 15 bài tập áp dụng định luật tăng giảm khối lượng có lời giải