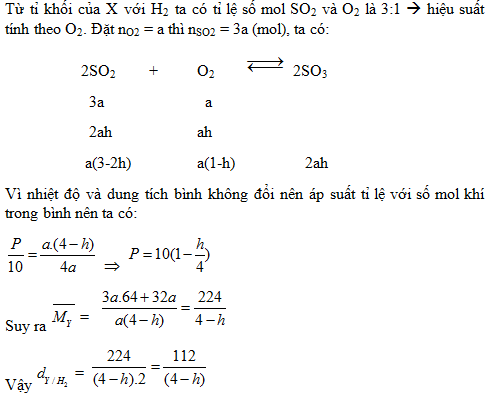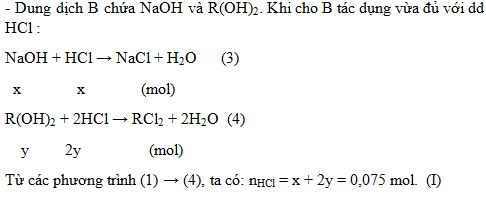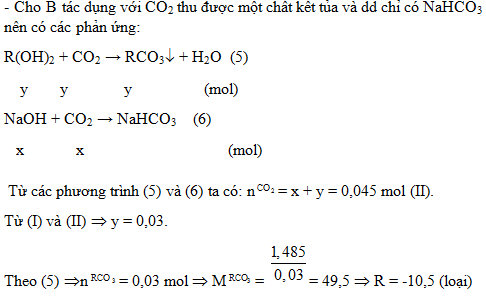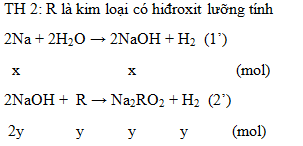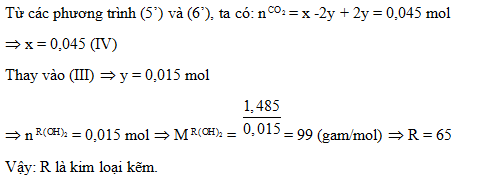15 bài tập vận dụng, vận dụng cao xác định kim loại có lời giải
Làm đề thiCâu hỏi 1 :
(1 điểm)
Cho m gam hỗn hợp A gồm kim loại kiềm X và kim loại Y thuộc nhóm IIA (X và Y thuộc cùng một chu kỳ) vào nước dư, sau phản ứng hoàn toàn thu được V lit khí H2(dktc). Mặt khác, cho m gam hỗn hợp A tan hoàn toàn trong 300 ml dung dịch H2SO4 1M dư, thu được 2V lit H2(dktc) và dung dịch F chứa 3 chất tan có số mol bằng nhau. Xác định X, Y và m.
Lời giải chi tiết:
Giả sử có các phản ứng :
X + H2O -> XOH + ½ H2
Y + 2H2O -> Y(OH)2 + H2(*)
2X + H2SO4 -> X2SO4 + H2
Y + H2SO4 -> YSO4 + H2
Vì khí H2 từ phản ứng với nước < lượng khí H2 từ phản ứng với axit
=> Y không phản ứng với nước. Không có phản ứng (*)
Dung dịch F chứa 3 chất tan có cùng số mol là X2SO4 ; YSO4 ; H2SO4
=> Y không thể là Ba.
=> Y là Mg => X là Na
=> số mol = 0,1 mol = 1/3 nH2SO4 bđ (bảo toàn SO4)
=> nH2(axit) = nY + ½ nX = 0,15 mol => 2V = 3,36 lit => V = 1,68 lit
Câu hỏi 2 :
(2,0 điểm)
4.1. Criolit được điều chế theo phản ứng sau: Al2O3(rắn) + HF(dd) + NaOH(dd) -> Na3AlF6(rắn) + H2O.
Tính khối lượng quặng có chứa 80% Al2O3 (còn lại là tạp chất trơ) cần dùng để sản xuất 1 tấn criolit, biết hiệu suất phản ứng là 75%.
4.2. A là hỗn hợp gồm M2CO3, MHCO3, MCl (M là kim loại kiềm). Cho 43,71g hỗn hợp A tác dụng hết với dung dịch HCl dư thu được dung dịch B và 17,6g khí C. Chia dung dịch B thành 2 phần không bằng nhau với tỉ lệ phần 1 : phần 2 = 2 : 3.
Phần 1: Phản ứng vừa đủ với 100 ml dung dịch KOH 0,8M.
Phần 2: Tác dụng hoàn toàn với dung dịch AgNO3 dư thu được 82,656g kết tủa trắng.
Xác định tên kim loại M.
Lời giải chi tiết:
4.1.
Al2O3(rắn) + 12HF(dd) + 6NaOH(dd) -> 2Na3AlF6(rắn) + 9H2O.
(g) 102 2.210
(tấn) x 1
=> x = 0,243 tấn
Có : x = mAl2O3 bđ. H% => mAl2O3 bđ = 0,324 tấn
=> mquặng = 0,405 tấn
4.2.
M2CO3 + 2HCl -> 2MCl + CO2 + H2O
Mol a ------> 2a ---> 2a ---> a
MHCO3 + HCl -> MCl + CO2 + H2O
Mol b -------> b ---> b ----> b
=> nkhí = nCO2 = 0,4 mol = nC
Do HCl dư nên B gồm MCl và HCl
Xét P1 : HCl + KOH -> KCl + H2O
=> nHCl(1) = 0,08 mol
=> nHCl = 0,2 mol
Xét P2 : nHCl = 0,12 mol
MCl + AgNO3 -> MNO3 + AgCl
HCl + AgNO3 -> HNO3 + AgCl
=> nAgCl(do MCl)(2) = 0,456 mol = nMCl(2)
=> nMCl(B) = 0,76 mol
Bảo toàn Clo : nMCl(A) = nMCl(B) – nHCl dư – nHCl pứ A = 0,56 – (2a + b)
Có nCO2 = a + b = 0,4 mol
Và : mA = a.(2M + 60) + b.(M + 61) + (0,56 – 2a – b).(M + 35,5) = 43,71g
=> 0,56.M – 11a + 25,5b = 23,83g
=> 0,56M + 36,5b = 23,83 + 11(a + b) = 28,23g
=> 0,56M = 28,23 – 36,5b(*) => M < 50,4
Lại có b = 0,4 – a => b < 0,4 => Thay vào (*) => M > 24,3
=> M = 39 thỏa mãn => M là Kali
Câu hỏi 3 :
( 1,0 đ):
Hòa tan hoàn toàn a gam kim loại M có hóa trị không đổi vào b gam dung dịch HCl được dung dịch D. Thêm 240 gam dung dịch NaHCO3 7% vào D thì vừa đủ tác dụng hết với lượng HCl còn dư, thu được dung dịch E trong đó nồng độ phần trăm của NaCl và muối clorua của kim loại M tương ứng là 2,5% và 8,12%. Thêm tiếp lượng dư dung dịch NaOH vào E, sau đó lọc lấy kết tủa, rồi nung đến khối lượng không đổi thì thu được 16 gam chất rắn. Viết các phương trình phản ứng. Xác định kim loại và nồng độ phần trăm của dung dịch axit HCl đã dùng.
Lời giải chi tiết:
Gọi n là hóa trị của M (n nguyên dương) Các phương trình pứ xảy ra: (1) M + n HCl → MCln + H2↑
(2) HCl dư + NaHCO3 → NaCl + CO2↑ + H2O
(3) MCln + n NaOH → M(OH)n ↓ + n NaCl
(4) 2M(OH)n → M2On + n H2O
Theo (2) ta có:
n NaHCO3 = n NaCl = (240.7) / (100.84) = 0,2 mol = n HCl dư
m dd E = 0,2. 58,5.100 / 2,5 = 468 g
m MCln = 468. 8,12 / 100 = 38 g
Từ (3) và (4) ta có:
½. n MCln = n M2On 38 / [2. (M + 35,5n)] = 16 / (2M + 16n)
⇒ M = 12n ⇒ Chỉ có n = 2 và M = 24 (Mg) thỏa mãn.
Vậy kim loại là Magiê.
Từ (1) (2) và (4) cho ta: n Mg = n MgO = 16 / 40 = 0,4 mol = n H2
Do đó a = 0,4. 24 = 9,6 g và m H2↑ = 0,4. 2 = 0,8g
n CO2 = n NaCl = 0,2 mol
⇒ m CO2 = 0,2. 44 = 8,8 g
Mặt khác: m dd E = a + b - 0,8 + 240 - 8,8 = 468 g
⇒ b = 228 g
Từ (1) ⇒ n HCl pứ = 2. n Mg = 2. 0,4 = 0,8 mol
n HCl ban đầu = n HCl pứ + n HCl dư = 0,8 + 0,2 = 1 mol
⇒ m HCl = 36,5 g
⇒ C% HCl = (36,5 / 228) . 100 = 16%
Câu hỏi 4 :
(1,5 điểm)
Hỗn hợp rắn X gồm nhôm và kim loại kiềm M. Hòa tan hoàn toan 6,36 gam X trong lượng vừa đủ dung dịch axit H2SO4 loãng thu được 4,928 lít H2 ở đktc và dung dịch Y (chỉ gồm muối sunfat trung hòa). Cho Y tác dụng với vừa đủ dung dịch Ba(ÔH)2 cho tới khi gốc sunfat chuyển hết thành kết tủa thì thu được 54,38 gam kết tủa.
a. Xác định kim loại M
b. Cho thêm 3,48 gam muối M2SO4 vào dung dịch Y thu được dung dịch Z. Tiến hành kết tinh cẩn thận dung dịch Z thu được 56,88 gam tinh thể muối kép có công thức dạng aM2SO4. bAl2(SO4)3. cH2O. Xác định công thức của tinh thể muối kép.
Lời giải chi tiết:
Câu hỏi 5 :
Chia một lượng kim loại Y thành 2 phần bằng nhau. Cho phần thứ nhất phản ứng hết với lượng dư khí clo, thu được 48,75g chất rắn Z. Hòa tan hết chất rắn này vào nước rồi cho tác dụng với dung dịch NaOH dư, tạo ra 32,1g kết tủa là hidroxit của kim loại Y. Đun nóng phần thứ 2 ngoài không khí tới khi kim loại phản ứng hết, thấy khối lượng chất rắn tăng 6,4g và tạo ra 1 oxit duy nhất L.
(a) Xác định công thức các chất Y, Z, L.
(b) Trộn toàn bộ lượng Z và L ở trên với nhau, rồi đun nóng hỗn hợp với lượng dư dung dịch H2SO4 đặc , dẫn khí tạo ra đi qua bình đựng dung dịch KMnO4 0,2M. Tính thể tích dung dịch KMnO4 tối đa có thể bị mất màu.
Lời giải chi tiết:
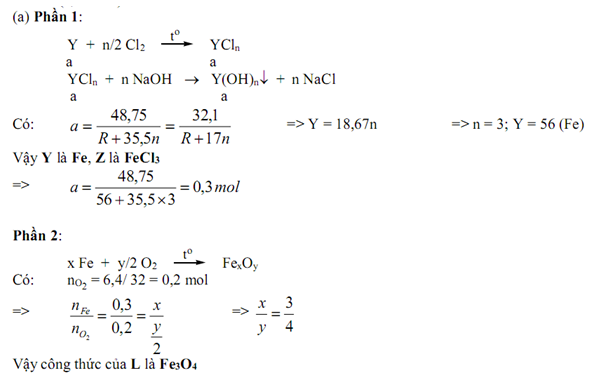
(b)
Trộn Z và L thu được hỗn hợp : 0,3 mol FeCl3 ; 0,1 mol Fe3O4.
Cho phản ứng với dung dịch H2SO4 đặc :
2FeCl3 + 3H2SO4 -> Fe2(SO4)3 + 6HCl
0,3 mol -> 0,9 mol
2Fe3O4 + 10H2SO4 -> 3Fe2(SO4)3 + SO2 + 10H2O
0,1 mol -> 0,05
5SO2 + 2KMnO4 + 2H2O -> K2SO4 + 2MnSO4 + 2H2SO4
0,05 -> 0,02 mol -> 0,02
16HCl + 2KMnO4 -> 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,9 mol -> 0,1125 mol
2KCl + H2SO4 -> 2HCl + K2SO4
0,04 0,04 mol
16HCl + 2KMnO4 -> 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,04 -> 0,005 mol
=> nSO2 = ½ nFe3O4 = 0,05 mol
=> nKMnO4 = 0,02 + 0,1125 + 0,005 = 0,1375 mol
=> V(KMnO4) = 0,6875 lit
Câu hỏi 6 :
(2,0 điểm)
1. Trong một bình kín dung dịch không đổi chứa hỗn hợp X gồm SO2 và O2 ở 1500C, 10 atm (có mặt V2O5), tỉ khối X so với H2 là 28. Nung bình ở nhiệt độ 4000C trong một thời gian, sau đó đưa về nhiệt độ ban đầu thì thu được hỗn hợp Y, áp suất trong bình là P (atm). Tính P và tỉ khối của Y so với H2, biết hiệu suất của phản ứng là h.
2. Hòa tan hết a gam hỗn hợp A gồm Na và một kim loại R có hóa trị II vào nước, phản ứng xong thu được dung dịch B và V lít khí H2. Nếu cho dung dịch B tác dụng vừa đủ với 300 ml dung dịch HCl 0,25M tạo thành một dung dịch chỉ chứa hai chất tan. Mặt khác, khi hấp thụ hết 1,008 lít khí CO2 vào dung dịch B thu được 1,485 gam một chất kết tủa và dung dịch nước lọc chỉ chứa chất tan NaHCO3. Biết các phản ứng xảy ra hoàn toàn và thể tích các khí đo ở điều kiện tiêu chuẩn. Hãy xác định tên kim loại R.
Lời giải chi tiết:
1.
2.
Câu hỏi 7 :
(2,0 điểm)
1. Hòa tan kim loại R trong dung dịch H2SO4 10%, sau khi phản ứng xảy ra hoàn toàn thu được 0,56 lít khí H2 (đo ở đktc) và dung dịch chỉ chứa một chất tan duy nhất có nồng độ 14,7%. Xác định kim loại R.
2. Đốt nóng hỗn hợp gồm Al và 3,48 gam Fe3O4 trong điều kiện không có oxi đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp chất rắn F có khối lượng 4,83 gam. Cho toàn bộ hỗn hợp F vào 50ml dung dịch CuSO4 1M. Sau khi phản ứng xảy ra hoàn toàn, lọc được m gam hỗn hợp chất rắn Z. Tính m.
Lời giải chi tiết:
1.
2.
Câu hỏi 8 :
1. Hỗn hợp A gồm Al và kim loại kiềm M. Hoà tan 2,54 gam A trong lượng vừa đủ dung dịch H2SO4 loãng thu được 2,464 lít H2 (đktc) và dung dịch B chỉ gồm muối sunfat trung hoà. Cho B tác dụng với dung dịch Ba(OH)2 cho tới khi gốc sunfat chuyển hết vào kết tủa thì thu được 27,19 gam gam kết tủa.
Xác định kim loại M và tính thành phần % theo khối lượng mỗi chất trong A.
2. Đốt cháy hoàn toàn 12 gam muối sunfua của kim loại R (R có hoá trị II, không đổi sau các phản ứng) thu được chất rắn A và khí B. Hoà tan hết A bằng một lượng vừa đủ dung dịch H2SO4 24,5% thu được dung dịch muối có nồng độ là 33,33%. Khi làm lạnh dung dịch muối xuống nhiệt độ thấp hơn thì có một lượng tinh thể muối ngậm nước tách ra, có khối lượng là 15,625 gam. Phần dung dịch bão hoà còn lại có nồng độ là 22,54%.
Xác định R và công thức hoá học của muối ngậm nước nói trên.
Lời giải chi tiết:


Câu hỏi 9 :
(1,5 điểm).
Hòa tan hoàn toàn 6 gam kim loại M bằng dung dịch HCl 7,3% (vừa đủ) thu
được dung dịch muối 9,295%. Khi làm lạnh dung dịch này thấy tách ra 20,3 gam
muối A và nồng độ phần trăm của muối trong dung dịch còn lại là 6,06%. Xác định
công thức của kim loại M và muối A.
Lời giải chi tiết:
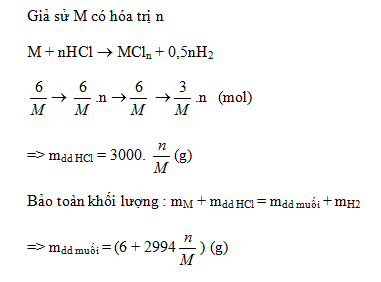

Câu hỏi 10 :
Hỗn hợp rắn X gồm M, MO và MCl2 (M là kim loại có hóa trị II không đổi). Cho 18,7 gam X tác dụng với dung dịch HCl (vừa đủ), thu được dung dịch A và 6,72 lít khí (đktc). Cho dung dịch NaOH dư vào dung dịch A, sau phản ứng thu được kết tủa B. Nung B ở nhiệt độ cao đến khối lượng không đổi thu được 18,0 gam chất rắn. Mặt khác, khi cho 18,7 gam hỗn hợp X vào 500 ml dung dịch CuCl2 1,0M, sau phản ứng, tách bỏ chất rắn rồi cô cạn dung dịch, thu được 65,0 gam muối khan. Biết các phản ứng hóa học xảy ra hoàn toàn.
1. Hãy viết các phương trình phản ứng xảy ra.
2. Xác định kim loại M và tính thành phần phần trăm theo khối lượng của các chất có trong hỗn hợp X.
Lời giải chi tiết:
\(X\left\{ \matrix{
M \hfill \cr
MO \hfill \cr
MC{l_2} \hfill \cr} \right. \to \left[ \matrix{
\buildrel {HCl\,vua\,du} \over
\longrightarrow \left\{ \matrix{
\uparrow {H_2}:0,3 \hfill \cr
{\rm{dd}}\,A\buildrel { + NaOH\,du} \over
\longrightarrow \downarrow B\buildrel {to} \over
\longrightarrow ran:18g \hfill \cr} \right. \hfill \cr
\buildrel {CuC{l_2}:0,5} \over
\longrightarrow \left\{ \matrix{
ran \hfill \cr
{\rm{dd}}\,D\buildrel {{t_o}} \over
\longrightarrow muoi:65g \hfill \cr} \right. \hfill \cr} \right.\)
a.
M + 2HCl → MCl2 + H2↑
MO + 2HCl → MCl2 + H2O
MCl2 + 2NaOH → M(OH)2↓ + 2NaCl
M(OH)2 → MO + H2O
M + CuCl2 → MCl2 + Cu↓
b.
nH2 = 0,3 → nM = 0,3
\(\eqalign{
& \left\{ \matrix{
M:0,3 \hfill \cr
MO:x \hfill \cr
MC{l_2}:y \hfill \cr} \right.\buildrel {TGKL} \over
\longrightarrow \left\{ \matrix{
\underbrace {M \to MO}_{ \uparrow 16} \hfill \cr
\underbrace {MC{l_2} \to MO}_{ \uparrow 55} \hfill \cr} \right. \to - 16.0,3 + 55y = 18,7 - 18 = > y = 0,1 \cr
& {\rm{dd}}\,{\rm{D}}\underbrace {\left\{ \matrix{
CuC{l_2}\,du:0,2 \hfill \cr
MC{l_2}:0,4 \hfill \cr} \right.}_{65g} \to M = 24g \to \left\{ \matrix{
\% Mg = 38,5\% \hfill \cr
\% MgO = 10,07\% \hfill \cr
\% MgC{l_2} = 50,80\% \hfill \cr} \right. \cr} \)
Câu hỏi 11 :
Hòa tan hòa toàn a gam kim loại M (có hóa trị không đổi) vào b gam dung dịch HCl thu được dung dịch D. Thêm 179,88 gam dung dịch NaHCO3 9,34% vào dung dịch D thì vừa đủ tác dụng hết với lượng HCl dư, thu được dung dịch E. Trong dung dịch E nồng độ phần trăm của NaCl và muối clorua của kim loại M tương ứng là 2,378% và 7,724%. Thêm tiếp một lượng dư dung dịch NaOH vào E, sau đố lọc kết tủa rồi nung đến khối lượng không đổi thì thu được 16,0 gam chất rắn. Xác định kim loại M và nồng độ phần trăm của dung dịch axit clohiđric đã dùng?
Phương pháp giải:
bảo toàn khối lượng, bảo toàn nguyên tố.
Lời giải chi tiết:
\(\eqalign{
& M + HCl \to \left\{ \matrix{
\uparrow {H_2} \hfill \cr
{\rm{dd}}\,{\rm{D}}\left\{ \matrix{
MC{{\mathop{\rm l}\nolimits} _n}\buildrel { + NaHC{O_3}:0,2mol} \over
\longrightarrow \hfill \cr
HCl\,du \hfill \cr} \right. \hfill \cr} \right.\left\{ \matrix{
\uparrow C{O_2}:0,2 \hfill \cr
{\rm{dd}}\,E\left\{ \matrix{
NaCl:2,378\% \hfill \cr
MC{{\mathop{\rm l}\nolimits} _n}:7,724\% \hfill \cr} \right.\buildrel { + NaOH\,du} \over
\longrightarrow \downarrow \buildrel {to} \over
\longrightarrow {M_2}{O_n}:16g \hfill \cr} \right. \cr
& \buildrel {BT\,Na} \over
\longrightarrow \left\{ \matrix{
{n_{NaCl}} = {n_{NaHC{O_3}}} \hfill \cr
= > {n_{NaCl}} = 0,2 \hfill \cr} \right.\buildrel {\% NaCl:2,378\% } \over
\longrightarrow {\rm{dd}}\,E\buildrel {\% MC{l_n}:7,724\% } \over
\longrightarrow MC{{\mathop{\rm l}\nolimits} _n}:38g \cr
& \buildrel {BT\,M} \over
\longrightarrow \left\{ \matrix{
MC{{\mathop{\rm l}\nolimits} _n}:x \hfill \cr
{M_2}{O_n}:0,5x \hfill \cr} \right. \to \left\{ \matrix{
(M + 35,5n)x = 38 \hfill \cr
(2M + 16n).0,5x = 16 \hfill \cr} \right. \to \left\{ \matrix{
M.x = 9,6 \hfill \cr
n.x = 0,8 \hfill \cr} \right. = > M = 12n = > \left\{ \matrix{
n = 2 \hfill \cr
M = 24 \hfill \cr} \right. \cr
& \mathop {Mg}\limits_{0,4} {\rm{ }} + {\rm{ }}\mathop {2HCl}\limits_{0,8} {\rm{ }} \to {\rm{ }}MgC{l_2} + {\rm{ }}{H_2} \cr
& = > \,{n_{HCl\,bd}} = 1mol \cr} \)
BTKL: mD + mNaHCO3 = mCO2 + mE
mD + 179,88 = 44.0,2 + 492 => mD = 320,92
BTKL: mMg + mddHCl = mH2 + mD
=> 24 . 0,4 + mddHCl = 2 . 0,4 + 320,92 => mddHCl = 312,12
=> C%HCl = 11,69%
Câu hỏi 12 :
1. Hỗn hợp A gồm CaCO3, Cu, FeO và Al. Nung nóng A (trong điều kiện không có không khí) một thời gian thu được chất rắn B. Cho B vào nước dư, thu được dung dịch C và chất rắn D (không thay đổi khối lượng khi cho vào dung dịch NaOH). Cho D tác dụng với dung dịch H2SO4 đặc nóng, dư. Xác định thành phần của B, C, D và viết các phương trình phản ứng xảy ra.
2. Cho 3,64 gam hỗn hợp E gồm một oxit, một hiđroxit và một muối cacbonat trung hòa của một kim loại M có hóa trị II tác dụng vừa đủ với 117,6 gam dung dịch H2SO4 10%. Sau phản ứng, thu được 0,448 lít khí (đktc) và dung dịch muối duy nhất có nồng độ 10,867% (khối lượng riêng là 1,093 gam/ml); nồng độ mol là 0,545M.
a) Viết các phương trình phản ứng xảy ra và xác định kim loại M.
b) Tính % khối lượng của các chất có trong hỗn hợp E.
Lời giải chi tiết:
1.
Phản ứng: CaCO3 → CaO + CO2
2Al + 3FeO →Al2O3 + 3Fe
(B gồm CaO, Cu, FeO, CaCO3 dư, Fe, Al)
CaO + H2O → Ca(OH)2
2Al + Ca(OH)2 + 2H2O →Ca(AlO2)2 + 3H2
Al2O3 + Ca(OH)2 →Ca(AlO2)2 + H2O
Do D không thay đổi khối lượng khi cho vào dung dịch NaOH, nên D không còn Al và Al2O3. Suy ra: D gồm Cu, FeO, CaCO3, Fe. Dung dịch C gồm Ca(AlO2)2, Ca(OH)2 dư.
CaCO3 + H2SO4 đặc →CaSO4 + CO2 + H2O
Cu + 2H2SO4 đặc →CuSO4 + 2H2O + SO2
2FeO + 4H2SO4 đặc →Fe2(SO4)3 + SO2 + 4H2O
2Fe + 6H2SO4 đặc → Fe2(SO4)3 + 3SO2 + 6H2O
2.
a) Đặt số mol của MO, M(OH)2, MCO3 tương ứng là x, y, z.
Nếu tạo muối trung hòa ta có các phản ứng:
MO + H2SO4 →MSO4 + H2O (1)
M(OH)2 + H2SO4 →MSO4 + 2H2O (2)
MCO3 + H2SO4 →MSO4 + H2O + CO2 (3)
Nếu tạo muối axít ta có các phản ứng:
MO + 2H2SO4 →M(HSO4)2 + H2O (4)
M(OH)2 + 2H2SO4 →M(HSO4)2 + 2H2O (5)
MCO3 + 2H2SO4 →M(HSO4)2 + H2O + CO2 (6)
Ta có : MMuối =\({{D.C\% .10} \over {{C_M}}} = {{1,093.10,867.10} \over {0,545}} \approx 218\)
- TH1: Nếu muối là MSO4 M + 96 = 218 M = 122 (loại)
- TH2: Nếu là muối M(HSO4)2 M + 97.2 = 218 M = 24 (Mg)
Vậy xảy ra phản ứng (4, 5, 6) tạo muối Mg(HSO4)2
b) Theo (4, 5, 6) Số mol CO2 = 0,448/22,4 = 0,02 molz = 0,02 (I)
Số mol H2SO4 =\({{{\rm{117}}{\rm{,6}}{\rm{.10}}} \over {{\rm{98}}}} = 0,12\) mol
2x + 2y + 2z = 0,12 (II)
Đề bài: 40x + 58y + 84z = 3,64 (III)
Giải hệ (I, II, III): x = 0,02; y = 0,02; z = 0,02
%MgO = 40.0,02.100/3,64 = 21,98%
%Mg(OH)2 = 58.0,02.100/3,64 = 31,87%
%MgCO3 = 84.0,02.100/3,64 = 46,15%
Câu hỏi 13 :
Hòa tan hết 18,6 gam hỗn hợp A gồm Fe và kim loại R (hóa trị 2 không đổi) vào 200 ml dung dịch HCl 3,5M thu được 6,72 lít khí (đktc) và dung dịch B.
Mặt khác nếu cho 2,6 gam kim loại R và 39 ml dung dịch H2SO4 1M thì sau khi phản ứng hoàn toàn vẫn còn dư kim loại.
a) Xác định kim loại R và phần trăm theo khối lượng của Fe, R trong hỗn hợp A.
b) Cho toàn bộ dung dịch B ở trên tác dụng với V lít dung dịch NaOH 2M thì thu được kết tủa, lọc lấy kết tủa rồi nung nóng trong không khí đến khối lượng không đổi được 16,1 gam chất rắn. Biết rằng các phản ứng xảy ra hoàn toàn và toàn bộ lượng muối của Fe trong B đã phản ứng hết với NaOH. Tính giá trị của V.
Phương pháp giải:
a) Nhận thấy: nH(HCl) > 2nH2 ⟹ HCl dư, KL hết
Giả sử 18,6 gam A chứa a mol Fe và b mol R
Tính toán ra được kim loại R
b) Chia 2 trường hợp
Trường hợp 1: Kết tủa R(OH)2 chưa bị hòa tan
Trường hợp 1: Kết tủa R(OH)2 bị hòa tan một phần.
Lời giải chi tiết:
a)
nHCl = 0,2.3,5 = 0,7 mol; nH2 = 0,3 mol
Nhận thấy: nH(HCl) > 2nH2 ⟹ HCl dư, KL hết
Giả sử 18,6 gam A chứa a mol Fe và b mol R
Fe + 2HCl → FeCl2 + H2
a → 2a → a
R + 2HCl → RCl2 + H2
b → 2b → b
(1) mhh = 56a + Rb = 18,6
(2) nH2 = a + b = 0,3
\(\xrightarrow{{\left( 1 \right) - 56 \times \left( 2 \right)}}\)\(\left( {R - 56} \right)b = 1,8 \to b = \frac{{1,8}}{{R - 56}}\)
Nhận thấy: 0 < b < 0,3 ⟹ \(0 < \frac{{1,8}}{{R - 56}} < 0,3 \Leftrightarrow 0,3.\left( {R - 56} \right) > 1,8 \Leftrightarrow R > 62\) (*)
- Khi cho 2,6 gam R phản ứng với 0,039 mol H2SO4:
R + H2SO4 → RSO4 + H2
Do R còn dư nên nR > nH2SO4 ⇔ \(\frac{{2,6}}{R} > 0,039 \Leftrightarrow R < 66,67\)(**)
Từ (*) (**) ⟹ R là kim loại Zn (R = 65)
Thay R = 65 vào (1) ta có \(\left\{ \begin{array}{l}56{\rm{a}} + 65b = 18,6\\a + b = 0,3\end{array} \right. \to \left\{ \begin{array}{l}a = 0,1\\b = 0,2\end{array} \right. \to \left\{ \begin{array}{l}\% {m_{F{\rm{e}}}} = \frac{{0,1.56}}{{18,6}}.100\% = 30,1\% \\\% {m_{Zn}} = 100\% - 30,1\% = 69,9\% \end{array} \right.\)
b)
Dung dịch B gồm: FeCl2 (0,1 mol); ZnCl2 (0,2 mol) và HCl dư (0,1 mol)
Theo đề bài toàn bộ muối Fe phản ứng hết với NaOH nên ta toàn Fe:
nFe2O3 = ½.nFe = 0,05 mol → mFe2O3 = 8 gam
→ mZnO = 16,1 - 8 = 8,1 gam → nZnO = 0,1 mol
*Trường hợp 1: Kết tủa Zn(OH)2 chưa bị hòa tan
HCl + NaOH → NaCl + H2O
0,1 → 0,1
FeCl2 + 2NaOH → Fe(OH)2 ↓
0,2 ← 0,1
ZnCl2 + 2NaOH → Zn(OH)2 ↓
0,2 ← 0,1
4Fe(OH)2 + O2 \(\xrightarrow{{{t^o}}}\) 2Fe2O3 + 4H2O
0,1 ← 0,05
Zn(OH)2 \(\xrightarrow{{{t^o}}}\) ZnO + H2O
0,1 ← 0,1
⟹ nNaOH = 0,1 + 0,2 + 0,2 = 0,5 mol
⟹ V = 0,25 lít
*Trường hợp 2: Kết tủa Zn(OH)2 bị hòa tan một phần
HCl + NaOH → NaCl + H2O
0,1 → 0,1
FeCl2 + 2NaOH → Fe(OH)2 ↓
0,2 ← 0,1
ZnCl2 + 2NaOH → Zn(OH)2 ↓
0,2 → 0,4 → 0,2
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O
(0,2-0,1) → 0,2
4Fe(OH)2 + O2 \(\xrightarrow{{{t^o}}}\) 2Fe2O3 + 4H2O
0,1 ← 0,05
Zn(OH)2 \(\xrightarrow{{{t^o}}}\) ZnO + H2O
0,1 ← 0,1
⟹ nNaOH = 0,1 + 0,2 + 0,4 + 0,2 = 0,9 mol
⟹ V = 0,45 lít
Câu hỏi 14 :
Hòa tan hoàn toàn 12 gam một kim loại M (hóa trị II) bằng dung dịch H2SO4 loãng được 11,2 lít khí hiđro (ở đktc). Kim loại M là
- A Mg.
- B Ca.
- C Fe.
- D Zn.
Đáp án: A
Phương pháp giải:
Bước 1: Đổi số mol H2 theo công thức: nH2(đktc) = VH2/22,4
Bước 2: Viết PTHH xảy ra, tính số mol M theo số mol H2
Bước 3: Tính MM = mM/nM ⟹ từ đó kết luận được kim loại M
Lời giải chi tiết:
nH2(đktc) = VH2/22,4 = 11,2/22,4 = 0,5 (mol)
PTHH: M + H2SO4 → MSO4 + H2↑
Theo PTHH: nM = nH2 = 0,5 (mol)
⟹ MM = mM/nM = 12/0,5 = 24 (g/mol)
⟹M là Mg
Đáp án A
Câu hỏi 15 :
Cho 1,896 gam KMnO4 vào dung dịch HCl đặc, du, đun nhẹ. Sau khi kết thúc phản ứng, cho toàn bộ lượng Cl2 tạo ra tác dụng hết với kim loại M (hóa trị n không đổi trong các hợp chất), thu được 5,380 gam hỗn hợp chất rắn X. Cho toàn bộ lượng X vào dung dịch AgNO3 dư, thu được 12,930 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn, xác định kim loại M.
Lời giải chi tiết:
\({n_{KMn{O_4}}} = \frac{{1,896}}{{158}} = 0,012\left( {mol} \right)\)
- Khi cho KMnO4 phản ứng với HCl đặc
(1) 2 KMnO4 + 16 HClđặc \(\xrightarrow{{{t^o}}}\) 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
0,012 → 0,03 mol
Bảo toàn nguyên tố Cl → nAgCl = 2nCl2 = 0,06 mol
⟹ mAgCl = 0,06.143,5 = 8,61 gam < 12,93 gam
⟹ Ngoài AgCl thì còn có kết tủa khác
⟹ Kim loại M có phản ứng với AgNO3
- Khi cho Cl2 tác dụng hết với kim loại M (có hóa trị n không đổi):
(2) n Cl2 + 2 M \(\xrightarrow{{{t^o}}}\) 2 MCln
0,03 → 0,06/n (mol)
→ Hỗn hợp chất rắn X gồm MCln (0,06/n mol) và M dư (a mol)
→ mX = \(\frac{{0,06}}{n}.\left( {M + 35,5n} \right) + a.M\) = 5,38 (1)
- Khi cho X tác dụng AgNO3 dư:
(3) MCln + n AgNO3 → n AgCl ↓ + M(NO3)n
0,06/n → 0,06 (mol)
(4) n M + 2n AgNO3 → n M(NO3)2 + 2n Ag ↓
a → 2a (mol)
→ mkết tủa = 8,61 + 108.2a = 12,93 (2)
Từ (2) ⟹ a = 0,02. Thay vào (1) ta được:
\(\begin{array}{l}\,\,\,\,\,\,\,\frac{{0,06}}{n}.\left( {M + 35,5n} \right) + 0,02.M = 5,38\\ \to 0,06M + 2,13n + 0,02M.n = 5,38n\\ \to M = \frac{{3,25n}}{{0,02n + 0,06}}\end{array}\)
Biện luận với n = 1, 2, 3 ta thấy n = 2 và M = 65 thỏa mãn
Vậy kim loại M là Kẽm (kí hiệu Zn)
>> Học trực tuyến lớp 9 và Lộ trình UP10 trên Tuyensinh247.com Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Lộ trình học tập 3 giai đoạn: Học nền tảng lớp 9, Ôn thi vào lớp 10, Luyện Đề. Bứt phá điểm lớp 9, thi vào lớp 10 kết quả cao. Hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 20 bài tập vận dụng áp dụng định luật bảo toàn khối lượng có lời giải
- 15 bài tập áp dụng định luật tăng giảm khối lượng có lời giải
- 10 bài tập vận dụng áp dụng phương pháp tương đương (công thức trung bình) có lời giải
- 10 câu hỏi vận dụng áp dụng phương pháp biện luận có lời giải
- 10 bài tập vận dụng áp dụng phương pháp bảo toàn nguyên tố có lời giải
- 10 bài tập vận dụng về phương pháp qui đổi có lời giải
- 10 bài tập vận dụng áp dụng phương pháp bảo toàn nguyên tố có lời giải
- 10 câu hỏi vận dụng áp dụng phương pháp biện luận có lời giải
- 10 bài tập vận dụng áp dụng phương pháp tương đương (công thức trung bình) có lời giải
- 15 bài tập áp dụng định luật tăng giảm khối lượng có lời giải