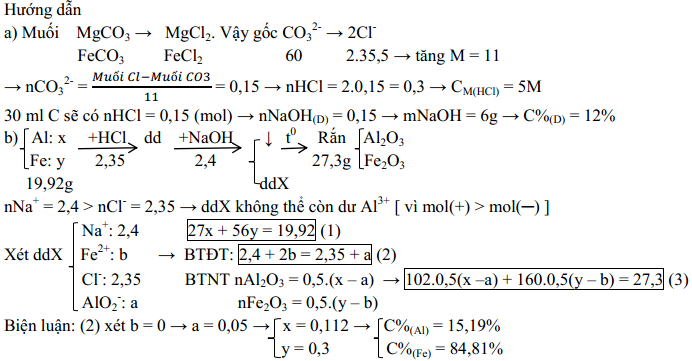10 bài tập vận dụng cao về HCl, H2SO4 loãng có lời giải
Làm đề thiCâu hỏi 1 :
(2,0 điểm):
Hỗn hợp X gồm Cu,Mg và Fe3O4.Cho 20,8g hỗn hợp X tác dụng với dung dịch H2SO4 loãng, dư sau phản ứng thu được dung dịch Y, thấy thoát ra 3,584 lit khí(dktc) và còn lại m gam chất rắn không tan. Cho dung dịch Y tác dụng với lượng dư dung dịch NaOH thu được kết tủa Z, lọc lấy Z nung ngoài không khí đến khối lượng không đổi thu được 19,2g chất rắn E. Biết các phản ứng xảy ra hoàn toàn .
- Tính m
- Tính thành phần phần trăm về khối lượng của các chất trong 20,8g X.
Lời giải chi tiết:
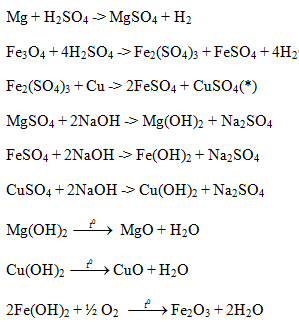
Chỉ có Mg phản ứng với axit tạo H2 => nMg = nH2 = 0,16 mol
Vì X +H2SO4 sau đó còn chất rắn => chính là Cu => Fe3+ chuyển hết thành Fe2+
Nếu số mol của Fe3O4 ban đầu là x mol
Theo (*) : nCuSO4 = x mol
Chất rắn E sẽ gồm : 0,16 mol MgO ; x mol CuO và 1,5x mol Fe2O3
=> 19,2 = 0,16.40 + 80x + 160.1,5x => x = 0,04 mol
,m gam chất rắn chính là lượng Cu không phản ứng :
m = mX – mCu pứ - mFe3O4 – mMg
=> m = 5,12g
%mMg(X) = 18,46% ; %mFe3O4 = 44,62% ; %mCu = 36,92%
Câu hỏi 2 :
Cho hỗn hợp Y gồm 2 amino axit Y1 và Y2 có mạch cacbon không phân nhánh. Tổng số mol của Y1 và Y2 là 0,05mol. Cho hỗn hợp Y tác dụng hoàn toàn với 50ml dung dịch H2SO4 0,55M, để trung hòa hết lượng H2SO4 dư cần dùng 10ml dd NaOH 0,5M. Hỗn hợp Y tác dụng vừa đủ với 200ml dd Ba(OH)2 0,15M, cô cạn dd sau phản ứng thu được 8,52 gam muối khan. Đốt cháy hoàn toàn hỗn hợp Y rồi cho sản phẩm qua nước vôi trong dư thu được 13 gam kết tủa. Cho biết Y1 có số nguyên tử cacbon nhỏ hơn Y2. Xác định công thức cấu tạo có thể có của Y1 và Y2.
Lời giải chi tiết:
Tác dụng với H2SO4 và NaOH
nH2SO4 = 0,0275mol
nNaOH = 0,005mol
=> nH2SO4 phản ứng với Y = 0,025 mol
2R-NH2 + H2SO4 → Muối
0,05 0,025
=> Trong Y có 1 nhóm NH2
Tác dụng với Ba(OH)2
nBa(OH)2 = 0,03 mol
Ta có
=> hh Y gồm R(COOH)(NH2): x mol và R’(COOH)2(NH2): y mol
Ta có x + y = 0,05 và x + 2y = 0,06
=> x = 0,04 và y = 0,01
Đốt cháy Y
nCO2 = 0,13 mol
=> số nguyên tử C trung bình = 2,6
=> Y1: H2N – CH2 – COOH: 0,04 mol
Và Y2: H2N – R’ – (COOH)2: 0,01 (có a nguyên tử C)
Có\({{0,04.2 + a.0,01} \over {0,05}} = 2,6 = > a = 5\)
m muối khan = 8,52g = (75 - 1) . 0,01 + (MY2 - 2) . 0,01 + 0,03 . 137 => MY2 = 147
do Y2 có mạch không phân nhánh => Y2 có thể có công thức sau
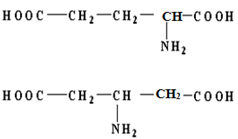
Y1: H2N – CH2 – COOH
Câu hỏi 3 :
Hỗn hợp A gồm MgO và CaO, hỗn hợp B gồm MgO và Al2O3 đều có khối lượng là 9,6 gam. Khối lượng của MgO trong B bằng 1,125 lần khối lượng MgO trong A.
1. Cho hỗn hợp A tác dụng với 100 ml dung dịch HCl 19,88% (D = 1,047g/cm3) được dung dịch X. Cho dung dịch X tác dụng với Na2CO3 thấy thoát ra tối đa 1,904 lít khí (đktc). Tính:
a. Thành phần % khối lượng các oxit có trong A.
b. Nồng độ % các chất có trong dung dịch X.
2. Cho hỗn hợp B tác dụng với cùng một lượng dung dịch HCl như trên được dung dịch Y. Thêm 340 ml dung dịch KOH 2M vào dung dịch Y thì lượng kết tủa thu được là bao nhiêu?
Lời giải chi tiết:
\(\eqalign{
& \underbrace {A\left\{ \matrix{
MgO:x \hfill \cr
CaO:y \hfill \cr} \right.}_{9,6g}\buildrel { + HCl:0,57} \over
\longrightarrow {\rm{dd}}\,X\buildrel { + N{a_2}C{O_3}} \over
\longrightarrow \underbrace { \uparrow C{O_2}}_{0,085} \cr
& a. \cr
& Pt:{\rm{ }} \cr
& 2HCl{\rm{ }} + {\rm{ }}N{a_2}C{O_3} \to {\rm{ }}2NaCl{\rm{ }} + {\rm{ }}C{O_2} \uparrow {\rm{ }} + {\rm{ }}{H_2}O \cr
& 0,17{\rm{ }}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{\rm{ }}\,\,\,\,\,\,\,\,\,\,\, \leftarrow 0,085 \cr
& \to {\rm{ }}{n_{HClpu}} = {\rm{ }}0,4 \cr
& MgO{\rm{ }} + {\rm{ }}2HCl{\rm{ }} \to {\rm{ }}MgC{l_2} + {\rm{ }}{H_2}O \cr
& CaO{\rm{ }} + {\rm{ }}2HCl{\rm{ }} \to {\rm{ }}CaC{l_2} + {\rm{ }}{H_2}O \cr
& \to \left\{ \matrix{
40x + 56y = 9,6 \hfill \cr
2x + 2y = 0,4 \hfill \cr} \right. \to \left\{ \matrix{
x = 0,1 \hfill \cr
y = 0,1 \hfill \cr} \right. \to \left\{ \matrix{
\% MgO = 25\% \hfill \cr
\% CaO = 75\% \hfill \cr} \right. \cr
& b. \cr
& {m_X}{\rm{ }} = {\rm{ }}{m_A}{\rm{ }} + {\rm{ }}{m_{ddHCl}}{\rm{ }} = {\rm{ }}114,3{\rm{ }}\left( g \right) \cr
& A\left\{ \matrix{
MgO:0,1 \hfill \cr
CaO \hfill \cr} \right.\buildrel {{m_{MgO(A)}} = 1,125\,.\,{m_{MgO(B)}}} \over
\longrightarrow B\left\{ \matrix{
MgO:0,1125 \hfill \cr
A{l_2}{O_3}:0,05 \hfill \cr} \right. \to Y\left\{ \matrix{
\buildrel {BTNT\,Mg} \over
\longrightarrow MgC{l_2}:0,1125 \hfill \cr
\buildrel {BTNT\,Al} \over
\longrightarrow AlC{l_3}:0,1 \hfill \cr
\buildrel {BTNT\,Cl} \over
\longrightarrow HCl{\,_{du}}:0,045 \hfill \cr} \right. \cr
& Y\left\{ \matrix{
MgC{l_2}:0,1125 \hfill \cr
AlC{l_3}:0,1 \hfill \cr
HCl{\,_{du}}:0,045 \hfill \cr} \right.\buildrel { + KOH:0,68mol} \over
\longrightarrow {\rm{dd}}Y\left\{ \matrix{
\buildrel {BTNT\,Cl} \over
\longrightarrow KCl:0,57 \hfill \cr
\buildrel {BTNT\,Al} \over
\longrightarrow KAl{O_2}:0,1 \hfill \cr
\buildrel {BTNT\,K} \over
\longrightarrow KO{H_{du}}:0,01 \hfill \cr} \right. = > {m_{Al{{(OH)}_3} \downarrow }} = 0g \cr} \)
Câu hỏi 4 :
Hòa tan 12,6 gam hỗn hợp hai kim loại M (hóa trị II) và M’ (hóa trị III) bằng axit HCl dư, thu được dung dịch A và khí B. Đốt cháy hoàn toàn ½ lượng khí B trên thu được 2,79 gam H2O.
a) Cô cạn dung dịch A thu được m gam hỗn hợp muối khan. Tính giá trị m.
b) Cho lượng khí B còn lại phản ứng hoàn toàn với khí Cl2 vừa đủ (t0C) rồi cho sản phẩm thu được hấp thụ vào 0,2 lít dung dịch NaOH 16% (d = 1,20g/ml). Tính nồng độ % các chất trong dung dịch thu được.
Lời giải chi tiết:
\(12,6g\left\{ \matrix{
{M^{(2)}} \hfill \cr
M{'^{(3)}} \hfill \cr} \right.\buildrel { + HCl} \over
\longrightarrow \left\{ \matrix{
\uparrow {H_2}\buildrel { + {O_2}} \over
\longrightarrow {H_2}O:0,31 \hfill \cr
{\rm{dd}}\,A \hfill \cr
m(g) \hfill \cr} \right.\)
Đồng nhất dữ kiện để thuận lợi cho tính toán, bằng cách nhân đôi khối lượng H2O.
a.
BTNT H: nH2 = nH2O = 0,31 mol
=> nHCl = 0,62mol
BTKL: m kim loại + mHCl = mA + mB => 12,6 + 36,5 . 0,62 = m + 2 . 0,31 => m = 34,61g
b.
\(\eqalign{
& {H_2}\,\,\,\,\,\,\, + \,\,\,\,\,\,\,\,\,\,{\rm{ }}C{l_2} \to {\rm{ }}2HCl \cr
& 0,155 \to {\rm{ }}0,155{\rm{ }}\,\,\,\,\,\,\,\,\,\,\,0,31 \cr
& \left\{ \matrix{
HCl:0,31 \hfill \cr
NaOH = {{0,2\,.\,1000\,.\,1,2\,.\,16\% } \over {40}} = 0,96 \hfill \cr} \right. \to {\rm{dd}}\left\{ \matrix{
\buildrel {BTNT\,Cl} \over
\longrightarrow NaCl:0,31 \hfill \cr
\buildrel {BTNT\,Na} \over
\longrightarrow NaOH\,du:\,0,65 \hfill \cr} \right. \cr
& {m_{{\rm{dd}}\,s}} = {m_{HCl}} + {m_{{\rm{dd}}\,NaOH}} = 36,5\,.\,0,31\, + 0,2\,.1000\,.\,1,2 = 251,315g \cr
& = > \left\{ \matrix{
\% NaCl:7,216\% \hfill \cr
\% NaOH\,du:10,346\% \hfill \cr} \right. \cr} \)
Câu hỏi 5 :
Cho 1,56 gam hỗn hợp gồm Al và Al2O3 phản ứng hết với dung dịch HCl (dư), thu được V lít khí H2 (đktc) và dung dịch X. Nhỏ từ từ dung dịch NH3 đến dư vào dung dịch X thu được kết tủa, lọc hết lượng kết tủa, nung đến khối lượng không đổi thu được 2,04 gam chất rắn. Giá trị của V là
- A 0,448.
- B 0,224.
- C 1,344.
- D 0,672
Đáp án: D
Phương pháp giải:
\(\left. \begin{gathered}
Al \hfill \\
A{l_2}{O_3} \hfill \\
\end{gathered} \right\}\xrightarrow{\begin{subarray}{l}
\\
+ HCl
\end{subarray} }AlC{l_3}\xrightarrow{{N{H_3}}}Al{(OH)_3}\xrightarrow{{nung}}A{l_2}{O_3}\)
nchất rắn = nAl2O3 = 2,04/102= 0,02 mol => nAl(chất rắn) = 0,02.2=0,04mol
Trong hỗn hợp ban đầu có: Al ( x mol), Al2O3 (y mol) => mhh = 27x+102y= 1,56 (1)
Bảo toàn nguyên tố Al
nAl(hỗn hợp) = nAl (chất rắn) = x + 2y=0,04 (2)
(1)(2) => x,y
2Al + 6HCl→2AlCl3 + 3H2
=> VH2
Lời giải chi tiết:
\(\left. \begin{gathered}
Al \hfill \\
A{l_2}{O_3} \hfill \\
\end{gathered} \right\}\xrightarrow{\begin{subarray}{l}
\\
+ HCl
\end{subarray} }AlC{l_3}\xrightarrow{{N{H_3}}}Al{(OH)_3}\xrightarrow{{nung}}A{l_2}{O_3}\)
nchất rắn = nAl2O3 = 2,04/102= 0,02 mol => nAl(chất rắn) = 0,02.2=0,04mol
Trong hỗn hợp ban đầu có: Al ( x mol), Al2O3 (y mol) => mhh = 27x+102y= 1,56 (1)
Bảo toàn nguyên tố Al
nAl(hỗn hợp) = nAl (chất rắn) = x + 2y=0,04 (2)
(1)(2) => x=0,02, y=0,01
2Al + 6HCl→2AlCl3 + 3H2
0,02 0,03
=> VH2 = 0,03.22,4= 0,672 lít
Đáp án D
Câu hỏi 6 :
Một hỗn hợp kim loại gồm Al, Cu, Fe . Nếu cho hỗn hợp này tác dụng với dung dịch HCl dư thì thu được 8,96 lít khí (đktc) và 9 gam chất rắn. Nếu cho hỗn hợp này tác dụng vừa đủ với dung dịch NaOH thì phải dùng 100 ml dung dịch NaOH 2M. % khối lượng của Fe trong hỗn hợp là
- A 27%
- B 50%
- C 28%
- D 45%
Đáp án: C
Phương pháp giải:
mchất rắn = mCu = 9 gam
nNaOH= 0,1.2=0,2 mol
nH2= V/22,4= 0,4 mol
Al + NaOH +H2O →NaAlO2 + \(\frac{3}{2}\)H2
2Al +6HCl →2AlCl3 + 3H2
Fe + 2HCl→FeCl2 + H2
Đặt số mol các chất vào PTHH, tính toán theo PTHH
=> mhh = mAl + mFe + mCu
=> %mFe
Lời giải chi tiết:
mchất rắn = mCu = 9 gam
nNaOH= 0,1.2=0,2 mol
nH2= V/22,4= 0,4 mol
Al + NaOH +H2O →NaAlO2 + \(\frac{3}{2}\)H2
0,2 0,2
2Al +6HCl →2AlCl3 + 3H2
0,2 0,3
Fe + 2HCl→FeCl2 + H2
0,1 0,1
=> mhh = mAl + mFe + mCu = 0,2.27+0,1.56+ 9= 20 gam
=> \(\% {m_{Fe}} = \frac{{{m_{Fe}}}}{{{m_{hh}}}}.100\% = \frac{{0,1.56}}{{20}}.100\% = 28\% \)
Đáp án C
Câu hỏi 7 :
Cho hỗn hợp Al và 1 kim loại hóa trị II tan trong dung dịch H2SO4 loãng vừa đủ thu được dung dịch A và có H2 thoát ra. Cho A tác dụng với dung dịch BaCl2 vừa đủ thấy tách ra 93,2 gam kết tủa trắng. Lọc kết tủa rồi cô cạn nước lọc thu được 36,2 gam muối khan. Khối lượng kim loại ban đầu là
- A 7,8
- B 7,9
- C 8
- D 8,6
Đáp án: A
Phương pháp giải:
nBaSO4 = 93,2/233= 0,4 mol = nBaCl2
=> nCl (muối khan) = 2 nBaCl2 = 0,8 mol
m muối khan = mKl + mClo = mKl + 0,8.35,5 = 36,2
=> mKL
Lời giải chi tiết:
nBaSO4 = 93,2/233= 0,4 mol = nBaCl2
=> nCl (muối khan) = 2 nBaCl2 = 0,8 mol
m muối khan = mKl + mClo = mKl + 0,8.35,5 = 36,2
=> mKL= 7,8 g
Đáp án A
Câu hỏi 8 :
Hòa tan 30,0 gam hỗn hợp X gồm Cu và Fe3O4 vào 500 ml dung dịch H2SO4 1M. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch Y và 6,32 gam chất rắn Z. Z không tan trong dung dịch HCl. Thêm nước vào Y để được 600 ml dung dịch Y1.
a) Viết các phương trình phản ứng xảy ra và tính % khối lượng của các chất trong hỗn hợp X.
b) Cô cạn 300 ml dung dịch Y1, thu được chất rắn khan T. Tính phần trăm khối lượng của các chất có trong T.
c) Để loại hết các chất tan trong 300 ml dung dịch Y1 cần V lít dung dịch U 0,2M. Cho biết tên dung dịch U và tính V?
Lời giải chi tiết:
\(X\left\{ \matrix{ Cu \hfill \cr Fe \hfill \cr} \right.\buildrel { + {H_2}S{O_4}:\,0,5mol} \over \longrightarrow \left\{ \matrix{ ran\,Z:\,Cu(0,09875) \hfill \cr {\rm{dd}}\,Y\buildrel { + {H_2}O} \over \longrightarrow \underbrace {{\rm{dd}}\,{Y_1}}_{600ml} \to \left[ \matrix{ \buildrel {co\,can} \over \longrightarrow ran\,T \hfill \cr \buildrel {{\rm{dd}}\,U} \over \longrightarrow \hfill \cr} \right. \hfill \cr} \right.\)
a.Gọi a, b lần lượt là số mol của Cu và Fe3O4
\( \to \left\{ \matrix{ 64a + 232b = 30 \hfill \cr a - b = 0,09875 \hfill \cr} \right. \to \left\{ \matrix{ a = 0,17875 \hfill \cr b = 0,08 \hfill \cr} \right. \to \left\{ \matrix{ \% Cu = 38,13\% \hfill \cr \% F{e_3}{O_4} = 61,87\% \hfill \cr} \right.\)
b.
\({Y_1}\left\{ \matrix{ CuS{O_4}:0,04 \hfill \cr FeS{O_4}:0,12 \hfill \cr {H_2}S{O_4}\,du:0,09 \hfill \cr} \right.\buildrel {{t^o}} \over \longrightarrow ran\,T\left\{ \matrix{ CuS{O_4}:0,04 \hfill \cr FeS{O_4}:0,12 \hfill \cr} \right. \to \left\{ \matrix{ \% CuS{O_4} = 25,97\% \hfill \cr FeS{O_4} = 74,03\% \hfill \cr} \right.\)
c. Ta dùng Ba(OH)2
\({Y_1}\left\{ \matrix{ CuS{O_4}:0,04 \hfill \cr FeS{O_4}:0,12 \hfill \cr {H_2}S{O_4}\,du:0,09 \hfill \cr} \right.\buildrel {Ba{{(OH)}_2}:\,0,2V\,mol} \over \longrightarrow \left\{ \matrix{ \downarrow \left\{ \matrix{ BaS{O_4}:0,25 \hfill \cr Cu{(OH)_2}:0,04 \hfill \cr Fe{(OH)_2}:0,12 \hfill \cr} \right. \hfill \cr {H_2}O \hfill \cr} \right.\buildrel {BTNT\,Ba} \over \longrightarrow Ba{(OH)_2}:\,0,25mol = > V = 1,25l\)
Câu hỏi 9 :
(2 điểm) Cho 28,4 gam hỗn hợp A (chứa MgCO3 và FeCO3) vào cốc đựng 60 ml dung dịch C (chứa HCl), sau khi các phản ứng xảy ra hoàn toàn, làm bay hơi cẩn thận hỗn hợp đến khô trong điều kiện không có oxi, thu được 30,05 gam chất rắn khan. Mặt khác, 50 gam dung dịch D (chứa NaOH) phản ứng vừa đủ với 30 ml dung dịch C
a. Tính nồng độ mol của dung dịch C và nồng độ phần trăm của dung dịch D
b. Hòa tan 19,92 gam hỗn hợp B (chứa Al, Fe) vào cốc đựng 470 ml dung dịch C. Thêm tiếp 800 gam dung dịch D vào cốc. Lọc kết tủa và nung ngoài không khí đến khối lượng không đổi, thu được 27,3 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Tính thành phần phần trăm khối lượng mỗi kim loại có trong hỗn hợp B.
Lời giải chi tiết:
Câu hỏi 10 :
(1,5 điểm)
Cho hỗn hợp gồm Al2O3, Cu, Fe2O3 vào dung dịch H2SO4 loãng dư thu được dung dịch X và chất rắn Y. Cho từ từ dung dịch NaOH tới dư vào dung dịch X thu dược dung dịch Z và kết tủa M. Nung kết tủa M ngoài không khí tới khối lượng không đổi thu được chất rắn N. Cho khí H2 dư đi qua N nung nóng thu được chất rắn P. Sục khí CO2 tới dư vào dung dịch Z thu được kết tủa Q. Viết các phương trình phản ứng hóa học xảy ra và xác định thành phần các chất có trong X, Y, Z, M, N, P, Q. Biết các phản ứng xảy ra hoàn toàn.
Lời giải chi tiết:
X : Al2(SO4)3 ; CuSO4 ; FeSO4 ; Fe2(SO4)3 ; H2SO4
Y : Cu
Al2O3 + 3H2SO4 -> Al2(SO4)3 + 3H2O
Fe2O3 + 3H2SO4 -> Fe2(SO4)3 + 3H2O
Fe2(SO4)3 + Cu -> 2FeSO4 + CuSO4
Z : Na2SO4 ; NaOH ; NaAlO2
M : Cu(OH)2 ; Fe(OH)2 ; Fe(OH)3
FeSO4 + 2NaOH -> Fe(OH)2 + Na2SO4
Fe2(SO4)3 + 6NaOH -> 2Fe(OH)3 + 3Na2SO4
Al2(SO4)3 + 6NaOH -> 2Al(OH)3 + 3Na2SO4
NaOH + Al(OH)3 -> NaAlO2 + 2H2O
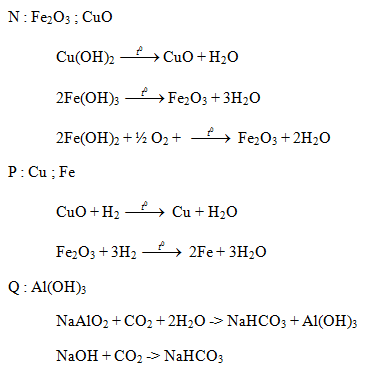
>> Học trực tuyến lớp 9 và Lộ trình UP10 trên Tuyensinh247.com Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Lộ trình học tập 3 giai đoạn: Học nền tảng lớp 9, Ôn thi vào lớp 10, Luyện Đề. Bứt phá điểm lớp 9, thi vào lớp 10 kết quả cao. Hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- 20 bài tập vận dụng áp dụng định luật bảo toàn khối lượng có lời giải
- 15 bài tập áp dụng định luật tăng giảm khối lượng có lời giải
- 10 bài tập vận dụng áp dụng phương pháp tương đương (công thức trung bình) có lời giải
- 10 câu hỏi vận dụng áp dụng phương pháp biện luận có lời giải
- 10 bài tập vận dụng áp dụng phương pháp bảo toàn nguyên tố có lời giải
- 10 bài tập vận dụng về phương pháp qui đổi có lời giải
- 10 bài tập vận dụng áp dụng phương pháp bảo toàn nguyên tố có lời giải
- 10 câu hỏi vận dụng áp dụng phương pháp biện luận có lời giải
- 10 bài tập vận dụng áp dụng phương pháp tương đương (công thức trung bình) có lời giải
- 15 bài tập áp dụng định luật tăng giảm khối lượng có lời giải