1. Thế điện cực chuẩn là gì?
- Thế điện cực của cặp oxi hoá - khử của kim loại trong điều kiện chuẩn (nồng độ ion kim loại trong dung dịch là 1 M, nhiệt độ 25°C) được gọi là thế điện cực chuẩn của kim loại (hay thế khử chuẩn của kim loại), kí hiệu là E°oxi hoá/khử và thường có đơn vị là volt (vôn).
+ Giá trị thế điện cực chuẩn càng nhỏ thì dạng khử có tính khử càng mạnh (kim loại càng mạnh) , dạng oxi hoá có tính oxi hoá càng yếu
+ Giá trị thế điện cực chuẩn càng lớn thì dạng khử có tính khử càng yếu (kim loại càng yếu) , dạng oxi hoá có tính oxi hoá càng mạnh.
2. Bảng giá trị thế điện cực chuẩn của một số cặp oxi hoá – khử
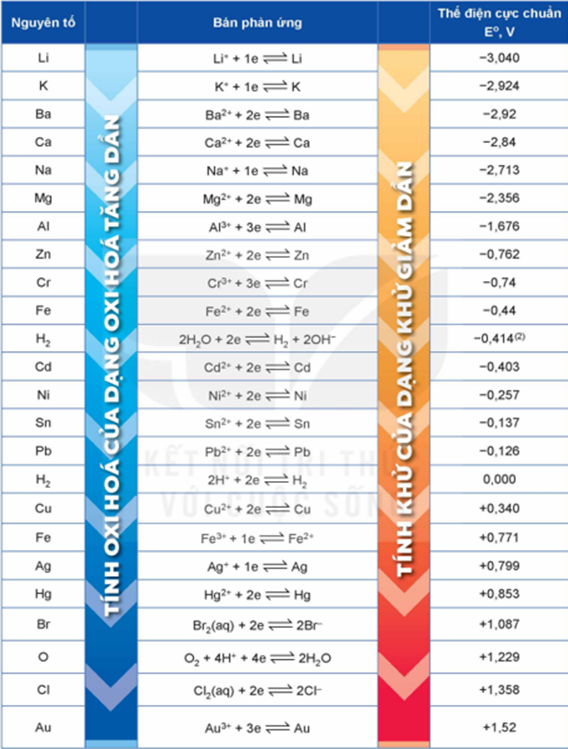
3. So sánh tính khử, tính oxi hoá giữa các cặp oxi hoá - khử
- Giữa hai cặp oxi hoá - khử, cặp có giá trị thế điện cực chuẩn nhỏ hơn thì dạng khử có tính khử mạnh hơn, còn dạng oxi hoá có tính oxi hoá yếu hơn và ngược lại => có thế (\({E^o}\)) nhỏ - kim loại mạnh.
Ví dụ: \(E_{C{u^{2 + }}/Cu}^o\)= + 0,340 V < \(E_{A{g^ + }/Ag}^o\)= + 0,799 V nên tính khử của Cu mạnh hơn Ag, tính oxi hoá của ion Cu2+ yếu hơn Ag+ ở điều kiện chuẩn.
- Trên cơ sở so sánh giá trị thế điện cực chuẩn, các cặp oxi hoá - khử Mn+/M được sắp xếp thành dãy theo chiều tăng dần thế điện cực chuẩn, thường gọi là dãy điện hoá của kim loại:
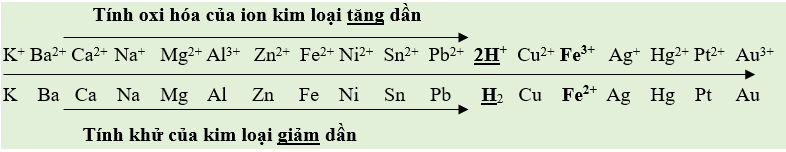
4. Dự đoán chiều phản ứng giữa hai cặp oxi hoá - khử
- Kim loại của cặp oxi hoá - khử có thế điện cực chuẩn nhỏ hơn có thể khử được cation kim loại của cặp oxi hoá - khử có thế điện cực chuẩn lớn hơn ở điều kiện chuẩn.
- Kim loại trong cặp oxi hoá - khử có thế điện cực chuẩn âm có thể khử được ion hydrogen (H+) trong dung dịch acid ở điều kiện chuẩn = kim loại đứng trước H tác dụng với HCl, H2SO4 loãng.
=> Chiều phản ứng :
Quy tắc alpha dự đoán chiều phản ứng oxi hoá - khử theo thế điện cực chuẩn như sau:
Nếu \(E_{{X^{m + }}/X}^o\)< \(E_{{Y^{n + }}/Y}^o\)thì vẽ chữ α theo chiều mũi tên dưới đây
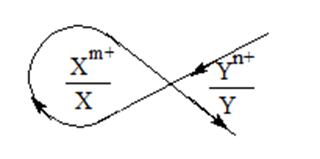
=> chiều phản ứng oxi hoá - khử m: Yn+ + nX \( \to \)nXm+ + mY
Thí dụ: \(E_{C{u^{2 + }}/Cu}^o = 0,340\,V\)< \(E_{A{g^ + }/Ag}^o = 0,799\,V\) => nên Ag+ có tính oxi hoá mạnh hơn Cu2+, Cu có tính khử mạnh hơn Ag. Vậy ở điều kiện chuẩn, phản ứng sau đây có thể diễn ra:
2Ag+(aq) + Cu(s) \( \to \) Cu2+(aq) + 2Ag(s) .
2AgNO3 + Cu \( \to \) Cu(NO3)2 + 2Ag .

 Pin điện và điện phân - Từ điển Hoá 12
Pin điện và điện phân - Từ điển Hoá 12 






Danh sách bình luận