1. Các dạng điện phân
Có hai dạng điện phân: điện phân nóng chảy & điện phân dung dịch.
a) Điện phân nóng chảy: chỉ có các ion ở mỗi điện cực tham gia.
b) Điện phân dung dịch: khi điện phân dung dịch ngoài các ion của chất điện phân còn có thể có nước bị oxi hoá và bị khử, bản thân kim loại làm điện cực. Khi đó quá trình oxi hoá – khử thực tế xảy ra phụ thuộc vào tính oxi hoá –khử mạnh hay yếu của các chất trong bình điện phân.
2. Điện phân nóng chảy
- Ở trạng thái nóng chảy, các tinh thể chất điện phân bị phá vỡ thành các ion chuyển động hỗn loạn. Khi có dòng điện một chiều chạy qua:
+ Ion dương chạy về cathode (cực âm) nhận electron (bị khử).
+ Ion âm chạy về anode (cực dương) và nhường electron (bị oxi hoá).
Ví dụ 1: Điện phân sodium chloride (NaCl) nóng chảy điều chế Na.
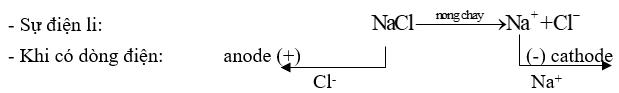
* Ở cực dương (anode): sự oxi hoá ion Cl- thành Cl2: \({\rm{C}}{{\rm{l}}^ - } \to \frac{1}{2}{\rm{C}}{{\rm{l}}_{\rm{2}}}{\rm{ + e}}\)
* Ở cực âm (cathode): sự khử ion Na+ thành Na: \({\rm{N}}{{\rm{a}}^{\rm{ + }}}{\rm{ + 1e}} \to {\rm{Na}}\)
* Phương trình điện phân: 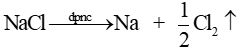
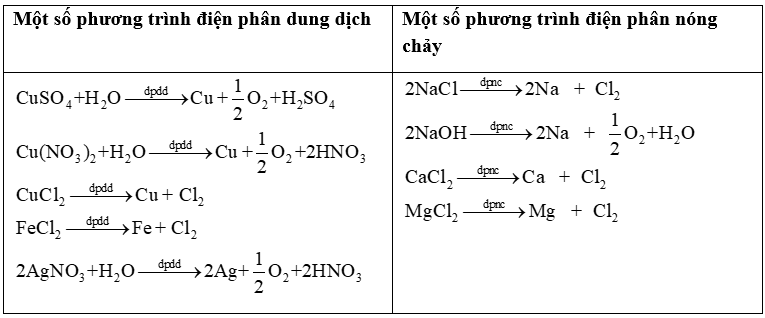
3. Điện phân dung dịch
|
Cathode (-) chứa ion dương (cation) |
Anode (+) chứa ion âm (anion) |
|
Thứ tự khử ở cathode: Au3+ > Ag+ > Hg2+ > Cu2+ > H+ > H2O. (Chỉ có ion kim loại sau Al3+ mới bị khử) Mn+ + ne \( \to \) M (M sau Al) Hết Mn+ thì H2O bị khử 2H2O + 2e \( \to \) H2 + 2\(O{H^ - }\) (pH >7) |
Thứ tự oxi hoá ở anode: \({S^{2 - }} > {I^ - } > B{r^ - } > C{l^ - } > O{H^ - } > {H_2}O\) (Các anion như \(NO_3^ - \), \(SO_4^{2 - }\),\(PO_4^{3 - }\),\(CO_3^{2 - }\), \({F^ - }\),\(ClO_4^ - \)coi như không bị điện phân). \({S^{2 - }}\)\( \to \) S + 2e 2X- → X2 + 2e ( X=Cl, Br, I) 4\(O{H^ - }\)\( \to \)O2 + 2H2O + 4e Hết \(C{l^ - }\), \(O{H^ - }\)nước bị oxi hoá: 2H2O \( \to \) O2 + 4H+ + 4e (pH<7) |
4. Các phản ứng xảy ra trong bình điện phân

 Pin điện và điện phân - Từ điển Hoá 12
Pin điện và điện phân - Từ điển Hoá 12 






Danh sách bình luận