1. Điện phân nóng chảy
- Ở trạng thái nóng chảy, các tinh thể chất điện phân bị phá vỡ thành các ion chuyển động hỗn loạn. Khi có dòng điện một chiều chạy qua:
+ Ion dương chạy về cathode (cực âm) nhận electron (bị khử).
+ Ion âm chạy về anode (cực dương) và nhường electron (bị oxi hoá).
Ví dụ 1: Điện phân sodium chloride (NaCl) nóng chảy điều chế Na.
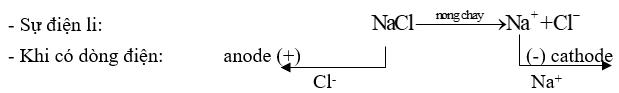
* Ở cực dương (anode): sự oxi hoá ion Cl- thành Cl2: \({\rm{C}}{{\rm{l}}^ - } \to \frac{1}{2}{\rm{C}}{{\rm{l}}_{\rm{2}}}{\rm{ + e}}\)
* Ở cực âm (cathode): sự khử ion Na+ thành Na: \({\rm{N}}{{\rm{a}}^{\rm{ + }}}{\rm{ + 1e}} \to {\rm{Na}}\)
* Phương trình điện phân: 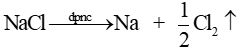
2. Điện phân dung dịch
|
Cathode (-) chứa ion dương (cation) |
Anode (+) chứa ion âm (anion) |
|
Thứ tự khử ở cathode: Au3+ > Ag+ > Hg2+ > Cu2+ > H+ > H2O. (Chỉ có ion kim loại sau Al3+ mới bị khử) Mn+ + ne \( \to \) M (M sau Al) Hết Mn+ thì H2O bị khử 2H2O + 2e \( \to \) H2 + 2\(O{H^ - }\) (pH >7) |
Thứ tự oxi hoá ở anode: \({S^{2 - }} > {I^ - } > B{r^ - } > C{l^ - } > O{H^ - } > {H_2}O\) (Các anion như \(NO_3^ - \), \(SO_4^{2 - }\),\(PO_4^{3 - }\),\(CO_3^{2 - }\), \({F^ - }\),\(ClO_4^ - \)coi như không bị điện phân). \({S^{2 - }}\)\( \to \) S + 2e 2X- → X2 + 2e ( X=Cl, Br, I) 4\(O{H^ - }\)\( \to \)O2 + 2H2O + 4e Hết \(C{l^ - }\), \(O{H^ - }\)nước bị oxi hoá: 2H2O \( \to \) O2 + 4H+ + 4e (pH<7) |
3. Một số công thức sử dụng trong điện phân
Định luật Faraday: \(m = \frac{{A.I.t}}{{n.F}}\)
Trong đó: m khối lượng chất thu dược ở điện cực (gam)
A là khối lượng mol nguyên tử thu được ở điện cực (amu)
n là số electron nguyên tử hoặc ion đã cho hoặc nhận.
I là cường độ dòng điện (A)
t là thời gian điện phân (s)
F là hằng số Faraday (F = 965000)
Bước 1: Tính n e trao đổi = \(\frac{{I.t}}{F}\)
Bước 2: Viết quá trình điện phân xảy ra ở 2 điện cực
Bước 3: Tính lượng chất đã điện phân hoặc lượng chất thu được sau điện phân.
Chú ý: V khí = V khí (anode) + V khí (cathode)
m dung dịch giảm = m kim loại + m khí thoát ra
m cathode = m kim loại.

 Pin điện và điện phân - Từ điển Hoá 12
Pin điện và điện phân - Từ điển Hoá 12 






Danh sách bình luận