1. Điện phân nóng chảy
- Ở trạng thái nóng chảy, các tinh thể chất điện phân bị phá vỡ thành các ion chuyển động hỗn loạn. Khi có dòng điện một chiều chạy qua:
+ Ion dương chạy về cathode (cực âm) nhận electron (bị khử).
+ Ion âm chạy về anode (cực dương) và nhường electron (bị oxi hoá).
Ví dụ 1: Điện phân sodium chloride (NaCl) nóng chảy điều chế Na.
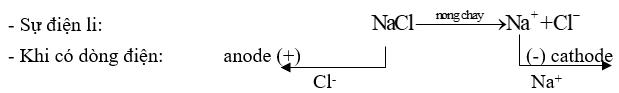
* Ở cực dương (anode): sự oxi hoá ion Cl- thành Cl2: \({\rm{C}}{{\rm{l}}^ - } \to \frac{1}{2}{\rm{C}}{{\rm{l}}_{\rm{2}}}{\rm{ + e}}\)
* Ở cực âm (cathode): sự khử ion Na+ thành Na: \({\rm{N}}{{\rm{a}}^{\rm{ + }}}{\rm{ + 1e}} \to {\rm{Na}}\)
* Phương trình điện phân: 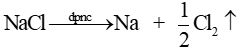
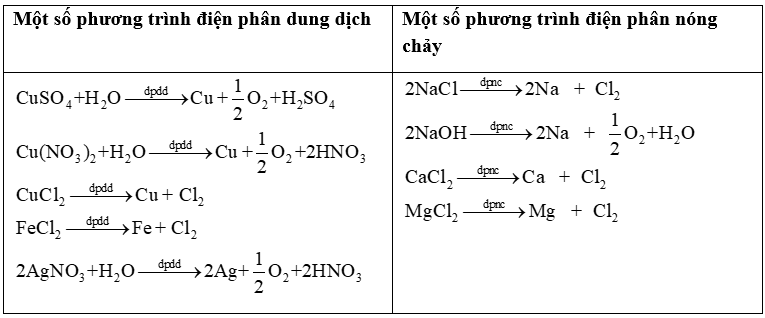
2. Điện phân dung dịch
|
Cathode (-) chứa ion dương (cation) |
Anode (+) chứa ion âm (anion) |
|
Thứ tự khử ở cathode: Au3+ > Ag+ > Hg2+ > Cu2+ > H+ > H2O. (Chỉ có ion kim loại sau Al3+ mới bị khử) Mn+ + ne \( \to \) M (M sau Al) Hết Mn+ thì H2O bị khử 2H2O + 2e \( \to \) H2 + 2\(O{H^ - }\) (pH >7) |
Thứ tự oxi hoá ở anode: \({S^{2 - }} > {I^ - } > B{r^ - } > C{l^ - } > O{H^ - } > {H_2}O\) (Các anion như \(NO_3^ - \), \(SO_4^{2 - }\),\(PO_4^{3 - }\),\(CO_3^{2 - }\), \({F^ - }\),\(ClO_4^ - \)coi như không bị điện phân). \({S^{2 - }}\)\( \to \) S + 2e 2X- → X2 + 2e ( X=Cl, Br, I) 4\(O{H^ - }\)\( \to \)O2 + 2H2O + 4e Hết \(C{l^ - }\), \(O{H^ - }\)nước bị oxi hoá: 2H2O \( \to \) O2 + 4H+ + 4e (pH<7) |
3. Các phản ứng xảy ra trong bình điện phân
4. Thí nghiệm 1: Điện phân dung dịch CuSO4
Chuẩn bị:
Hoá chất: dung dịch CuSO4 0,5 M.
Dụng cụ: nguồn điện một chiều (3 - 6 vôn), ống thuỷ tinh hình chữ U, hai điện cực than chì, dây dẫn, kẹp kim loại.
Tiến hành:
- Lắp thiết bị thí nghiệm điện phân dung dịch CuSO4 như Hình 16.2.
- Rót dung dịch CuSO4 0,5 M vào ống thuỷ tinh hình chữ U rồi nhúng hai điện cực than chì vào dung dịch.
- Nối hai điện cực than chì với hai cực của nguồn điện và tiến hành điện phân trong khoảng 5 phút.
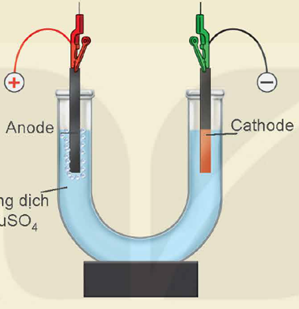
Sơ đồ thí nghiệm điện phân dung dịch CuSO4 với điện cực trơ
Quan sát hiện tượng xảy ra ở mỗi điện cực và giải thích.Viết phương trình xảy ra tại các cực và phương điện phân dung dịch.
Lời giải chi tiết
Hiện tượng: điện cực than chì ở cathode có kim loại đồng(màu đỏ) sinh ra bám vào.
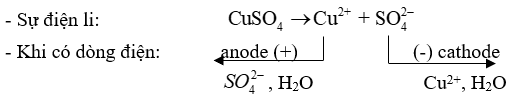
+ Ở cực dương (anode) sự oxi hoá H2O thành O2 : H2O \( \to \)\(\frac{1}{2}\)O2 + 2H+ + 2e
+ Ở cực âm (cathode) sự khử ion Cu2+ thành Cu: \({\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{ + 2e}} \to {\rm{Cu}}\)
+ Phương trình điện phân: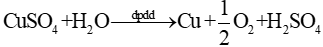
5. Sản xuất nhôm từ quặng bauxite
Trong công nghiệp, nhôm được sản xuất từ quặng bauxite theo hai giai đoạn chính:
Giai đoạn 1: Tinh chế quặng bauxite
Quặng bauxite (thành phần chính Al2O3.2H2O) thường lẫn tạp chất. Sau khi loại bỏ tạp chất bằng phương pháp hoá học thu được Al2O3.
Giai đoạn 2: Điện phân Al2O3 nóng chảy
Do Al2O3 có nhiệt độ nóng chảy rất cao (2050°C) nên Al2O3 được trộn cùng với cryolite (Na3AlF6) để
- Tạo thành hỗn hợp nóng chảy ở gần 1000°C. Giải pháp này giúp tiết kiệm nhiều năng lượng.
- Tạo chất lỏng vừa có tính dẫn điện tốt vừa nổi lên trên Al lỏng để ngăn cách Al lỏng không bị oxi hoá bởi không khí.
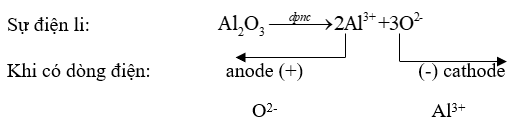
* Ở cực dương (anode) sự oxi hoá ion O2- thành O2 : \({\rm{2}}{{\rm{O}}^{2 - }} \to {{\rm{O}}_{\rm{2}}}{\rm{ + 4e}}\)
* Ở cực âm (cathode) sự khử ion Al3+ thành Al: : \({\rm{A}}{{\rm{l}}^{{\rm{3 + }}}}{\rm{ + 3e}} \to {\rm{Al}}\)
* Phương trình điện phân: 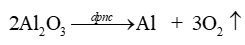
Khí O2 tạo thành ở nhiệt độ cao, đốt cháy dần điện cực anode than chì thành CO và CO2. Do vậy, trong quá trình điện phân phải hạ thấp dần các điện cực anode vào thùng điện phân.
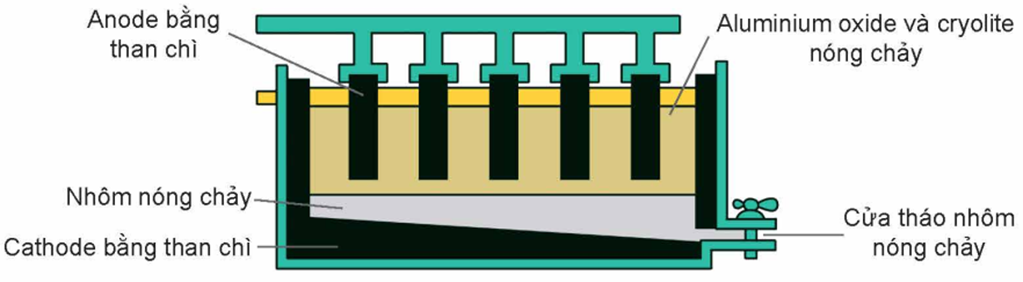
Sơ đồ thùng điện phân Al2O3 nóng chảy
6. Phương pháp nhiệt luyện
Nguyên tắc: Khử các oxide kim loại của kim loại hoạt động trung bình yếu như Zn, Fe, Sn, Pb, Cu,… ở nhiệt độ cao bằng các chất khử như C, CO,…
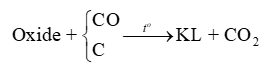
Ví dụ 1: Tách kẽm từ quặng zinc blende.
- Đốt quặng zinc blende: 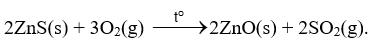
- Khử zinc oxide ở nhiệt độ cao bằng than cốc: 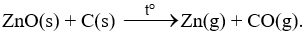
Ví dụ 2: Tách sắt từ quặng hematite.
ở nhiệt độ cao, sắt được tách ra khỏi iron(III) oxide bởi carbon monoxide:
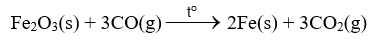
7. Phương pháp thuỷ luyện
Khử những ion kim loại trong dung dịch bằng kim loại có tính khử mạnh hơn như Fe, Zn,…
=> Cho kim loại mạnh (không tan trong nước) + dung dịch muối KL cần tách.
Tách Cu từ CuSO4 bởi Fe : Fe + CuSO4 \( \to \)FeSO4+Cu

 Đại cương về kim loại - Từ điển Hoá 12
Đại cương về kim loại - Từ điển Hoá 12 






Danh sách bình luận