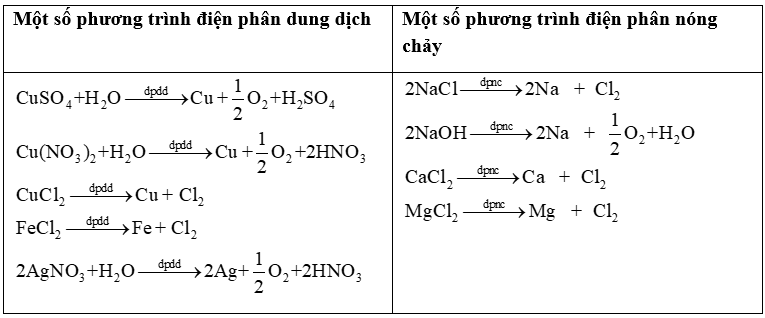
1. Các phản ứng xảy ra trong bình điện phân
2. Thí nghiệm 1: Điện phân dung dịch CuSO4
Chuẩn bị:
Hoá chất: dung dịch CuSO4 0,5 M.
Dụng cụ: nguồn điện một chiều (3 - 6 vôn), ống thuỷ tinh hình chữ U, hai điện cực than chì, dây dẫn, kẹp kim loại.
Tiến hành:
- Lắp thiết bị thí nghiệm điện phân dung dịch CuSO4 như Hình 16.2.
- Rót dung dịch CuSO4 0,5 M vào ống thuỷ tinh hình chữ U rồi nhúng hai điện cực than chì vào dung dịch.
- Nối hai điện cực than chì với hai cực của nguồn điện và tiến hành điện phân trong khoảng 5 phút.
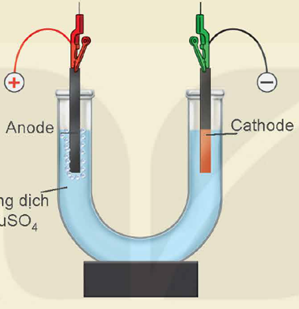
Sơ đồ thí nghiệm điện phân dung dịch CuSO4 với điện cực trơ
Quan sát hiện tượng xảy ra ở mỗi điện cực và giải thích.Viết phương trình xảy ra tại các cực và phương điện phân dung dịch.
Lời giải chi tiết
Hiện tượng: điện cực than chì ở cathode có kim loại đồng(màu đỏ) sinh ra bám vào.
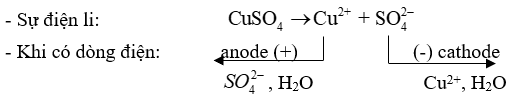
+ Ở cực dương (anode) sự oxi hoá H2O thành O2 : H2O \( \to \)\(\frac{1}{2}\)O2 + 2H+ + 2e
+ Ở cực âm (cathode) sự khử ion Cu2+ thành Cu: \({\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{ + 2e}} \to {\rm{Cu}}\)
+ Phương trình điện phân: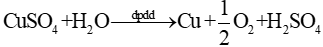
3. Thí nghiệm 2: Điện phân dung dịch NaCl với các điện cực trơ (graphite)
Điện phân dung dịch NaCl bão hoà với điện cực trơ (graphite)
a) Viết quá trình oxi hoá, quá trình khử xảy ra ở mỗi điện cực, biết sản phẩm của quá trình điện phân có khí Cl2 và H2.
b) Viết phương trình hoá học của phản ứng điện phân.
c) Trong quá trình điện phân, sản phẩm tạo thành ở hai điện cực khuếch tán vào nhau sẽ xảy ra phản ứng hoá học nào?
Lời giải chi tiết
a) 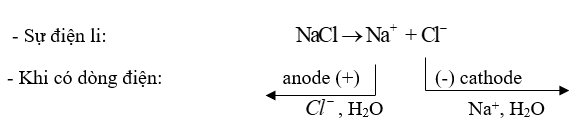
+ Ở cực dương (anode) sự oxi hoá \(C{l^ - }\) thành Cl2 : \({\rm{C}}{{\rm{l}}^ - } \to \frac{1}{2}{\rm{C}}{{\rm{l}}_{\rm{2}}}{\rm{ + e}}\)
+ Ở cực âm (cathode) sự khử nước thành H2: 2H2O + 2e \( \to \) H2 + 2\(OH_{}^ - \)
b) Phương trình điện phân: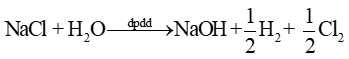
c) Cl2 ở anode sẽ tác dụng với NaOH ở cathode tạo nước Javel:
Cl2 + 2NaOH \( \to \)NaCl + NaClO + H2O
4. Thí nghiệm 3: Điện phân dung dịch NaCl (tự điều chế nước Javel để tẩy rửa)
Chuẩn bị:
Hoá chất: dung dịch NaCl bão hoà, cánh hoa màu hồng.
Dụng cụ: nguồn điện một chiều (3 - 6 vôn), cốc thuỷ tinh 100 mL, hai điện cực than chì, dây dẫn, kẹp kim Tiến hành:
- Lắp thiết bị thí nghiệm điện phân dung dịch NaCl với điện cực trơ như Hình 16.3.
loại.
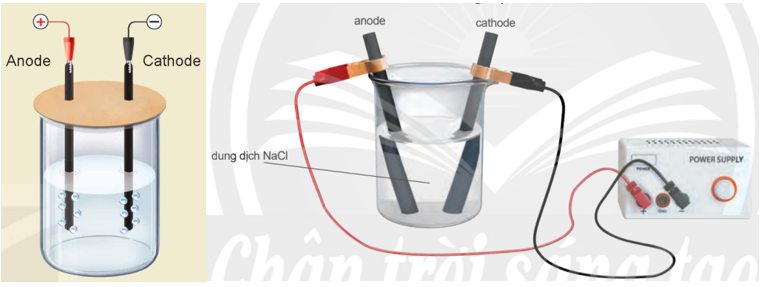
Thí nghiệm điện phân dung dịch NaCl với điện cực trơ
- Rót khoảng 80 mL dung dịch NaCl bão hoà vào cốc rồi nhúng hai điện cực than chì vào dung dịch.
- Nối hai điện cực than chì với hai cực của nguồn điện và tiến hành điện phân trong khoảng 5 phút.
- Cho một mẩu cánh hoa màu hồng vào cốc chứa khoảng 5 mL dung dịch sau điện phân.
Quan sát hiện tượng xảy ra và thực hiện các yêu cầu sau:
1. Giải thích hiện tượng quan sát được ở mỗi điện cực.
2. Giải thích khả năng tẩy màu của dung dịch sau điện phân.
3. Tại sao nên dùng nắp đậy trong quá trình điện phân?
Lời giải chi tiết
1. Cả hai cực đều sủi bọt khí.
* Ở cực dương (anode) sự oxi hoá \(C{l^ - }\) thành Cl2 : \({\rm{C}}{{\rm{l}}^ - } \to \frac{1}{2}{\rm{C}}{{\rm{l}}_{\rm{2}}}{\rm{ + e}}\)
* Ở cực âm (cathode) sự khử nước thành H2: 2H2O + 2e \( \to \) H2 + 2\(OH_{}^ - \)
2. Dung dịch sau điện phân là nước Javel nên có tính tẩy màu.
Cl2 ở anode sẽ tác dụng với NaOH ở cathode tạo nước Javel:
Cl2 + 2NaOH \( \to \)NaCl + NaClO + H2O
3. Nên dùng nắp đậy trong quá trình điện phân vì trong quá trình điện phân có sinh ra khí độc Cl2 ở anode.

 Pin điện và điện phân - Từ điển Hoá 12
Pin điện và điện phân - Từ điển Hoá 12 






Danh sách bình luận