1. Phản ứng xảy ra trong pin
Zn + Cu2+ \( \to \) Zn2+ + Cu
+ Vai trò cầu muối : vừa đóng kín mạch điện, vừa duy trì tính trung hoà điện của mỗi dung dịch.
+ Sức điện động của pin đo ở điều kiện chuẩn gọi là sức điện động chuẩn. Sức điện động chuẩn có thể xác định dựa vào thế điện cực chuẩn của các cặp oxi hoá - khử tương ứng:
\(E_{pin}^o\)= \(E_{( + )}^o\)(lớn) - \(E_{( - )}^o\)(nhỏ)
=> Sức điện động chuẩn của pin Galvani Zn-Cu được tính như sau:
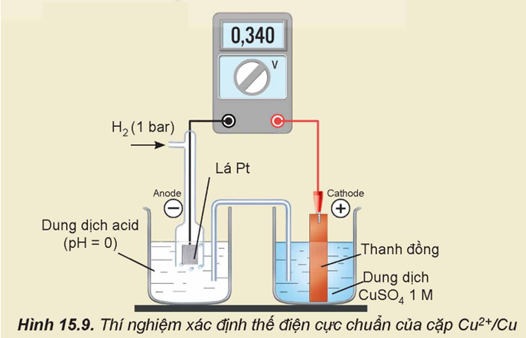
Epin = \(E_{C{u^{2 + }}/Cu}^o\)- \(E_{Z{n^{2 + }}/Zn}^o\)= 0,340 - (-0,762) = 1,102 (V).
2. Xác định bằng thực nghiệm
Thực nghiệm không đo được giá trị tuyệt đối của thế điện cực chuẩn nhưng đo được sự chênh lệch điện thế giữa hai điện cực ở điều kiện chuẩn.
Do vậy, bằng cách quy ước thế điện cực chuẩn của hydrogen bằng 0:
2H+ + 2e \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) H2 \(E_{2{H^ + }/{H_2}}^o\) = 0 V
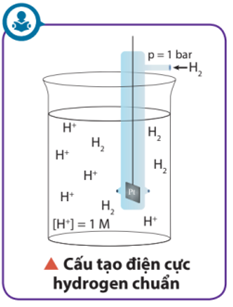
Từ đó, thế điện cực chuẩn của một điện cực khác được xác định bằng thực nghiệm trên cơ sở đo sự chênh lệch điện thế giữa điện cực đó với điện cực hydrogen chuẩn.
Ví dụ:
Zn2+ + 2e \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)Zn \(E_{Z{n^{2 + }}/Zn}^o\)= - 0,762 V
Cu2+ + 2e \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) Cu \(E_{C{u^{2 + }}/Cu}^o\)= + 0,340 V
3. Nguyên nhân xuất hiện thế điện cực
Khi cân bằng Mn+ + ne \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)M được thiết lập thì tại ranh giới giữa kim loại và dung dịch điện li xuất hiện hai lớp tích điện trái dấu rất gần nhau (lớp điện kép). Sự xuất hiện lớp điện kép tạo ra sự chênh lệch điện thế và điện thế chênh lệch này được gọi là thế điện cực của điện cực tương ứng.
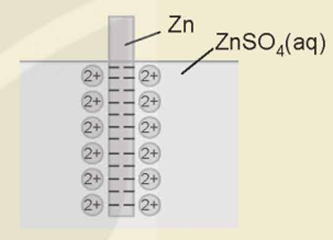
Mô hình lớp điện kép của điện cực kẽm
4. Cách xác định thế điện cực chuẩn
Thế điện cực chuẩn của một điện cực được xác định bằng cách thiết lập pin điện gồm điện cực (ở điều kiện chuẩn) cần xác định và điện cực hydrogen chuẩn.

 Pin điện và điện phân - Từ điển Hoá 12
Pin điện và điện phân - Từ điển Hoá 12 






Danh sách bình luận