Trắc nghiệm Bài 7. Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm - Hóa 10 Cánh diều
Đề bài
Các nguyên tố thuộc cùng một nhóm A có tính chất hóa học tương tự nhau, vì vỏ nguyên tử của các nguyên tố nhóm A có
-
A.
số electron như nhau
-
B.
số lớp electron như nhau
-
C.
số electron thuộc lớp ngoài cùng như nhau
-
D.
cùng số electron s hay p
Sự biến thiên tính chất của các nguyên tố thuộc chu kì sau được lặp lại tương tự như chu kì trước là do
-
A.
Sự lặp lại tính chất kim loại của các nguyên tố ở chu kì sau so với chu kì trước
-
B.
Sự lặp lại tính chất phi kim của các nguyên tố ở chu kì sau so với chu kì trước
-
C.
Sự lặp lại cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố ở chu kì sau so với chu kì trước (ở ba chu kì đầu)
-
D.
Sự lặp lại tính chất hóa học của các nguyên tố ở chu kì sau so với chu kì trước
Trong một chu kì, bán kính nguyên tử của các nguyên tố
-
A.
tăng theo chiều tăng dần của điện tích hạt nhân
-
B.
giảm theo chiều tăng dần của điện tích hạt nhân
-
C.
tăng theo chiều tăng của tính phi kim
-
D.
tăng dần từ trái sang phải
Dãy các nguyên tố nào dưới đây được sắp xếp theo chiều tăng dần tính kim loại?
-
A.
Li, Be, Na, K.
-
B.
Al, Na, K, Ca.
-
C.
Mg, K, Rb, Cs.
-
D.
Mg, Na, Rb, Sr.
Cho các phát biểu sau:
(I) F là phi kim mạnh nhất.
(II) Li là KL có độ âm điện lớn nhất
(III) He là nguyên tử có bán kính nhỏ nhất.
(IV) Be là KL yếu nhất trong nhóm IIA.
Số các phát biểu đúng là?
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Độ âm điện của các nguyên tố : Na, Mg, Al, Si. Xếp theo chiều tăng dần là:
-
A.
Na < Mg < Al < Si
-
B.
Si < Al < Mg < Na
-
C.
Si < Mg < Al < Na
-
D.
Al < Na < Si < Mg
Cấu hình electron hóa trị của nguyên tử các nguyên tố nhóm IIA trong bảng tuần hoàn đều là
-
A.
np2
-
B.
ns2
-
C.
ns2np2
-
D.
ns2np4
Nguyên tử của nguyên tố X có bán kính rất lớn. Phát biểu nào sau đây về X là đúng?
-
A.
Độ âm điện của X rất lớn và X là phi kim
-
B.
Độ âm điện của X rất nhỏ và X là phi kim
-
C.
Độ âm điện của X rất lớn và X là kim loại
-
D.
Độ âm điện của X rất nhỏ và X là kim loại
Các kim loại X, Y, Z có cấu hình electron nguyên tử lần lượt là: 1s22s22p63s1 , 1s22s22p63s2 , 1s22s22p63s23p1 Dãy gồm các kim loại xếp theo thứ tự tăng dần tính khử là
-
A.
X, Y, Z.
-
B.
Z, X, Y.
-
C.
Z, Y, X.
-
D.
Y, Z, X.
Dãy nguyên tố nào sau đây sắp xếp theo chiều tăng dần của bán kính nguyên tử ?
-
A.
Be, F, O, C, Mg.
-
B.
Mg, Be, C, O, F.
-
C.
F, O, C, Be, Mg.
-
D.
F, Be, C, Mg, O.
Cho các nguyên tố M (Z = 11), X (Z = 17), Y (Z = 9) và R (Z = 19). Độ âm điện của các nguyên tố tăng dần theo thứ tự
-
A.
M < X < Y < R.
-
B.
R < M < X < Y.
-
C.
Y < M < X < R.
-
D.
M < X < R < Y.
Nguyên tố gallium thuộc nhóm IIIA trong bảng tuần hoàn. Đâu là công thức hóa học của oxide, hydroxide ứng với hóa trị cao nhất của nguyên tố gallium?
-
A.
GaO, Ga(OH)3
-
B.
Ga2O3, Ga(OH)3
-
C.
Ga2O3, Ga(OH)2
-
D.
GaO, Ga(OH)2
Trong các chất dưới đây, chất nào có tính acid yếu nhất?
-
A.
H3PO4
-
B.
H2SO4
-
C.
HClO4
-
D.
H2SiO3
Sắp xếp các chất sau theo thứ tự tăng dần tính base.
-
A.
Mg(OH)2 < NaOH < Al(OH)3
-
B.
NaOH < Al(OH)3 < Mg(OH)2
-
C.
Al(OH)3 < Mg(OH)2 < NaOH
-
D.
NaOH < Mg(OH)2 < Al(OH)3
Oxide cao nhất của 1 nguyên tố R ứng với công thức RO2. Nguyên tố R đó là
-
A.
Mg
-
B.
N
-
C.
C
-
D.
P
Nguyên tố X có công thức oxit cao nhất là XO2., trong đó tỉ lệ khối lượng của X và O là 3/8. Công thức của XO2 là
-
A.
CO2
-
B.
NO2
-
C.
SO2
-
D.
SiO2
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng
-
A.
tăng dần
-
B.
giảm dần
-
C.
không đổi
-
D.
không theo quy tắc nào
Nguyên tố R có cấu hình electron: 1s22s22p3. Công thức hợp chất oxide ứng với hóa trị cao nhất của R và hydride (hợp chất của R với hydrogen) tương ứng là
-
A.
RO2 và RH4
-
B.
R2O5 và RH3
-
C.
RO3 và RH2
-
D.
R2O3 và RH3
Lời giải và đáp án
Các nguyên tố thuộc cùng một nhóm A có tính chất hóa học tương tự nhau, vì vỏ nguyên tử của các nguyên tố nhóm A có
-
A.
số electron như nhau
-
B.
số lớp electron như nhau
-
C.
số electron thuộc lớp ngoài cùng như nhau
-
D.
cùng số electron s hay p
Đáp án : C
Các nguyên tố thuộc cùng một nhóm A có tính chất hóa học tương tự nhau, vì vỏ nguyên tử của các nguyên tố nhóm A có số lớp electron lớp ngoài cùng là như nhau.
Sự biến thiên tính chất của các nguyên tố thuộc chu kì sau được lặp lại tương tự như chu kì trước là do
-
A.
Sự lặp lại tính chất kim loại của các nguyên tố ở chu kì sau so với chu kì trước
-
B.
Sự lặp lại tính chất phi kim của các nguyên tố ở chu kì sau so với chu kì trước
-
C.
Sự lặp lại cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố ở chu kì sau so với chu kì trước (ở ba chu kì đầu)
-
D.
Sự lặp lại tính chất hóa học của các nguyên tố ở chu kì sau so với chu kì trước
Đáp án : C
Sự lặp lại cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố ở chu kì sau so với chu kì trước vì có sự biến đổi electron lớp ngoài cùng của nguyên tử các nguyên tố chu kì sau giống như chu kì trước khi điện tích hạt nhân tăng dần.
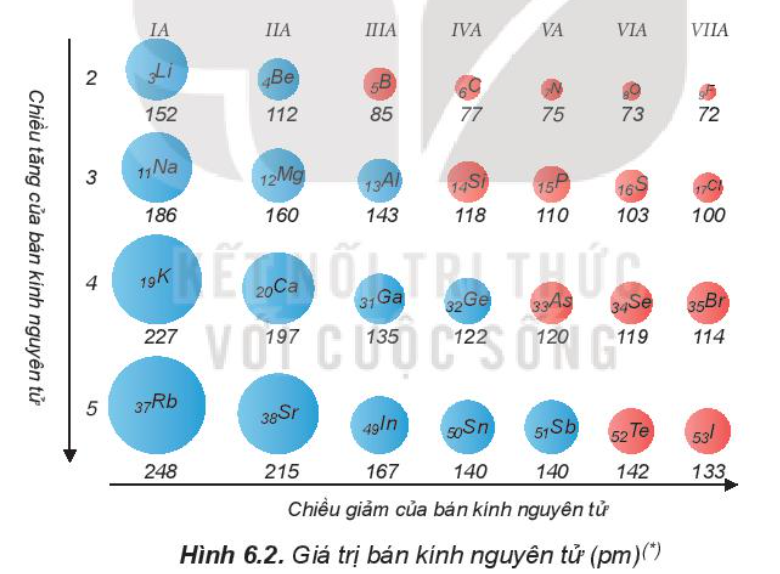
Trong một chu kì, bán kính nguyên tử của các nguyên tố
-
A.
tăng theo chiều tăng dần của điện tích hạt nhân
-
B.
giảm theo chiều tăng dần của điện tích hạt nhân
-
C.
tăng theo chiều tăng của tính phi kim
-
D.
tăng dần từ trái sang phải
Đáp án : B
Các nguyên tố trong cùng một chu kì từ trái qua phải, nguyên tử các nguyên tố có số lớp e như nhau nhưng điện tích hạt nhân tăng dần nên lực hút tính điện giữa hạt nhân và các electron lớp ngoài cùng tăng nên bán kính giảm.
=> Bán kính giảm dần theo chiều tăng dần của điện tích hạt nhân
Dãy các nguyên tố nào dưới đây được sắp xếp theo chiều tăng dần tính kim loại?
-
A.
Li, Be, Na, K.
-
B.
Al, Na, K, Ca.
-
C.
Mg, K, Rb, Cs.
-
D.
Mg, Na, Rb, Sr.
Đáp án : C
Trong 1 chu kì, tính kim loại giảm dần (đi từ trái qua phải).
Trong 1 nhóm, tính kim loại tăng dần (đi từ trên xuống dưới).
A. Sai vì tính kim loại của Li > Be
B. Sai vì tính kim loại của K > Ca
C. Đúng
D. Sai vì tính kim loại của Rb > Sr
Cho các phát biểu sau:
(I) F là phi kim mạnh nhất.
(II) Li là KL có độ âm điện lớn nhất
(III) He là nguyên tử có bán kính nhỏ nhất.
(IV) Be là KL yếu nhất trong nhóm IIA.
Số các phát biểu đúng là?
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : C
Dựa vào bảng tuần hoàn để rút ra kết luận
I. Đúng
II. Sai vì Be mới là kim loại có độ âm điện lớn nhất
III. Đúng
IV. Đúng
Độ âm điện của các nguyên tố : Na, Mg, Al, Si. Xếp theo chiều tăng dần là:
-
A.
Na < Mg < Al < Si
-
B.
Si < Al < Mg < Na
-
C.
Si < Mg < Al < Na
-
D.
Al < Na < Si < Mg
Đáp án : A
- Trong một chu kì, độ âm điện tăng dần (từ trái sang phải)
- Trong một nhóm, độ âm điện giảm dần (từ trên xuống dưới)
4 nguyên tố Na, Mg, Al, Si cùng thuộc chu kì 3.
Trong 1 chu kì, từ trái sang phải, độ âm điện tăng dần
=> Sắp xếp: Na < Mg < Al < Si
Cấu hình electron hóa trị của nguyên tử các nguyên tố nhóm IIA trong bảng tuần hoàn đều là
-
A.
np2
-
B.
ns2
-
C.
ns2np2
-
D.
ns2np4
Đáp án : B
Các nguyên tử nhóm IIA thì có 2 electron ở lớp ngoài cùng
Các nguyên tố nhóm IIA đều có 2 electron hóa trị ở lớp ngoài cùng
=> Cấu hình electron hóa trị của nguyên tử các nguyên tố nhóm IIA: ns2
Nguyên tử của nguyên tố X có bán kính rất lớn. Phát biểu nào sau đây về X là đúng?
-
A.
Độ âm điện của X rất lớn và X là phi kim
-
B.
Độ âm điện của X rất nhỏ và X là phi kim
-
C.
Độ âm điện của X rất lớn và X là kim loại
-
D.
Độ âm điện của X rất nhỏ và X là kim loại
Đáp án : D
Nguyên tố X có độ âm điện rất nhỏ và là kim loại
Các kim loại X, Y, Z có cấu hình electron nguyên tử lần lượt là: 1s22s22p63s1 , 1s22s22p63s2 , 1s22s22p63s23p1 Dãy gồm các kim loại xếp theo thứ tự tăng dần tính khử là
-
A.
X, Y, Z.
-
B.
Z, X, Y.
-
C.
Z, Y, X.
-
D.
Y, Z, X.
Đáp án : C
Sắp xếp các nguyên tố đã cho vào ô, nhóm, chu kì phù hợp. Sử dụng sự biến thiên tính chất tuần hoàn để so sánh
X thuộc ô số 11, chu kì 3, nhóm IA
Y thuộc ô số 12, chu kì 3 nhóm IIA
Z thuộc ô số 13 chu kì 3 nhóm IIIA
=> Các nguyên tố thuộc cùng một chu kì thì tính khử giảm theo chiều tăng ĐTHN
Dãy nguyên tố nào sau đây sắp xếp theo chiều tăng dần của bán kính nguyên tử ?
-
A.
Be, F, O, C, Mg.
-
B.
Mg, Be, C, O, F.
-
C.
F, O, C, Be, Mg.
-
D.
F, Be, C, Mg, O.
Đáp án : C
Be, Mg thuộc cùng nhóm IIA
Be, C, O, F thuộc cùng chu kì 2
Trong cùng 1 nhóm, bán kính nguyên tử tăng theo chiều tăng ĐTHN
Trong cùng một chu kì, bán kính giảm theo chiều tăng ĐTHN
=> Thứ tự tăng dần bán kính nguyên tử: F, O, C, Be, Mg
Cho các nguyên tố M (Z = 11), X (Z = 17), Y (Z = 9) và R (Z = 19). Độ âm điện của các nguyên tố tăng dần theo thứ tự
-
A.
M < X < Y < R.
-
B.
R < M < X < Y.
-
C.
Y < M < X < R.
-
D.
M < X < R < Y.
Đáp án : B
Viết cấu hình e của các nguyên tố, xác định vị trí các nguyên tố trong bảng tuần hoàn
M (Z = 11): 1s22s22p63s1
X (Z = 17): 1s22s22p63s23p5
Y (Z = 9): 1s22s22p5
R (Z = 19): 1s22s22p63s23p64s1
M, X thuộc cùng chu kì 3
Y thuộc cùng chu kì 2; R thuộc chu kì 4
M, R thuộc cùng nhóm IA
X, Y thuộc cùng nhóm IIVA
Trong cùng 1 nhóm, độ âm điện giảm theo chiều tăng ĐTHN
Trong cùng một chu kì, độ âm điện tăng theo chiều tăng ĐTHN
=> thứ tự tăng dần độ âm điện: R < M < X < Y
Nguyên tố gallium thuộc nhóm IIIA trong bảng tuần hoàn. Đâu là công thức hóa học của oxide, hydroxide ứng với hóa trị cao nhất của nguyên tố gallium?
-
A.
GaO, Ga(OH)3
-
B.
Ga2O3, Ga(OH)3
-
C.
Ga2O3, Ga(OH)2
-
D.
GaO, Ga(OH)2
Đáp án : B
- Công thức tổng quát của 1 nguyên tố ( có hóa trị cao nhất) trong hợp chất oxide có dạng: M2On – với n là hóa trị cao nhất của nguyên tố M.
- Công thức tổng quát của 1 nguyên tố ( có hóa trị cao nhất) trong hợp chất oxide có dạng: M(OH)n – với n là hóa trị cao nhất của nguyên tố M.
- Gallium thuộc thuộc nhóm IIIA => Ga có hóa trị III
=> Công thức hóa học của oxide là Ga2O3
- Công thức hóa học của hydroxide là Ga(OH)3
Trong các chất dưới đây, chất nào có tính acid yếu nhất?
-
A.
H3PO4
-
B.
H2SO4
-
C.
HClO4
-
D.
H2SiO3
Đáp án : D
Trong một chu kì theo chiều tăng dần điện tích hạt nhân, tính acid tăng dần
Xét các nguyên tố S, P, Cl và Si
4 nguyên tố đều thuộc chu kì 3, trong một chu kì theo chiều tăng dần điện tích hạt nhân, tính acid tăng dần
=> Tính acid: H2SiO3< H3PO4< H2SO4<HClO4
Sắp xếp các chất sau theo thứ tự tăng dần tính base.
-
A.
Mg(OH)2 < NaOH < Al(OH)3
-
B.
NaOH < Al(OH)3 < Mg(OH)2
-
C.
Al(OH)3 < Mg(OH)2 < NaOH
-
D.
NaOH < Mg(OH)2 < Al(OH)3
Đáp án : C
Trong cùng chu kì theo chiều điện tích hạt nhân tăng dần, tính base của oxide và hydroxide giảm dần
Al, Mg và Na cùng thuộc chu kì 3, trong cùng chu kì theo chiều điện tích hạt nhân tăng dần, tính base của oxide và hydroxide giảm dần
=> Al(OH)3 < Mg(OH)2 < NaOH
Oxide cao nhất của 1 nguyên tố R ứng với công thức RO2. Nguyên tố R đó là
-
A.
Mg
-
B.
N
-
C.
C
-
D.
P
Đáp án : C
Số thứ tự nhóm A bằng hóa trị cao nhất của nguyên tử nguyên tố đó trong hợp chất với oxi
Oxit cao nhất của 1 nguyên tố R ứng với công thức RO2 nên R có hóa trị cao nhất trong hợp chất với oxi là IV. Vậy R thuộc nhóm IVA
=> Là nguyên tố C
Nguyên tố X có công thức oxit cao nhất là XO2., trong đó tỉ lệ khối lượng của X và O là 3/8. Công thức của XO2 là
-
A.
CO2
-
B.
NO2
-
C.
SO2
-
D.
SiO2
Đáp án : A
Ta có X/16.2 = 3/8
=> X=12
Trong phân tử XO2:
MO = 16.2 = 32 (g/mol)
Mà tỉ lệ khối lượng của X và O là 3/8
=> MX/MO = MX/ 32 = 3/8
=> MX = 32 . 3/8 = 12 (g/mol)
=> Công thức là CO2
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng
-
A.
tăng dần
-
B.
giảm dần
-
C.
không đổi
-
D.
không theo quy tắc nào
Đáp án : B
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần
Nguyên tố R có cấu hình electron: 1s22s22p3. Công thức hợp chất oxide ứng với hóa trị cao nhất của R và hydride (hợp chất của R với hydrogen) tương ứng là
-
A.
RO2 và RH4
-
B.
R2O5 và RH3
-
C.
RO3 và RH2
-
D.
R2O3 và RH3
Đáp án : B
Nguyên tố R có 5 electron ở lớp ngoài cùng
=> Nguyên tố R thuộc nhóm VA
Nguyên tố R thuộc nhóm VA trong bảng tuần hoàn
=> Khi liên kết với O: R2O5
Khi liên kết với H: RH3
Luyện tập và củng cố kiến thức Bài 8. Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học Hóa 10 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 6. Cấu tạo của bảng tuần hoàn các nguyên tố hóa học Hóa 10 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
- Trắc nghiệm Bài 18. Hydrogen halide và hydrohalic acid - Hóa 10 Cánh diều
- Trắc nghiệm Bài 17. Nguyên tố và đơn chất halogen - Hóa 10 Cánh diều
- Trắc nghiệm Bài 16. Tốc độ phản ứng hóa học - Hóa 10 Cánh diều
- Trắc nghiệm Bài 15. Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học - Hóa 10 Cánh diều
- Trắc nghiệm Bài 14. Phản ứng hóa học và enthalpy - Hóa 10 Cánh diều










Danh sách bình luận