Trắc nghiệm Bài 10. Liên kết ion - Hóa 10 Cánh diều
Đề bài
Liên kết hóa học trong NaCl được hình thành là do
-
A.
hai hạt nhân nguyên tử hút electron rất mạnh.
-
B.
mỗi nguyên tử Na và Cl góp chung 1 electron.
-
C.
mỗi nguyên tử đó nhường hoặc thu electron để trở thành các ion trái dấu hút nhau.
-
D.
Na – e → Na+; Cl + e → Cl- ; Na+ + Cl- → NaCl.
Muối ăn ở thể rắn là:
-
A.
Các phân tử NaCl.
-
B.
Các ion Na+ và Cl-.
-
C.
Các tinh thể hình lập phương : các ion Na+ và Cl- được phân bố luân phiên đều đặn trên mỗi đỉnh.
-
D.
Các tinh thể hình lập phương : các ion Na+ và Cl- được phân bố luân phiên đều đặn thành từng phân tử riêng rẽ.
Các ion và nguyên tử 9F-, 10Ne, 11Na+ giống nhau về
-
A.
số khối.
-
B.
số electron.
-
C.
số proton.
-
D.
số nơtron.
Cấu hình electron nguyên tử X và Y lần lượt là 1s22s22p63s23p64s1 và 1s22s22p5 Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết.
-
A.
cho - nhận.
-
B.
kim loại.
-
C.
ion
-
D.
cộng hoá trị.
X thuộc chu kì 3, nhóm IA, Y thuộc chu kì 3, nhóm VIIA. Công thức phân tử và bản chất liên kết của hợp chất giữa X và Y là
-
A.
X2Y ; liên kết ion
-
B.
XY ; liên kết ion.
-
C.
XY2 ; liên kết cộng hoá trị.
-
D.
X2Y2 ; liên kết cộng hoá trị.
Hợp chất trong phân tử có liên kết ion là
-
A.
NH4Cl.
-
B.
NH3.
-
C.
HCl.
-
D.
H2O.
Khi phản ứng hoá học xảy ra giữa những nguyên tử có cấu hình electron ở trạng thái cơ bản là 1s22s1 và 1s22s22p5 thì liên kết này là
-
A.
liên kết cộng hoá trị có cực.
-
B.
liên kết cộng hoá trị không cực.
-
C.
liên kết ion.
-
D.
liên kết kim loại.
Liên kết ion là loại liên kết hóa học được hình thành nhờ lực hút tĩnh điện giữa các phần tử nào sau đây?
-
A.
cation và anion
-
B.
các anion
-
C.
cation và electron tự do
-
D.
electron và hạt nhân nguyên tử
Tính chất nào sau đây là tính chất của hợp chất ion?
-
A.
Hợp chất ion có nhiệt độ nóng chảy thấp
-
B.
Hợp chất ion có nhiệt độ nóng chảy cao
-
C.
Hợp chất ion dễ hóa lỏng
-
D.
Hợp chất ion có nhiệt độ sôi không xác định
Dãy gồm các phân tử đều có liên kết ion là
-
A.
Cl2, Br2, I2, HCl
-
B.
HCl, H2S, NaCl, N2O
-
C.
Na2O, KCl, BaCl2, Al2O3
-
D.
MgO, H2SO4, H3PO4, HCl
Lời giải và đáp án
Liên kết hóa học trong NaCl được hình thành là do
-
A.
hai hạt nhân nguyên tử hút electron rất mạnh.
-
B.
mỗi nguyên tử Na và Cl góp chung 1 electron.
-
C.
mỗi nguyên tử đó nhường hoặc thu electron để trở thành các ion trái dấu hút nhau.
-
D.
Na – e → Na+; Cl + e → Cl- ; Na+ + Cl- → NaCl.
Đáp án : D
Liên kết trong phân tử NaCl là liên kết ion, do vậy sự hình thành NaCl phải là sự cho nhận e của cation (Na+) và anion (Cl-)
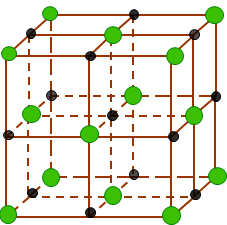
Muối ăn ở thể rắn là:
-
A.
Các phân tử NaCl.
-
B.
Các ion Na+ và Cl-.
-
C.
Các tinh thể hình lập phương : các ion Na+ và Cl- được phân bố luân phiên đều đặn trên mỗi đỉnh.
-
D.
Các tinh thể hình lập phương : các ion Na+ và Cl- được phân bố luân phiên đều đặn thành từng phân tử riêng rẽ.
Đáp án : C
Ở thể rắn, NaCl tồn tại dưới dạng tinh thể ion. Trong mạng tinh thể NaCl, các ion Na+ và Cl- được phân bố luân phiên đều đặn trên các đỉnh của các hình lập phương nhỏ.
Các ion và nguyên tử 9F-, 10Ne, 11Na+ giống nhau về
-
A.
số khối.
-
B.
số electron.
-
C.
số proton.
-
D.
số nơtron.
Đáp án : B
Viết cấu hình e, xác định số p, số e, số n, số khối của từng ion và nguyên tử
9F-: (Z = 9): 1s22s22p6 => Có 10e, 9p
10Ne: (Z = 10): 1s22s22p6 => Có 10e, 10p
11Na+ (Z = 11): 1s22s22p6 => Có 10e, 11p
Cấu hình electron nguyên tử X và Y lần lượt là 1s22s22p63s23p64s1 và 1s22s22p5 Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết.
-
A.
cho - nhận.
-
B.
kim loại.
-
C.
ion
-
D.
cộng hoá trị.
Đáp án : C
X thuộc nhóm IA là kim loại điển hình
Y thuộc nhóm VIIA là phi kim điển hình
=> liên kết giữa X và Y là liên kết ion
X thuộc chu kì 3, nhóm IA, Y thuộc chu kì 3, nhóm VIIA. Công thức phân tử và bản chất liên kết của hợp chất giữa X và Y là
-
A.
X2Y ; liên kết ion
-
B.
XY ; liên kết ion.
-
C.
XY2 ; liên kết cộng hoá trị.
-
D.
X2Y2 ; liên kết cộng hoá trị.
Đáp án : B
X thuộc nhóm IA là kim loại điển hình, điện tích 1+
Y thuộc nhóm VIIA là phi kim điển hình, điện tích 1-
=> CT là XY, liên kết giữa X và Y là liên kết ion
Hợp chất trong phân tử có liên kết ion là
-
A.
NH4Cl.
-
B.
NH3.
-
C.
HCl.
-
D.
H2O.
Đáp án : A
Liên kết ion là lực hút tĩnh điện giữa 2 ion mang điện tích trái dấu
NH4Cl được tạo thành từ ion NH4+ và Cl-
Khi phản ứng hoá học xảy ra giữa những nguyên tử có cấu hình electron ở trạng thái cơ bản là 1s22s1 và 1s22s22p5 thì liên kết này là
-
A.
liên kết cộng hoá trị có cực.
-
B.
liên kết cộng hoá trị không cực.
-
C.
liên kết ion.
-
D.
liên kết kim loại.
Đáp án : C
1s22s1 thuộc nhóm IA là kim loại điển hình
1s22s22p5 thuộc nhóm VIIA là phi kim điển hình
=> liên kết giữa 2 nguyên tố trên là liên kết ion
Liên kết ion là loại liên kết hóa học được hình thành nhờ lực hút tĩnh điện giữa các phần tử nào sau đây?
-
A.
cation và anion
-
B.
các anion
-
C.
cation và electron tự do
-
D.
electron và hạt nhân nguyên tử
Đáp án : A
Lực hút tĩnh điện giữa các ion mang điện tích trái dấu trong phân tử tạo ra liên kết
=> Lực hút tĩnh điện giữa cation và anion
Tính chất nào sau đây là tính chất của hợp chất ion?
-
A.
Hợp chất ion có nhiệt độ nóng chảy thấp
-
B.
Hợp chất ion có nhiệt độ nóng chảy cao
-
C.
Hợp chất ion dễ hóa lỏng
-
D.
Hợp chất ion có nhiệt độ sôi không xác định
Đáp án : B
Trong tinh thể ion, giữa các ion có lực hút tĩnh điện rất mạnh nên các hợp chất ion thường là chất rắn, khó nóng chảy
Dãy gồm các phân tử đều có liên kết ion là
-
A.
Cl2, Br2, I2, HCl
-
B.
HCl, H2S, NaCl, N2O
-
C.
Na2O, KCl, BaCl2, Al2O3
-
D.
MgO, H2SO4, H3PO4, HCl
Đáp án : C
Liên kết ion tạo bởi kim loại điển hình và phi kim điển hình
A. Sai vì cả 4 chất đều là liên kết cộng hóa trị
B. Sai vì HCl, H2S, N2O là liên kết cộng hóa trị
C. Đúng
D. Sai vì H2SO4, H3PO4, HCl là liên kết cộng hóa trị
Luyện tập và củng cố kiến thức Bài 11. Liên kết cộng hóa trị Hóa 10 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 12. Liên kết hydrogen và tương tác van der Waals Hóa 10 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
Luyện tập và củng cố kiến thức Bài 9. Quy tắc octet Hóa 10 với đầy đủ các dạng bài tập trắc nghiệm có đáp án và lời giải chi tiết
- Trắc nghiệm Bài 18. Hydrogen halide và hydrohalic acid - Hóa 10 Cánh diều
- Trắc nghiệm Bài 17. Nguyên tố và đơn chất halogen - Hóa 10 Cánh diều
- Trắc nghiệm Bài 16. Tốc độ phản ứng hóa học - Hóa 10 Cánh diều
- Trắc nghiệm Bài 15. Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học - Hóa 10 Cánh diều
- Trắc nghiệm Bài 14. Phản ứng hóa học và enthalpy - Hóa 10 Cánh diều










Danh sách bình luận