 Đề thi hóa 11, đề kiểm tra hóa 11 cánh diều có đáp án và lời giải chi tiết
Đề thi hóa 11, đề kiểm tra hóa 11 cánh diều có đáp án và lời giải chi tiết
 Đề thi giữa kì 1 Hóa 11 - Chân trời sáng tạo
Đề thi giữa kì 1 Hóa 11 - Chân trời sáng tạo Tổng hợp 7 đề thi giữa kì 1 Hóa 11 Chân trời sáng tạo có đáp án
Tải vềCâu 1: Cho các phát biểu sau: (1) Phản ứng thuận nghịch là phản ứng xảy ra theo 2 chiều ngược nhau. (2) Phản ứng bất thuận nghịch là phản ứng xảy ra theo 1 chiều xác định
Đề 1
Câu 1: Cho các phát biểu sau:
(1) Phản ứng thuận nghịch là phản ứng xảy ra theo 2 chiều ngược nhau.
(2) Phản ứng bất thuận nghịch là phản ứng xảy ra theo 1 chiều xác định
(3) Cân bằng hóa học là trạng thái mà phản ứng đã xảy ra hoàn toàn.
(4) Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, lượng các chất sẽ không đổi.
(5) Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, phản ứng dừng lại.
Các phát biểu sai là:
A. 2,3. B. 3,4. C. 3,5. D. 4,5.
Câu 2: Hằng số cân bằng K của phản ứng phụ thuộc vào
A. áp suất.
B. bản chất của các chất trong cân bằng và nhiệt độ.
C. nồng độ.
D. phân tử khối
Câu 3: Cho cân bằng sau: 2SO2(k) + O2(k) ⇄ 2SO3(k); ∆H = -192,5kJ
Để tăng hiệu suất của quá trình sản xuất SO3, người ta cần
A. giảm nhiệt độ của hệ phản ứng, dùng xúc tác.
B. giữ phản ứng ở nhiệt độ thường, giảm áp suất.
C. tăng nhiệt độ của hệ phản ứng, dùng xúc tác.
D. giảm nhiệt độ và tăng áp suất của hệ phản ứng.
Câu 4: Dãy chất nào dưới đây chỉ gồm những chất điện li mạnh?
A. HNO3, Cu(NO3)2, H3PO4, Ca(NO3)2. B. CaCl2, CuSO4, H2S, HNO3.
C. H2SO4, NaCl, KNO3, Ba(NO3)2. D. KCl, H2SO4, HNO2, MgCl2.
Câu 5: Theo thuyết Bronsted – Lowry chất nào sau đây là base?
A. Al3+ B. Cl- C. H3PO4. D. CO32-
Câu 6: Giá trị pH của dung dịch HCl 0,001M là
A. 3. B. 11. C. 12. D. 2.
Câu 7: Nạp đầy khi amoniac vào bình thuỷ tinh trong suốt, đậy bình NH3 bằng nút cao su có ống thuỷ tinh vuốt nhọn xuyên qua. Nhúng đầu ống thuỷ tinh vào một chậu thuỷ tinh chứa nước có pha thêm dung dịch phenolphthalein. Một lát sau, nước trong chậu phun vào bình thành những tia có màu hồng. Thí nghiệm này chứng tỏ được
A. NH3 tan nhiều trong nước.
B. NH3 là chất khí.
C. NH3 có tính bazơ và tan nhiều trong nước.
D. NH3 có mùi khai.
Câu 8: Trong phản ứng giữa khí ammonia và khí hydrogen chloride thành ammonium chloride ở dạng khí trắng, ammonia đóng vai trò là:
A. Acid. B. Base. C. Chất oxi hóa. D. Chất khử.
Câu 9: Trong tự nhiên, nguyên tố nitrogen tồn tại chủ yếu ở dạng đồng vị nào sau đây?
A. 14N. B. 13N. C. 15N. D. 12N.
Câu 10: Áp suất riêng phần của khí nitrogen trong khí quyển là
A. 0,21 bar. B. 0,01 bar. C. 0,78 bar. D. 0,28 bar.
Câu 11: Cho sơ đồ chuyển hoá nitrogen trong khí quyển thành phân đạm:
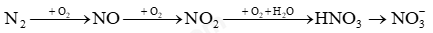
Số phản ứng thuộc loại oxi hoá-khử trong sơ đồ là
A. 3. B. 1. C. 4. D. 2.
Câu 12: Quá trình đốt cháy hỗn hợp hơi nhiên liệu và không khí trong động cơ khi đánh tia lửa điện sinh ra khí NO, một tác nhân gây ô nhiễm không khí. Tên gọi của NO là:
A. Ammonia. B. Nitrogen dioxide. C. Nitrogen monoxide. D. Nitrogen.
Câu 13: Cho các nhận định sau về cấu tạo phân tử nitric acid:
(a) Liên kết O – H phân cực về oxygen.
(b) Nguyên tử N có số oxi hóa là +5.
(c) Nguyên tử N có hóa trị bằng 4.
(d) Liên kết cho – nhận N → O kém bền.
Số nhận định đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 14: Cho các nhận định sau về tính chất hóa học của nitric acid: (1) có tính acid mạnh; (2) có tính acid yếu; (3) có tính oxi hóa mạnh; (4) có tính khử mạnh.
Số nhận định đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 15: Cho sơ đồ phản ứng : C + HNO3 (đ) \( \to \) CO2 + NO2 + H2O. Tổng hệ số cân bằng của phản ứng là :
A. 12 B. 10 C. 11 D. 13
II. Tự luận
Câu 1 (2 điểm): Hỗn hợp X gồm N2 và H2 có tỉ lệ mol tương ứng là 1 : 4. Nung nóng X trong bình kín ở nhiệt độ khoảng 450 °C có bột Fe xúc tác, thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 4. Tính hiệu suất của phản ứng tổng hợp NH3.
Câu 2: (2 điểm) Xét cân bằng của dung dịch NH3 0,1 M ở 25 °C:
.\({\rm{N}}{{\rm{H}}_{\rm{3}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{NH}}_4^ + + {\rm{O}}{{\rm{H}}^ - }{\rm{ }}{{\rm{K}}_{\rm{C}}}{\rm{ = 1,74}}{\rm{.1}}{{\rm{0}}^{ - 5}}\).
Bỏ qua sự phân li của nước. Xác định giá trị pH của dung dịch trên.
---Hết---
Đề 2
I. TRẮC NGHIỆM (6 điểm)
Câu 1: Một phản ứng thuận nghịch đạt đến trạng thái cân bằng khi
A. tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch.
B. nồng độ của các chất tham gia phản ứng bằng nồng độ của các chất sản phẩm.
C. phản ứng thuận đã kết thúc.
D. phản ứng nghịch đã kết thúc.
Câu 2: Cho cân bằng sau: \(2S{O_2}(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_3}(g)\) \(\Delta H = - 192,5kJ\)
Để tăng hiệu suất của quá trình sản xuất SO3, người ta cần
A. giảm nhiệt độ của hệ phản ứng, dùng xúc tác
B. giữ phản ứng ở nhiệt độ thường, giảm áp suất
C. tăng nhiệt độ của hệ phản ứng, dùng xúc tác
D. giảm nhiệt độ và tăng áp suất của hệ phản ứng
Câu 3: Qúa trình tổng hợp NH3 từ H2 và N2 (với xúc tác Al2O3) có thể được biểu diễn bằng cân bằng hóa học sau: \({N_2} + 3{H_2} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_3};\Delta H < 0\)
Người ta thử các cách sau:
(1) tăng áp suất của khí N2 khi cho vào hệ
(2) tăng áp suất chung của hệ
(3) giảm nhiệt độ của hệ
(4) không dùng chất xúc tác nữa
(5) hóa lỏng NH3 và đưa ra khỏi hệ
Số cách có thể làm cân bằng chuyển dịch theo chiều thuận là
A. 4 B. 3 C. 2 D. 1
Câu 4: Phát biểu nào sau đây đúng khi nói về sự điện li?
A. Sự điện li là quá trình phân li một chất trong nước thành ion
B. Sự điện li là quá trình hòa tan một chất vào nước tạo thành dung dịch
C. Sự điện li là quá trình phân li một chất dưới tác dụng của dòng điện
D. Sự điện li thực chất là quá trình oxi hóa – khử
Câu 5: Chất nào sau đây không phải chất điện li?
A. KOH B. H2S C. HNO3 D. C2H5OH
Câu 6: Cho phương trình điện li: \(N{H_3} + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} NH_4^ + + O{H^ - }\). Trong phản ứng nghịch, theo thuyết Bronsted – Lowry chất nào là acid?
A. CH3COOH B. H2O C. NH4+ D. OH-
Câu 7: Dung dịch nào sau đây có pH > 7?
A. NaCl B. NaOH C. HNO3 D. H2SO4
Câu 8: Số hiệu nguyên tử của nitrogen là
A. 6 B. 7 C. 8 D. 9
Câu 9: Ứng dụng nào sau đây không phải của nitrogen?
A. Tạo khí quyển trơ (giảm nguy cơ cháy nổ)
B. Tổng hợp ammonia
C. Tác nhân làm lạnh (bảo quản thực phẩm, mẫu vật sinh học…)
D. Sản xuất phân lân
Câu 10: N2 thể hiện tính khử trong phản ứng với
A. H2 B. O2 C. Li D. Mg
Câu 11: Trong ammonia, nitrogen có số oxi hóa là
A. +3 B. -3 C. +4 D. +5
Câu 12: Phát biểu không đúng là
A. Trong điều kiện thường, NH3 là khí không màu, mùi khai
B. Khí NH3 nhẹ hơn không khí
C. Phân tử NH3 chứa các liên kết cộng hóa trị không phân cực
D. Khí NH3 tan nhiều trong nước
Câu 13: Có các mệnh đề sau
(1) Các muối nitrate đều tan trong nước và đều là chất điện li mạnh.
(2) Ion NO3- có tính oxi hóa trong môi trường acid.
(3) Khi nhiệt phân muối nitrate rắn ta đều thu được khí NO2.
(4) Hầu hết muối nitrate đều bền nhiệt.
Trong các mệnh đề trên, những mệnh đề đúng là
A. (1) và (3).
B. (2) và (4).
C. (2) và (3).
D. (1) và (2).
Câu 14: Cho Cu tác dụng với dung dịch hỗn hợp gồm NaNO3 và H2SO4 loãng giải phóng khí X (không màu, dễ hóa nâu trong không khí). Khí X là
A. NO B. NO2 C. N2O D. NH3
Câu 15: Phú dưỡng là hiện tượng
A. Ao, hồ dư quá nhiều các nguyên tố dinh dưỡng
B. Ao, hồ thiếu quá nhiều các nguyên tố dinh dưỡng
C. Ao, hồ dư quá nhiều các nguyên tố kim loại nặng
D. Ao, hồ thiếu quá nhiều các nguyên tố kim loại nặng
II. TỰ LUẬN
Câu 1: Cho phản ứng: \({H_2}(g) + {I_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2HI(g)\)
Ở nhiệt độ 4300C hằng số cân bằng KC của phản ứng trên bằng 53,96. Đun nóng một bình kín dung tích không đổi 10 lít chứa 4,0 gam H2 và 406,4 gam I2. Khi hệ phản ứng đạt trạng thái cân bằng ở 4300C, nồng độ của HI là.
Câu 2: Trộn 200 ml dung dịch gồm HCl 0,1M vá H2SO4 0,15M với 300 ml dung dịch Ba(OH)2 nồng độ aM, thu được m gam kết tủa và 500 ml dung dịch có pH = 1.
Đề 3
I. TRẮC NGHIỆM (6 điểm)
Câu 1: Với một phản ứng thuận nghịch bất kì tại trạng thái cân bằng, phát biểu nào sau đây là sai?
A. Tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch
B. Nồng độ của tất cả các chất trong hỗn hợp phản ứng là không đổi
C. Nồng độ mol của chất phản ứng luôn bằng nồng độ mol của chất sản phẩm
D. Phản ứng thuận và phản ứng nghịch vẫn diễn ra
Câu 2: Cho các cân bằng sau:
\(\begin{array}{l}(1)2HI(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H_2}(g) + {I_2}(g)\\(2)CaC{O_3}(s) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} CaO(s) + C{O_2}(s)\\(3)FeO(s) + CO(s) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} Fe(s) + C{O_2}(s)\\(4)2S{O_2}(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_3}(g)\end{array}\)
Khi giảm áp suất của hệ, số cân bằng bị chuyển dịch theo chiều nghịch là
A. 4 B. 3 C. 2 D. 1
Câu 3: Cho cân bằng (trong bình kín) sau:
Cho các yếu tố ảnh hưởng đến cân bằng: (1) tăng nhiệt độ; (2) thêm hơi nước; (3) thêm H2; (4) tăng áp suất chung của hệ; (5) dùng chất xúc tác
Dãy gồm các yếu tố làm thay đổi cân bằng của hệ là
A. (1), (4), (5) B. (1), (2), (3) C. (2), (3), (4) D. (1), (2), (4)
Câu 4: Dãy nào dưới đây chỉ gồm chất điện li mạnh?
A. HBr, Na2S, Mg(OH)2, Na2CO3 B. HCl, H3PO4, Fe(NO3)3, NaOH
C. HNO3, CH3COOH, BaCl2, KOH D. H2SO4, MgCl2, Al2(SO4)3, Ba(OH)2
Câu 5: Theo thuyết Bronsted – Lowry chất nào sau đây là lưỡng tính?
A. H2O B. NH3 C. NaOH D. Al
Câu 6: Theo thuyết Bronsted – Lowry, dãy chất nào sau đây là acid?
A. Fe2+, HCl, PO43- B. CO32-, SO32-, PO43-
C. Na+, H+, Al3+ D. Fe3+, Ag+, H2CO3
Câu 7: Ở nhiệt độ thường, nitrogen kém hoạt động hóa học là do
A. nitrogen có bán kính nguyên tử nhỏ B. nitrogen có độ âm điện lớn nhất trong nhóm
C. phân tử nitrogen có liên kết ba khá bền D. phân tử nitrogen không phân cực
Câu 8: Trong hợp chất nitrogen có các mức oxi hóa (đặc trưng) nào sau đây?
A. -3, +3, +5 B. -3, 0, +3, +5
C. -3, +1, +2, +3, +4, +5 D. -3, 0, +1, +2, +3, +4, +5
Câu 9: Amonia tan nhiều trong nước do
A. NH3 nhẹ hơn không khí
B. NH3 là phân tử không phân cực
C. Phân tử NH3 phân cực, có khả năng tạo liên kết hydrogen với nước
D. NH3 tồn tại ở trạng thái khí
Câu 10: Tính base của NH3 do
A. trên N còn cặp electron tự do B. phân tử có 3 liên kết cộng hóa trị phân cực
B. NH3 tan được nhiều trong nước D. NH3 tác dụng với nước tạo NH4OH
Câu 11: Để xác định nồng độ của một dung dịch HCl, người ta đã tiến hành chuẩn độ bằng dung dịch
NaOH 0,1 M. Để chuẩn độ 10 mL dung dịch HCl này cần 15 mL dung dịch NaOH. Xác định nồng độ
của dung dịch HCl trên.
A. 0,1M B. 0,05M C. 0,15M D. 0,2M
Câu 12: Một dung dịch có PH = 11,7. Nồng độ ion H+ của dung dịch là
A. 2,3M B. 11,7M C. 5,0.10-3M D. 2,0.10-12M
Câu 13: Công thức của khí nitrogen monoxide là
A. NO
B. N2O
C. NO2
D. N2
Câu 14: Mưa acid là hiện tượng
A. Nước mưa có pH > 7
B. Nước mưa có pH = 14
C. Nước mưa có ph = 1
D. Nước mưa có ph < 5,6
Câu 15: Tính chất hóa học của NH3 là
A. tính base mạnh, tính khử. B. tính base yếu, tính oxi hóa.
C. tính khử mạnh, tính base yếu. D. tính base mạnh, tính oxi hóa
II. TỰ LUẬN
Câu 1: Trộn V1 lít dung dịch H2SO4 có pH = 3 với 2 lít dung dịch NaOH có pH = 12, thu được dung dịch mới có pH = 4. Tỉ số V1 : V2 có giá trị là:
Câu 2: Xét cân bằng trong dung dịch gồm NH4Cl 0,10 M và NH3 0,05 M ở 25 oC
\({\rm{N}}{{\rm{H}}_{\rm{3}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{NH}}_4^ + + {\rm{O}}{{\rm{H}}^ - }{\rm{ }}{{\rm{K}}_{\rm{C}}}{\rm{ = 1,74}}{\rm{.1}}{{\rm{0}}^{ - 5}}\)
Bỏ qua sự phân li của nước. Xác định giá trị pH của dung dịch trên.
Đề 4
Câu 1: Sự chuyển dịch cân bằng là
A. phản ứng trực tiếp theo chiều nghịch.
B. phản ứng trực tiếp theo chiều thuận.
C. chuyển từ trạng thái cân bằng này sang trạng thái cân bằng khác.
D. phản ứng tiếp tục xảy ra cả chiều thuận và chiều nghịch
Câu 2: Xét các hệ cân bằng sau đây trong một bình kín:
(1) 2NaHCO3 (r) ⇄ Na2CO3 (r) + H2O (k) + CO2 (k);
(2) CO2 (k) + CaO (r) ⇄ CaCO3 (r);
(3) C (r) + CO2 (k) ⇄ 2CO (k);
(4) CO (k) + H2O (k) ⇄ CO2 (k) + H2 (k).
Khi thêm CO2 vào hệ thì có bao nhiêu cân bằng chuyển dịch theo chiều thuận?
A. 1. B. 3. C. 2. D. 4
Câu 3: Cho cân bằng hóa học sau: 2NO2 (khí màu nâu) ⇄ N2O4 (khí không màu) (∆H <0)
Cho khí NO2 vào một ống nghiệm đậy nắp kín ở 300C. Đợi một thời gian để các khí trong ống đạt trạng thái cân bằng. Sau đó, đem ngâm ống nghiệm này trong chậu nước đá 00C, thì sẽ có hiện tượng gì kể từ lúc đem ngâm nước đá?
A. Màu nâu trong ống không đổi.
B. Màu nâu trong ống nhạt dần.
C. Khi tăng nhiệt độ cân bằng chuyển dịch theo chiều thu nhiệt, nên màu nâu trong ống không đổi.
D. Màu nâu trong ống đậm dần.
Câu 4: Cho các chất: Cho các chất: NaOH, HCl, HNO3, NaNO3, saccharose (C12H22O11), ethanol
(C2H5OH), glycerol (C3H5(OH)3), KAl(SO4)2.12H2O. Trong các chất trên, có bao nhiêu chất tạo được
dung dịch dẫn điện?
A. 5 B. 3 C. 6 D. 2
Câu 5: Dung dịch chất nào sau đây làm quỳ tím chuyển thành màu xanh?
A. HCl. B. CH3COONa. C. KNO3. D. C2H5OH.
Câu 6: Cho phương trình: \(C{H_3}COOH + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_4}^ + + O{H^ - }\)
Trong phản ứng nghịch, theo thuyết Bronsted – Lowry chất nào là acid?
A. CH3COOH. B. H2O. C. CH3COO- D. H3O+
Câu 7: Để xác định nồng độ của một dung dịch NaOH, người ta đã tiến hành chuẩn độ bằng dung dịch HCl 0,1 M. Để chuẩn độ 10 mL dung dịch NaOH này cần 12 mL dung dịch HCl. Nồng độ của dung dịch NaOH trên là
A. 0,1. B. 1,2. C. 0,12. D. 0,012.
Câu 8: Phân tử nitrogen có cấu tạo là
A. N=N B. N≡N C. N-N D. N⟶N
Câu 9: Cho các phát biểu về nitrogen như sau:
(a) Trong hợp chất, các số oxi hóa thường gặp của nguyên tử nitrogen là -3, 0, +4, +5.
(b) Khí nitrogen kém hoạt động hóa học ở nhiệt độ thường.
(c) Nitrogen là phi kim tương đối hoạt động ở nhiệt độ cao.
(d) Trong tự nhiên, nitrogen chỉ tồn tại ở dạng đơn chất.
(e) Nitrogen là chất khí, không màu, tan ít trong nước.
Số phát biểu đúng là
A. 3. B. 2. C. 5. D. 4.
Câu 10: Phản ứng nào sau đây nitrogen thể hiện tính khử?
A. N2 + O2 ⟶ 2NO B. N2 + 3H2 ⇄ NH3
C. N2 + 6Li ⟶ 2Li3N D. N2 + 3Ca ⟶ Ca3N2
Câu 11: Khi nói về muối ammonium, phát biểu không đúng là
A. Muối ammonium dễ tan trong nước. B. Muối ammonium trong nước là chất điện li mạnh.
C. Muối ammonium kém bền với nhiệt. D. Dung dịch muối ammonium có tính base.
Câu 12: Dung dịch ammonia trong nước có chứa thành phần chất tan là
A. NH4 + , NH3. B. NH4 + , NH3, H+ . C. NH4 + , OH- . D. NH4 + , NH3, OH- .
Câu 13: Nitric acid tinh khiết
A. Là chất lỏng màu vàng, bốc khói mạnh trong không khí ẩm
B. Là chất lỏng không màu, bốc khói mạnh trong không khí ẩm
C. Là chất lỏng màu lục nhạt, bốc khói mạnh trong không khí ẩm
D. Là chất lỏng nâu đỏ, bốc khói mạnh trong không khí
Câu 14: Ứng dụng của nitric acid là
A. Bảo quản thực phẩm
B. Làm chất làm lạnh
C. Kích thích trái cây nhanh chín
D. Chế tạo thuốc nổ
Câu 15: Cho phương trình sau: Fe + HNO3 \( \to \) Fe(NO3)3 + NO2 + H2O. Tổng hệ số cân bằng của phản ứng trên là
A. 10 B. 12 C. 14 D. 16
II. TỰ LUẬN
Câu 1: Vỏ trứng có chứa calcium ở dạng CaCO3. Để xác định hàm lượng CaCO3 trong vỏ trứng, trong phòng thí nghiệm người ta có thể làm như sau:
Lấy 1,0 g vỏ trứng khô, đã được làm sạch, hòa tan hoàn toàn trong 50 mL dung dịch HCl 0,4 M. Lọc dung dịch sau phản ứng thu được 50 mL dung dịch A. Lấy 10 mL dung dịch A chuẩn độ với dung dịch NaOH 0,1 M thấy hết 5,6 mL. Xác định hàm lượng cacium trong vỏ trứng (giả thiết các tạp chất khác trong vỏ trứng không phản ứng với HCl).
Câu 2: Cho phương trình hoá học của phản ứng:
N2O4(l) + 2N2H4(l) → 3N2(g) + 4H2O(g)
Biết enthalpy tạo thành chuẩn của các chất được trình bày trong bảng sau:
|
Chất |
N2O4(l) |
N2H4(l) |
H2O(g) |
|
\({\Delta _{\rm{f}}}{\rm{H}}_{298}^0\)(kJ/mol) |
-19,56 |
50,63 |
-241,82 |
a) Tính nhiệt đốt cháy 1 kg hỗn hợp lỏng gồm N2O4 và N2H4.
b) Tại sao hỗn hợp lỏng (N2O4 và N2H4) được dùng làm nhiên liệu tên lửa?
Đề 5
Câu 1: Điều nào sau đây là đúng khi nói về nồng độ của các sản phẩm, đối với một phản ứng hóa học đã ở trạng thái cân bằng, giả sử không có sự phá vỡ trạng thái cân bằng?
A. Nồng độ của các sản phẩm sẽ không thay đổi vì không còn chất phản ứng
B. Nồng độ của sản phẩm sẽ không thay đổi vì chất tham gia phản ứng đã hết
C. Nồng độ của các sản phẩm sẽ không thay đổi vì tốc độ phản ứng thuận và nghịch bằng nhau
D. Nồng độ của các sản phẩm sẽ thay đổi liên tục do tính thuận nghịch
Câu 2: Hằng số cân bằng KC của phản ứng chỉ phụ thuộc vào:
A. Nhiệt độ
B. Xúc tác
C. Nồng độ
D. Áp suất
Câu 3: Cho hai phản ứng sau:
(1) \({H_2}(g) + {I_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2HI(g)\)
(2) \(HI(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \frac{1}{2}{H_2}(g) + \frac{1}{2}{I_2}(g)\)
Biết hằng số cân bằng của (1) bằng 6. Giá trị hằng số cân bằng KC2 của phản ứng: \(HI(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \frac{1}{2}{H_2}(g) + \frac{1}{2}{I_2}(g)\)
A. 0,408 B. 2,454 C. 0,167 D. 36
Câu 4: Trong dung dịch acid acetic (bỏ qua sự phân li của H2O) có những phần tử nào?
A. CH3OO-, H+ B. CH3COOH, H2O
C. CH3COOH, H+, H2O D. CH3COO-, H+, H2O, CH3COOH
Câu 5: Ở trạng thái lỏng nguyên chất, phân tử chất nào sau đây tạo được liên kết hydrogen với nhau?
A. Nitrogen B. Ammonnia C. Oxygen D. Hydrogen
Câu 6: Mưa acid là hiện tượng nước mưa có pH thấp hơn 5,6 (giá trị pH của khí carbon dioxide bão hòa trong nước). Hai tác nhân chính gây mưa acid là
A. Cl2, HCl B. N2, NH3 C. SO2, NOx D. S, H2S
Câu 7: Cho dãy các chất: KAl(SO4)2.12H2O, C2H5OH, C12H22O11 (saccarozơ), CH3COOH, Ca(OH)2, CH3COONH4. Số chất thuộc loại chất điện li là
A. 2 B. 3 C. 4 D. 5
Câu 8: Trộn 200ml dung dịch H2SO4 0,05M với 300ml dung dịch HCl 0,1M thu được dung dịch Y. pH của dung dịch Y là:
A. 1,3 B. 4 C. 1 D. 3
Câu 9: Chuẩn độ 10ml dung dịch H2SO4 chưa biết nồng độ đã dùng hết 20ml dung dịch KOH 0,1M. Nồng độ mol của dung dịch H2SO4 là:
A. 0,2M B. 0,05M C. 0,1M D. 0,15M
Câu 10: Dung dịch ammonia trong nước có chứa thành phần chất tan là
A. NH4 + , NH3.
B. NH4 + , NH3, H+ .
C. NH4 + , OH- .
D. NH4 + , NH3, OH-
Câu 11: Khí cười (laughing gas) thực chất là một chất kích thích được bán tại các quán bar ở một số quốc gia. Người ta bơm khí này vào một trái bóng bay, gọi là bóng cười và cung cấp cho các khách có yêu cầu. Giới Y khoa thế giới đã cảnh báo rằng khí cười ảnh hưởng trực tiếp tới hệ tim mạch, hệ thần kinh mà hậu quả xấu nếu là lạm dụng sẽ dẫn tới trầm cảm hoặc thiệt mạng. Khí cười có công thức là
A. NO2. B. CO. C. NO. D. N2O.
Câu 12: Cho các phân tử và ion sau: \(HI,C{H_3}COO - ,{H_2}PO_4^ - ,PO_4^{3 - },N{H_3},{S^{2 - }},HPO_4^{2 - }\)
Hãy cho biết có bao nhiêu phân tử, ion lưỡng tính theo thuyết Bronsted – Lowry
A. 4 B. 3 C. 2 D. 1
Câu 13: Nitrogen thể hiện tính khử trong phản ứng nào?
A. \({N_2} + 3{H_2} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_3}\)
B. \({N_2} + {O_2} \to 2NO\)
C. \({N_2} + 3Mg \to M{g_3}{N_2}\)
D. \({N_2} + 6Li \to 2L{i_3}N\)
Câu 14: Trong phòng thí nghiệm, người ta có thể phân biệt muối ammonium với một số muối khác bằng cách cho nó tác dụng với dung dịch base. Hiện tượng nào xảy ra?
A. Thoát ra một chất khí màu lục nhạt, làm xanh giấy quỳ tím ẩm.
B. Thoát ra một chất khí không màu, làm xanh giấy quỳ tím ẩm.
C. Thoát ra một chất khí màu nâu đỏ, làm xanh giấy quỳ tím ẩm.
D. Thoát ra một chất khí không màu, làm hồng giấy quỳ tím ẩm.
Câu 15: Tính base của NH3 do:
A. Cặp e tự do của nguyên tử nitrogen
B. Phân tử có 3 liên kết cộng hóa trị phân cực
C. NH3 tan nhiều trong nước
D. NH3 tác dụng với nước tạo NH4OH
II. Tự luận
Câu 1 (2 điểm): Một bình phản ứng có dung dịch không đổi, chứa hỗn hợp khí N2 và H2 với nồng độ tương ứng là 0,3M và 0,7M. Sau khi phản ứng tổng hợp NH3 đạt trạng thái cân bằng ở toC, H2 chiếm 50% thể thích hỗn hợp thu được. Xác định hằng số cân bằng KC ở t0C của phản ứng trên.
Câu 2 (2 điểm): Trộn 300ml dung dịch KOH a(M) vào 200ml dung dịch HCl 0,2M thu được dung dịch có pH = 13. Tính a(M)
Đề 6
Câu 1: Đồ thị dưới đây biểu diễn sự thay đổi tốc độ phản ứng thuận và phản ứng nghịch theo thời gian của phản ứng: A(g) ⇌ B(g). Đường nào dưới đây biểu diễn sự thay đổi tốc độ phản ứng thuận và phản ứng nghịch?
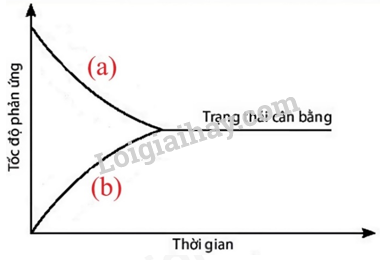
Hình 1.5. Đồ thị biểu diễn sự thay đổi tốc độ phản ứng thuận và phản ứng nghịch theo thời gian
A. Đường (a) biểu diễn sự thay đổi tốc độ phản ứng thuận và đường (b) biểu diễn sự thay đổi tốc độ phản ứng nghịch.
B. Đường (a) biểu diễn sự thay đổi tốc độ phản ứng nghịch và đường (b) biểu diễn sự thay đổi tốc độ phản ứng thuận.
C. Cả 2 đường (a) và (b) đều biểu diễn sự thay đổi tốc độ phản ứng thuận.
D. Cả 2 đường (a) và (b) đều không biểu diễn sự thay đổi tốc độ phản ứng thuận.
Câu 2: Cho các nhận xét sau:
(a) Ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản nghịch.
(b) Ở trạng thái cân bằng, các chất không phản ứng với nhau.
(c) Ở trạng thái cân bằng, nồng độ chất sản phẩm luôn lớn hơn nồng độ chất ban đầu.
(d) Ở trạng thái cân bằng, nồng độ các chất không thay đổi.
Các nhận xét đúng là
A. (a) và (b). B. (b) và (c). C. (a) và (c). D. (a) và (d).
Câu 3: Hằng số cân bằng của phản ứng N2O4(g) ⇌ 2NO2(g) ở 2 °C là KC = 2,0. Nếu mỗi quả cầu màu vàng (  ) đại diện cho 1 mol N2O4 và mỗi quả cầu màu nâu là 1 mol NO2 (
) đại diện cho 1 mol N2O4 và mỗi quả cầu màu nâu là 1 mol NO2 (  ) thì bình chứa 1,0 L nào sau đây đại diện cho hỗn hợp cân bằng ở 2 °C?
) thì bình chứa 1,0 L nào sau đây đại diện cho hỗn hợp cân bằng ở 2 °C?
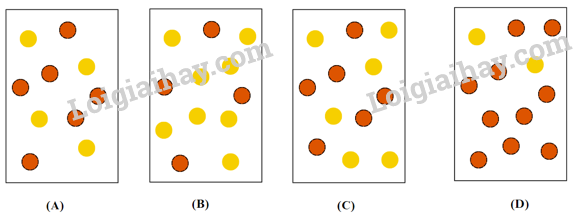
A. Hình A. B. Hình B. C. Hình C. D. Hình D.
Câu 4: Cân bằng nào dưới đây có sự chuyển dịch khi thay đổi áp suất của hệ phản ứng?
A. 2HI(g) ⇌ H2(g) + I2(g) B. FeO(s) + CO(g) ⇌ Fe(s) + CO2(g)
C. CaCO3(s) ⇌ CaO(s) + CO2(g) D. H2O(g) + CO(g) ⇌ CO2(g) + H2(g)
Câu 5: Ở nhiệt độ không đổi, hệ cân bằng nào sẽ chuyển dịch về bên phải nếu tăng áp suất chung của hệ?
A. H2(g)+ Cl2(g)⇌ 2HCl(g) B. 2H2 (g)+ O2 (g)⇌ 2H2O(g)
C. 2CO2(g) ⇌ 2CO(g)+ O2(g) D. H2(g)+ F2(g)⇌ 2HF(g)
Câu 6: Cho cân bằng sau trong bình kín: 2NO2(màu nâu đỏ) ⇌ N2O4 (không màu). Biết khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng thuận có
A. \({\Delta _r}H_{298}^o\) < 0, phản ứng toả nhiệt. B. \({\Delta _r}H_{298}^o\) > 0, phản ứng toả nhiệt.
C. \({\Delta _r}H_{298}^o\) < 0, phản ứng thu nhiệt. D. \({\Delta _r}H_{298}^o\) > 0, phản ứng thu nhiệt.
Câu 7: Khi đun nóng HI trong một bình kín, xảy ra phản ứng sau:
2HI(g) ⇌ H2(g) + I2 (g) ∆H0298 > 0
Ở to C hằng số cân bằng KC của phản ứng bằng \(\frac{1}{{81}}\). Phần trăm HI bị phân hủy ở nhiệt độ trên là
A. 18,18%. B. 36,67%. C. 33,33%. D. 66,67%.
Câu 8: Trong dung dịch nitric acid (bỏ qua sự phân li của H2O) có những phần tử nào?
A. H+, NO3-. B. H+, NO3-, H2O. C. H+, NO3-, HNO3. D. H+, NO3-, HNO3, H2O.
Câu 9: Dung dịch thu được khi trộn lẫn 200 mL dung dịch NaCl 0,2 M và 300 mL dung dịch Na2SO4 0,2 M có nồng độ cation Na+ là bao nhiêu?
A. 0,23 M. B. 1 M. C. 0,32 M. D. 0,1 M.
Câu 10: Dung dịch X gồm: 0,09 mol Cl− ,0,04 mol Na+, a mol Fe3+ và b mol SO42-. Khi cô cạn X thu được 7,715 gam muối khan. Giá trị của a và b lần lượt là
A. 0.05 và 0,05. B. 0,03 và 0,02. C. 0,07 và 0,08. D. 0,018 và 0,027.
Câu 11: Phát biểu nào sau đây không đúng khi nói về ammonia?
A. Trong công nghiệp, ammonia thường được sử dụng với vai trò chất làm lạnh (chất sinh hàn).
B. Do có hàm lượng nitrogen cao (82,35%) theo khối lượng) nên ammonia được sử dụng làm phân đạm rất hiệu quả.
C. Phần lớn ammonia được dùng phản ứng với acid để sản xuất các loại phân đạm.
D. Quá trình tổng hợp ammonia từ nitrogen và hydrogen là quá trình thuận nghịch nên không thể đạt hiệu suất 100%.
Câu 12: Hiện tượng khi cho quỳ tím ẩm vào bình chứa khí ammonia là
A. quỳ tím chuyển màu đỏ. B. quỳ tím chuyển màu vàng.
C. quỳ tím chuyển màu xanh. D. quỳ tím không chuyển màu.
Câu 13: Hiện tượng xả ra khi để hai ống nghiệm chứa lần lượt dung dịch HCl và dung dịch NH3 đặc gần nhau là
A. xuất hiện khói trắng. B. xuất hiện khói vàng.
C. xuất hiện khói màu đen. D. xuất hiện khói màu nâu.
Câu 14: Chất nào dưới đây tác dụng với dung dịch HNO3 không xảy ra phản ứng oxi hóa – khử?
A. Cu. B. Fe. C. CuO. D. FeO.
Câu 15: Để m gam Fe ngoài không khí, sau một thời gian thu được hỗn hợp A có khối lượng 12 gam gồm: FeO, Fe2O3, Fe3O4 và Fe. Hòa tan hết A bằng dung dịch HNO3 thu được 2,479 lít NO (đkc, sản phẩm khử duy nhất). Giá trị của m là
A. 10,08. B. 9,02. C. 11,2. D. 14,0.
Câu 16: Cho phản ứng: Al + H2SO4đặc ⟶ Al2(SO4)3 + SO2 + H2O. Hệ số cân bằng của H2SO4 là
A. 4. B. 8. C. 6. D. 3.
Câu 17: Trong số các tính chất sau, tính chất nào không là tính chất của sulfuric acid đặc, nguội?
A. Tan trong nước, tỏa nhiệt. B. Làm hóa than vải, giấy, đường.
C. Hòa tan được kim loại Al và Fe. D. Háo nước.
Câu 18: Sulfuric acid đặc nguội có thể đựng trong bình chứa làm bằng
A. Cu. B. Ag. C. Ca. D. Al.
Câu 19: Cho các chất: Cu, CuO, BaSO4, Mg, KOH, C, Na2CO3. Tổng số chất tác dụng với dung dịch H2SO4 đặc, nóng là
A. 4. B. 5. C. 6. D. 7.
Câu 20: Khi làm thí nghiệm với H2SO4 đặc, nóng thường sinh ra khí SO2. Để hạn chế tốt nhất khí SO2 thoát ra gây ô nhiễm môi trường, người ta nút ống nghiệm bằng bông tẩm dung dịch nào sau đây?
A. Giấm ăn. B. Muối ăn. C. Cồn. D. Xút.
----- HẾT -----
Đề 7
Câu 1: Trong quá trình tổng hợp ammonia, ở trạng thái cân bằng [N2] = 0,45 (M); [H2] = 0,14 (M); [NH3] = 0,62 (M). Giá trị hằng số cân bằng KC của phản ứng trên gần nhất với
A. 10. B. 311. C. 502. D. 6.
Câu 2: Cho phản ứng hóa học: H2(g) + I2(g) ⇌ 2HI(g)
Ở 430oC, hằng số KC = 51,52. Biết nồng độ ban đầu của H2 và I2 lần lượt là 1,0 (M) và 3,0 (M). Nồng độ của hydrogen tại thời điểm cân bằng là
A. 2,06 M. B. 0,96 M. C. 2,04 M. D. 0,94 M.
Câu 3: Nhận xét nào sau đây sai?
A. Trong phản ứng một chiều, chất sản phẩm không phản ứng được với nhau tạo thành chất đầu.
B. Trong phản ứng thuận nghịch, các chất sản phẩm có thể phản ứng với nhau tạo thành chất đầu.
C. Phản ứng một chiều là phản ứng luôn diễn ra theo nhiều hướng và xảy ra không hoàn toàn.
D. Phản ứng thuận nghịch, tại thời điểm tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch thì phản ứng đạt trạng thái cân bằng.
Câu 4: Cho cân bằng hóa học: CaO(s) + CO2(g) ⇌ CaCO3(s) ∆rH < 0
Khi áp suất tăng thì
A. cân bằng chuyển dịch theo chiều thuận. B. cân bằng chuyển dịch theo chiều nghịch.
C. cân bằng không chuyển dịch. D. cân bằng chuyển dịch theo cả hai chiều.
Câu 5: Phản ứng hóa học nào dưới đây không dịch chuyển cân bằng khi thay đổi áp suất chung của hệ?
A. 2SO2(g) + O2(g) ⇌ 2SO3 (g). B. CH4(g) + Cl2(g) ⇌ CH3Cl (g) + HCl(g).
C. PCl5(g) ⇌ PCl3(g) + Cl2(g). D. 2CO(g) + O2(g) ⇌ 2CO2(g)
Câu 6: Cho các chất sau: nitric acid, hydrofluoric acid, hydrochloric acid, sodium hydroxide, potassium chloride, copper hydroxide, acetic acid. Số chất điện li mạnh là:
A. 2. B. 3. C. 4. D. 1.
Câu 7: Phương trình điện li nào dưới đây sai?
A. NaCl ⟶ Na+ + Cl-. B. HF ⇌ H+ + F-.
C. CH3COOH ⟶ CH3COO- + H+. D. KNO3 ⟶ K+ + NO3-.
Câu 8: Dung dịch X chứa các ion sau: 0,10 mol Cl-; 0,15 mol SO42-; 0,10 mol Na+ và a mol Cu2+. Giá trị của a là
A. 0,10. B. 0,05. C. 0.20. D. 0,15.
Câu 9: Cho những mô tả dưới đây nói về ứng dụng của chất nào?
(a) Chất trung gian quan trọng trong quá trình sản xuất sulfuric acid.
(b) Dạng lỏng là một dung môi phân cực, được sử dụng để thực hiện nhiều phản ứng.
(c) Sử dụng để tẩy trắng bột giấy, khử màu trong sản xuất đường, chống nấm mốc,…
A. Sulfur. B. Sulfur dioxide. C. Sulfuric acid. D. Sulfur trioxide.
Câu 10: Khi nhỏ sulfuric acid đặc vào cốc đựng đường mía thì xuất hiện hiện tượng
A. đường bị chuyển thành màu đen.
B. đường bị than hóa và có khí mùi hắc thoát ra khỏi cốc.
C. đường bị than hóa và bị đẩy ra khỏi cốc.
D. đường thị than hóa, bị đẩy ra khỏi cốc và có không màu, không mùi thoát ra.
Câu 11: Khẳng định nào dưới đây là sai khi nói về cân bằng của H2SO4 trong nước (Hình 2.6).
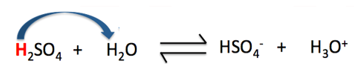
Hình 4.11. Cân bằng của H2SO4 trong nước
A. Trong phản ứng thuận, H2SO4 đóng vai trò là acid.
B. Trong phản ứng thuận, H2O đóng vai trò là base.
C. Trong phản ứng nghịch, H3O+ đóng vai trò là acid.
D. Trong phản ứng thuận, H2O là chất cho H+.
Câu 12: Cho các phát biểu:
(a) HCl khi tan trong nước cho dung dịch có pH < 7.
(b) Dãy các chất: HF, NaF, NaOH đều là chất điện li mạnh.
(c) Dãy các chất: C2H5OH, C6H12O6, CH3CHO là các chất điện li yếu.
(d) Những chất khi tan trong nước cho dung dịch dẫn điện được gọi là những chất điện li.
Số phát biểu đúng là
A. 2. B. 3. C. 1. D. 4.
Câu 13: Đo pH của một cốc nước chanh được giá trị pH bằng 2,4. Nhận định nào sau đây không đúng?
A. Nước chanh có môi trường acid.
B. Nồng độ ion [H+] của nước chanh là 10-2,4 mol/L.
C. Nồng độ ion [H+] của nước chanh là 0,24 mol/L.
D. Nồng độ ion [OH-] của nước chanh nhỏ hơn 10-7 mol/L.
Câu 14: Vai trò của chất chỉ thị trong chuẩn độ acid mạnh và base mạnh là
A. là chất xúc tác cho phản ứng.
B. tạo môi trường trung tính cho phản ứng.
C. làm tăng tốc độ phản ứng.
D. xác định thời điểm khi phản ứng đạt đến hoặc vượt qua điểm tương đương.
Câu 15: Cho 100 ml dung dịch A chứa HCl 0,05M, H2SO4 0,025M vào 400 ml dung dịch B chứa NaOH 0,035M, Ba(OH)2 0,02M thu được dung dịch có pH = x. Giá trị x là
A. 1,4. B. 11,8. C. 2,2. D. 12,6.
Câu 16: Thể tích dung dịch Ba(OH)2 0,025M cần cho vào 100 ml dung dịch hỗn hợp gồm HNO3 và HCl có pH = 1, để thu được dung dịch có pH = 2 là
A. 0,224 lít. B. 0,15 lít. C. 0,336 lít. D. 0,448 lít.
Câu 17: Hiện tượng mưa acid chủ yếu là do những chất khí sinh ra trong quá trình sản xuất công nghiệp nhưng không xử lí triệt để. Hai khí đó là
A. CO2 và O2. B. NH3 và HCl. C. SO2 và NO2. D. H2S và N2.
Câu 18: Phương trình phản ứng nhiệt phân nào sau đây sai?
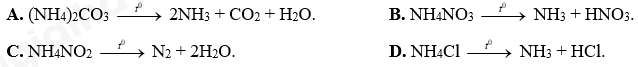
Câu 19: Cho hỗn hợp khí A gồm 0,2 mol N2; 0,9 mol H2 phản ứng trong điều kiện thích hợp thu được hỗn hợp B biết dA/B = 51/55. Hiệu suất phản ứng là
A. 10%. B. 20%. C. 30%. D. 40%.
Câu 20: Hoà tan hoàn toàn 4,8 gam Mg bằng dung dịch HNO3 loãng, sau phản ứng chỉ thu được dung dịch X và không thấy xuất hiện khí. Khối lượng muối có trong X là
A. 29,6 gam. B. 33,6 gam. C. 44,4 gam. D. 59,2 gam.
----- HẾT -----
- Đề thi giữa kì 1 Hóa 11 Chân trời sáng tạo - Đề số 8
- Đề thi giữa kì 1 Hóa 11 Chân trời sáng tạo - Đề số 9
- Đề thi giữa kì 1 Hóa 11 Chân trời sáng tạo - Đề số 10
- Đề thi giữa kì 1 Hóa 11 Chân trời sáng tạo - Đề số 7
- Đề thi giữa kì 1 Hóa 11 Chân trời sáng tạo - Đề số 6
>> Xem thêm
Luyện Bài Tập Trắc nghiệm Hóa 11 - Chân trời sáng tạo - Xem ngay











