1. Amine là gì?
Khi thay thế nguyên tử H trong phân tử NH3 bằng gốc hydrocarbon ta thu được amine.
2. Tính chất vật lí
- Nhiệt độ nóng chảy, nhiệt độ sôi của các amine cùng bậc có xu hướng tăng khi phân tử khối tăng. Nhiệt độ sôi : Amine > hydrocarbon (cùng C hoặc M).
- Trạng thái: Methylamine, ethylamine, dimethylamine và trimethylamine là những chất khí, có mùi tanh của cá hoặc mùi khai tương ammonia tự (tuỳ nồng độ), các amine còn lại là chất lỏng hoặc rắn.
- Độ tan:
+ Các amine là chất khí dễ tan trong nước nhờ tạo được liên kết hydrogen với nước.
+ Khi số C tăng thì độ tan của các amine giảm.
+ Các arylamine có độ tan trong nước rất thấp.
Aniline là chất lỏng, ít tan trong nước.
3. Tính chất hoá học: Tính base của amine
Amine có tính base yếu tương tự NH3.
- Làm đổi màu chất chỉ thị: Dung dịch các alkylamine có thể làm quỳ tím đổi màu xanh hoặc phenolphthalein hoá hồng, còn dung dịch aniline không làm đổi màu quỳ tím hoặc phenolphthalein hoá hồng.
\({\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{N}}{{\rm{H}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {{\rm{[C}}{{\rm{H}}_{\rm{3}}}{\rm{N}}{{\rm{H}}_{\rm{3}}}{\rm{]}}^{\rm{ + }}}{\rm{ + O}}{{\rm{H}}^ - }\)
- Tác dụng với acid (HCl, H2SO4,…) tạo muối ammonium.
\({\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{N}}{{\rm{H}}_{\rm{2}}}{\rm{ + HCl}} \to {\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{N}}{{\rm{H}}_{\rm{3}}}{\rm{Cl}}\): methylammonium chloride.
\({\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_2}{\rm{N}}{{\rm{H}}_{\rm{2}}}{\rm{ + HCl}} \to {\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{C}}{{\rm{H}}_2}{\rm{N}}{{\rm{H}}_{\rm{3}}}{\rm{Cl}}\): ethylammonium chloride.
\({{\rm{C}}_{\rm{6}}}{{\rm{H}}_{\rm{5}}}{\rm{N}}{{\rm{H}}_{\rm{2}}}{\rm{ + HCl}} \to {{\rm{C}}_{\rm{6}}}{{\rm{H}}_{\rm{5}}}{\rm{N}}{{\rm{H}}_{\rm{3}}}{\rm{Cl}}\): Phenylammonium chloride.
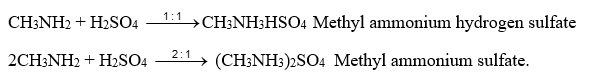
CH3NH2 + HNO3 \( \to \) CH3NH3NO3 Methyl ammonium nitrate.
CH3NH2 + CH3COOH \( \to \)CH3NH3OCOCH3 Methyl ammonium acetate (+ acid, base)
4. Tính chất hoá học: Tạo phức
methylamine hay ethylamine tác dụng với Cu(OH)2 tạo dung dịch phức chất có màu xanh lam.
4CH3NH2 + Cu(OH)2→ [Cu(CH3NH2)4](OH)2
4CH3CH2NH2 + Cu(OH)2→ [Cu(CH3CH2NH2)4](OH)
5. Tính chất hoá học: Tính khử
Phản ứng với nitrous acid (HNO2) thể hiện tính khử
- RNH2 + HNO2 ROH + N2 +H2O => nhận biết alkylamine bậc một. (R: gốc alkyl)
CH3NH2 + HONO → CH3OH + N2 + H2O
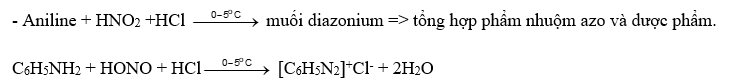
6. Tính chất hoá học: Phản ứng ở nhân thơm
* Aniline + nước Bromine => Hiện tượng: Xuất hiện kết tủa trắng + Mất màu dung dịch bromine 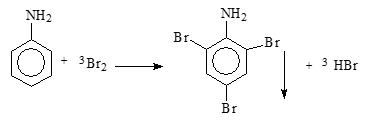
2,4,6-tribromoaniline (trắng)
Hoặc: C6H5NH2 + 3Br2 → C6H2Br3NH2 + 3HBr
7. So sánh tính base
- Gốc đẩy electron làm tăng tính base, gốc hút electron làm giảm tính base
p – NO2 – C6H4NH2 < C6H5NH2 < NH3 < CH3NH2 < C2H5NH2 < C3H7NH2
- Amine có càng nhiều gốc đẩy electron thì tính base càng mạnh, amine có càng nhiều gốc hút electron thì tính base càng yếu.
(R thơm)3N < (R thơm)2 NH < R thơm NH2 < NH3 < R no NH2 < (R no)2 NH < (R no)3N
Chú ý rằng với gốc R no càng cồng kềnh thì ảnh hưởng không gian của nó càng lớn làm cản trở quá trình H+ tiến lại gần nguyên tử N nên (Rno)2NH < (Rno)3N sẽ không còn đúng nữa.

 Hợp chất chứa nitrogen - Từ điển môn Hoá 12
Hợp chất chứa nitrogen - Từ điển môn Hoá 12 






Danh sách bình luận