Lý thuyết bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
Lý thuyết: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
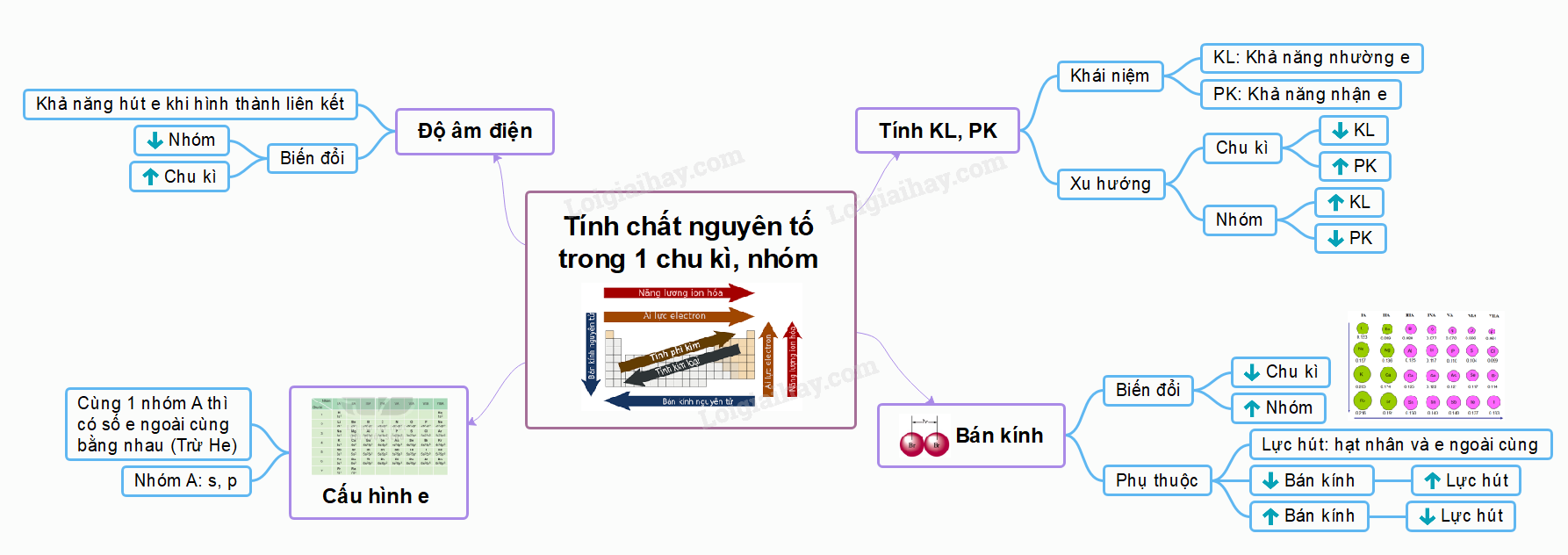
I. Cấu hình electron nguyên tử của các nguyên tố nhóm A
Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A
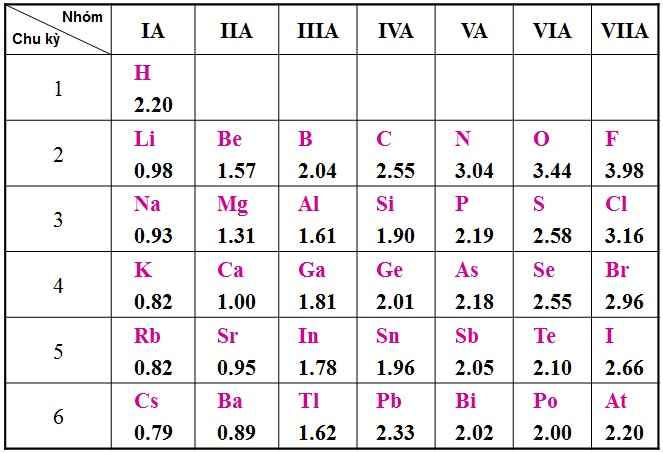
- Nhóm A gồm các nguyên tố s và p. Nguyên tử của các nguyên tố cùng một nhóm A có số electron ngoài cùng (electron hóa trị) bằng nhau (trừ He trong nhóm VIIIA)
- Sự giống nhau về số electron hóa trị dẫn đến sự tương tự nhau về tính chất hóa học của các nguyên tố trong cùng nhóm A
- Sau mỗi chu kì, cấu hình electron ngoài cùng của nguyên tử các nguyên tố nhóm A được lặp đi lặp lại một cách tuần hoàn. Sự biến đổi tuần hoàn cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần là nguyên nhân của sự biến đổi tuần hoàn về tính chất của các nguyên tố
II. Bán kính nguyên tử
- Một cách gần đúng, bán kính nguyên tử được xác định bằng nửa khoảng cách trung bình giữa 2 hạt nhân nguyên tử gần nhau nhất trong chất rắn đơn chất hoặc trong phân tử hai nguyên tử giống nhau
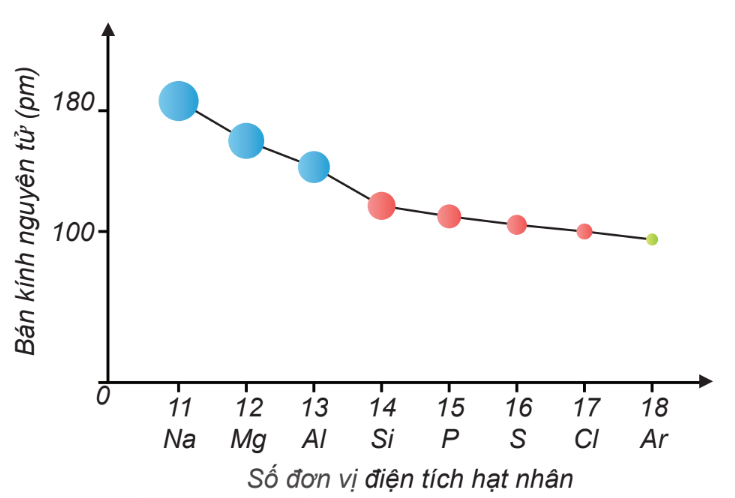
Sự giảm bán kính nguyên tử của các nguyên tố trong chu kì 3
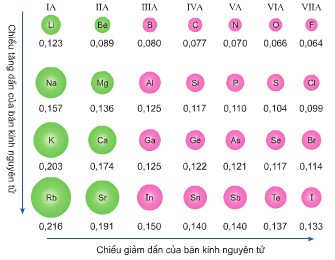
Giá trị bán kính nguyên tử
- Bán kính nguyên tử phụ thuộc vào lực hút giữa hạt nhân với các electron lớp ngoài cùng. Bán kính giảm là do lực hút tăng và ngược lại, bán kính tăng là do lực hút giảm
- Xu hướng biến đổi bán kính nguyên tử
+ Trong 1 chu kì, bán kính nguyên tử giảm dần theo chiều tăng dần của điện tích hạt nhân
+ Trong 1 nhóm A, bán kính nguyên tử tăng theo chiều tăng dần điện tích hạt nhân
Em có biết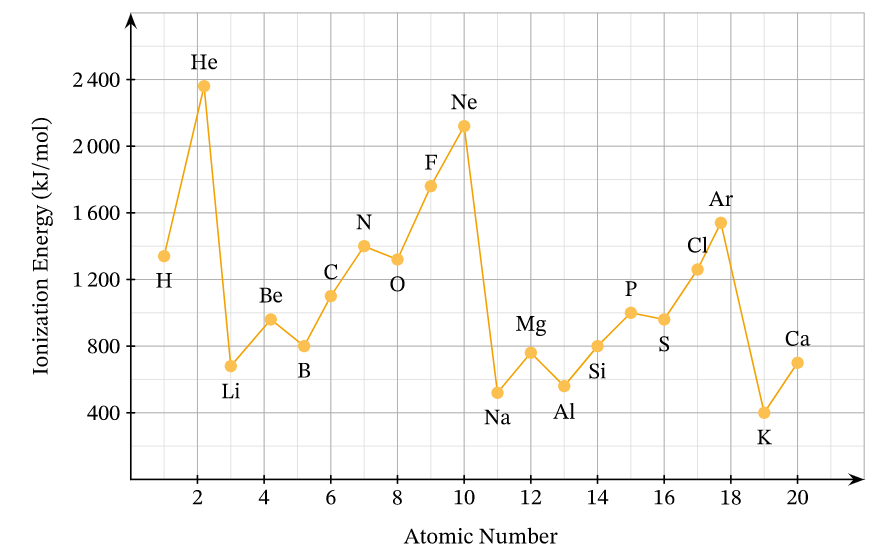
Sự biến đổi năng lượng ion hóa thứ nhất của các nguyên tố chu kì 2 và 3
- Năng lượng ion hóa thứ nhất của nguyên tử là năng lượng tối thiểu cần thiết để tách electron thứ nhất ra khỏi nguyên tử ở thể khí, trạng thái cơ bản:
X(g) → X+(g) + e
- Năng lượng ion hóa thứ nhất kí hiệu là I1, đơn vị là kJ/mol
Ví dụ: Để tách một mol electron ra khỏi một mol nguyên tử hydrogen theo quá trình H(g) → H+(g) + e phải tiêu tốn một năng lượng là 1312 kJ, do đó I1 = 1312 kJ/mol
+ Trong một chu kì, năng lượng ion hóa thứ nhất có xu hướng tăng theo chiều tăng dần của điện tích hạt nhân
+ Trong một nhóm A, năng lượng ion hóa thứ nhất có xu hướng giảm theo chiều tăng dần của điện tích hạt nhân
III. Độ âm điện
- Độ âm điện của nguyên tử là đại lượng đặc trưng cho khả năng hút electron của nguyên tử một nguyên tố hóa học khi tạc thành liên kết hóa học
- Khi tham gia liên kết hóa học, nguyên tử có độ âm điện nhỏ dễ nhường electron, nguyên tử có độ âm điện lớn dễ nhận electron
- Xu hướng biến đổi độ âm điện theo chiều tăng dần của điện tích hạt nhân
+ Độ âm điện tăng từ trái qua phải trong một chu kì
- Trong một chu kì, khi số electron lớp ngoài cùng tăng, điện tích hạt nhân tăng thì lực hút giữa hạt nhân với các electron ngoài cùng tăng nên độ âm điện tăng
+ Độ âm điện giảm từ trên xuống trong một nhóm A
- Trong một nhóm A, khi số lớp electron tăng, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm nên độ âm điện giảm
IV. Tính kim loại và tính phi kim
1. Khái niệm
- Tính kim loại là tính chất của một nguyên tố mà nguyên tử của nó dễ nhường electron để trở thành ion dương. Nguyên tử của nguyên tố nào càng dễ nhường electron để trở thành ion dương, tính kim loại của nguyên tố đó càng mạnh.
- Tính phi kim là tính chất của một nguyên tố mà nguyên tử của nó dễ nhường electron để trở thành ion âm. Nguyên tử của nguyên tố nào càng dễ nhận electron để trở thành ion âm, tính phi kim của nguyên tố đó càng mạnh.
2. Sự biến đổi tính kim loại, tính phi kim
Ví dụ: So sánh tính kim loại của sodium và magnesium
- Chuẩn bị: Kim loại Na, Mg, dung dịch phenolphtalein, nước, cốc thủy tinh
- Tiến hành:
+ Lấy 2 cốc thủy tinh, mỗi cốc chứa khoảng 200 ml nước, nhỏ tiếp vài giọt dung dịch
+ Cho 1 mẫu nhỏ Na vào cốc (1), một dây Mg vào cốc (2)
Lưu ý: hầu hết kim loại kiềm phản ứng với nước mãnh liệt, chỉ sử dụng các kim loại kiềm với lượng nhỏ, cần làm sạch bề mặt dây Mg trước khi cho vào cốc (2)
Phương trình phản ứng:
2Na + 2H2O → 2NaOH + H2
Mg + 2H2O → Mg(OH)2 + H2
Quan sát thí nghiệm có thể thấy kim loại Na tác dụng mãnh liệt với nước còn Mg tác dụng chậm hơn, điều này chứng tỏ kim loại Na dễ nhường electron để trở thành ion dương hơn so với Mg nên Na có tính kim loại mạnh hơn Mg
- Xu hướng biến đổi tính kim loại và phi kim
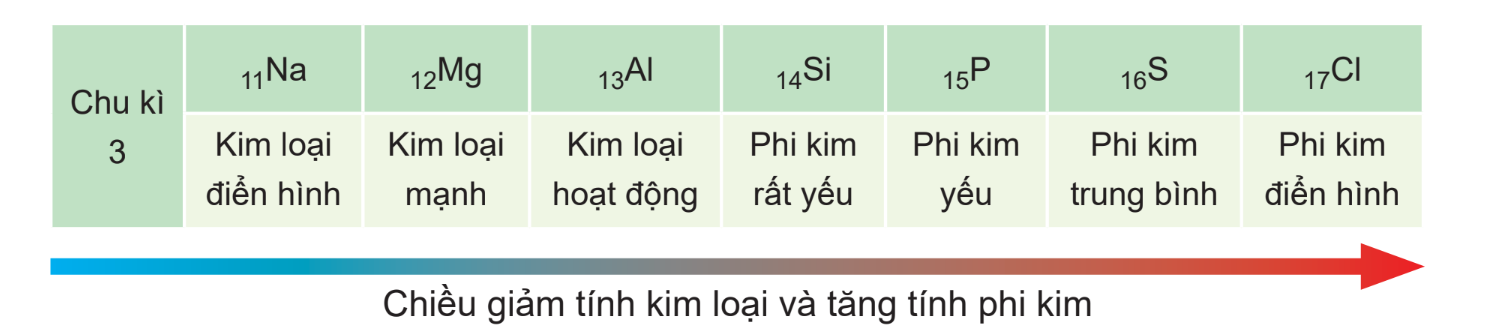
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần. Do bán kính nguyên tử giảm, lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng, dẫn đến khả năng nhường electron giảm nên tính kim loại giảm, khả năng nhận electron tăng nên tính phi kim tăng
+ Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần. Tuy điện tích hạt nhân tăng dần, nhưng bán kính nguyên tử tăng nhanh hơn, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm, dẫn đến khả năng nhường electron tăng nên tính kim loại tăng, khả năng nhận electron giảm nên tính phi kim giảm.
Ví dụ:
Luyện Bài Tập Trắc nghiệm Hóa 10 - Kết nối tri thức - Xem ngay











