Lý thuyết bài 21: Nhóm halogen
Trạng thái tự nhiên, nhiệt độ sôi, nhiệt độ nóng chảy của halogen Tính chất hóa học, ứng dụng, điều chế
Lý thuyết: Nhóm Halogen
I. Trạng thái tự nhiên
- Nhóm VIIA (nhóm halogen)
+ Fluorine: F
+ Chlorine: Cl
+ Bromine: Br
+ Iodine: I
+ Astatine: At
+ Tennessine: Ts
- 4 nguyên tố F, Cl, Br, I tồn tại trong tự nhiên còn At và Ts là nguyên tố phóng xạ
- Trong tự nhiên, halogen chỉ tồn tại ở dạng hợp chất, phần lớn ở dạng muối halide
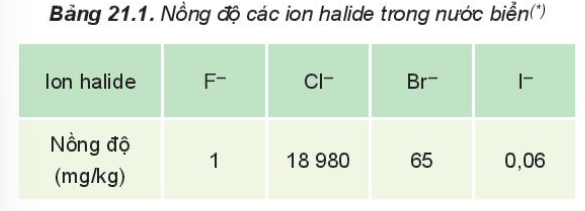
II. Cấu tạo nguyên tử, phân tử
- Các nguyên tử halogen có 7 electron ở lớp ngoài cùng
=> Dễ nhận thêm 1 electron
ns2np5 + 1e → ns2np6
=> Số oxi hóa đặc trăng của halogen trong hợp chất là -1
- Khi liên kết với với các nguyên tố có độ âm điện lớn, các halogen có thể có các số oxi hóa dương: +1, +3, +5, +7
III. Tính chất vật lí
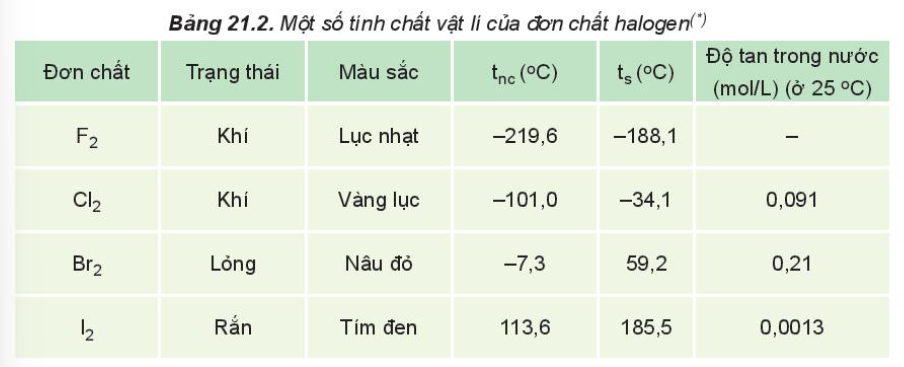
- Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do
+ Tương tác van der Waals giữa các phân tử tăng.
+ Khối lượng phân tử tăng
- Halogen tan ít trong nước nhưng tan nhiều trong dung môi hữu cơ
+ Trong y học, dung dịch iodine loãng trong ethanol được dùng làm thuốc sát trùng
- Bromine gây bỏng sâu khi tiếp xúc với da
- Hít thở không khí có chứa halogen làm tổn hại niêm mạc tế bào đường hô hấp
IV. Tính chất hóa học
- Halogen là phi kim điển hình, có tính oxi hóa mạnh, giảm dần từ F2 đến I2
1. Halogen + Kim loại → Muối halide
2Na + Cl2 \(\xrightarrow{{{t^o}C}}\) 2NaCl
2Fe + 3Cl2 \(\xrightarrow{{{t^o}C}}\) 2FeCl3

2. X2 + H2 → 2HX

- Mức độ phản ứng của halogen với H2 giảm dần khi đi từ F2 đến I2
3. Tác dụng với H2O
- F2 phản ứng mạnh với H2O ở điều kiện thường
2F2 + 2H2O → 4HF + O2
- Cl2 khi tan vào nước, 1 phần tác dụng với H2O
Cl2 + H2O ↔ HCl + HClO
=> HClO có tính oxi hóa mạnh nên Chlorine trong nước có khả năng diệt khuẩn, tẩy màu và được ứng dụng trong khử trùng nước sinh hoạt
4. Tác dụng với dung dịch kiềm
- Ở nhiệt độ thường:
Cl2 + 2NaOH → NaCl + NaClO + H2O
=> Nước Javel (chứa NaClO, NaCl và 1 phần NaOH dư) được làm chất tẩy rửa, khử trùng
- Khi đun nóng
3Cl2 + 6KOH \(\xrightarrow{{{t^o}C}}\) 5KCl + KClO3 + 3H2O
=> KClO3 là chất oxi hóa mạnh, được dùng để chế tạo thuốc nổ, hỗn hợp đầu que diêm…
5. Tác dụng với dung dịch halide
- Halogen có tính oxi hóa mạnh hơn sẽ đẩy X- ra khỏi muối
Ví dụ:
Cl2 + 2NaBr → 2NaCl + Br2
Br2 + 2NaI → 2NaBr + I2
- Trong công nghiệp, phản ứng giữa Cl2 và Br- đưuọc dùng để điều chế Br2 từ nước biển
V. Điều chế Cl2
1. Trong phòng thí nghiệm
- Từ MnO2 và HCl đặc
MnO2 + 4HCl (đặc) \(\xrightarrow{{{t^o}C}}\) MnCl2 + Cl2 + 2H2O
- Từ KMnO4 + HCl đặc
2KMnO4 + 16HCl(đặc) → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
2. Trong công nghiệp
- Điện phân dung dịch muối ăn có màng ngăn xốp

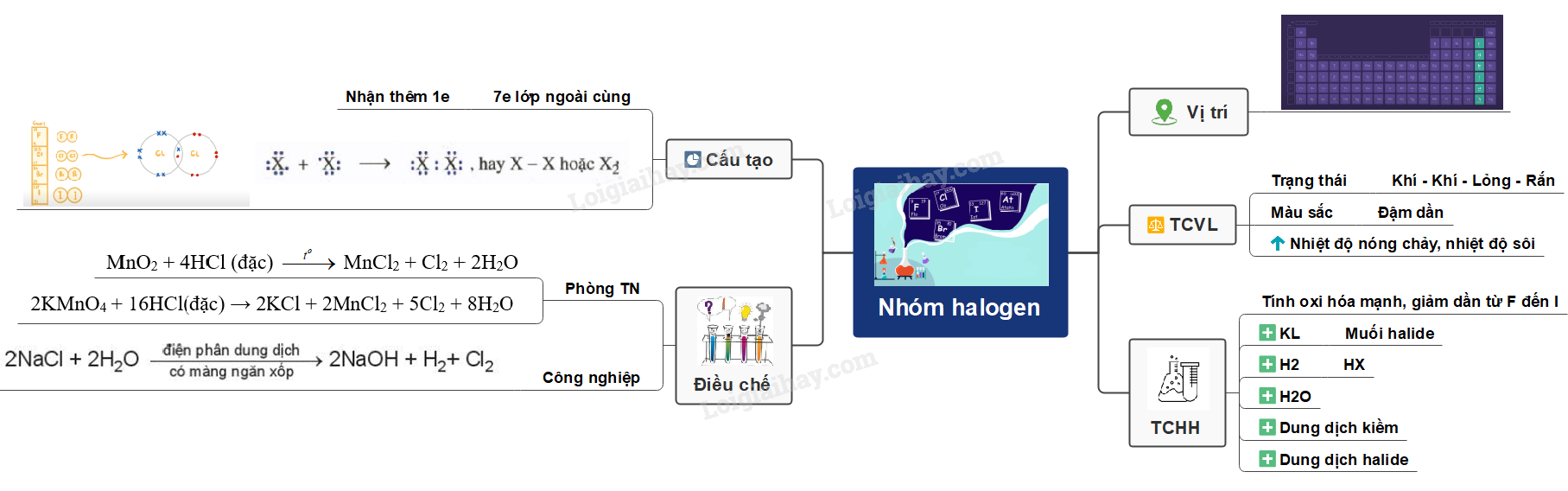
Sơ đồ tư duy:
Luyện Bài Tập Trắc nghiệm Hóa 10 - Kết nối tri thức - Xem ngay












Danh sách bình luận