Lý thuyết bài 15: Ý nghĩa và cách tính biến thiên Enthalpy phản ứng hóa học
phản ứng tỏa nhiệt, phản ứng thu nhiệt, nhiệt tạo thành, biến thiên enthalpy, ý nghĩa của dấu và giá trị biến thiên enthalpy chuẩn
Lý thuyết: Ý nghĩa và cách tính biến thiên Enthalpy phản ứng hóa học
I. Ý nghĩa về dấu và giá trị của biến thiên enthalpy phản ứng
Có hai phản ứng kèm theo sự trao đổi năng lượng dưới dạng nhiệt:
- Phản ứng tỏa nhiệt: Biến thiên enthalpy của phản ứng có giá trị âm. Biến thiên enthalpy càng âm, phản ứng tỏa ra càng nhiều nhiệt.

- Phản ứng thu nhiệt: Biến thiên enthalpy của phản ứng có giá trị dương. Biến thiên enthalpy càng dương, phản ứng thu vào càng nhiều nhiệt.

- Các phản ứng tỏa nhiệt (\({\Delta _r}H_{298}^o\) < 0) thường diễn ra thuận lợi hơn các phản ứng thu nhiệt (\({\Delta _r}H_{298}^o\)>0)
Ví dụ: Sau khi được đốt nóng, Na tự cháy trong oxygen cho đến hết do phản ứng này có \({\Delta _r}H_{298}^o\) rất âm.
II. Cách tính biến thiên Enthalpy phản ứng
Có 2 cách:
1. Tính biến thiên enthapy phản ứng theo enthalpy tạo thành
Giả sử có phương trình tổng quát: aA + bB -> mM + nN
- Biến thiên enthalpy của phản ứng được xác định bằng hiệu số giữa tổng nhiệt tạo thành các chất sản phẩm (sp) và tổng nhiệt tạo thành của các chất đầu (cđ)
- Biến thiên enthalpy chuẩn của phản ứng được tín theo công thức:
VÍ dụ: Cho phản ứng:
Biến thiên Enthalpy chuẩn của phản ứng này được tính như sau:
Thay các giá trị tương ứng:
2. Tính biến thiên Enthalpy phản ứng theo năng lượng liên kết
Giả sử có phản ứng tổng quát:
aA(g) + bB(g) -> mM(g) + nN(g)
Biến thiên Enthalpy chuẩn của phản ứng này được tính như sau:
Ví dụ: Cho phản ứng:
Biến thiên Enthalpy chuẩn của phản ứng tính theo năng lượng liên kết như sau:
Sơ đồ tư duy





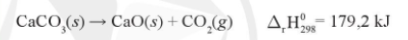
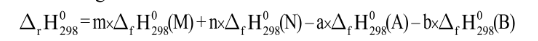
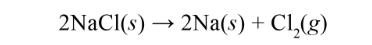
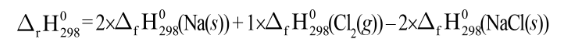
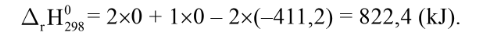
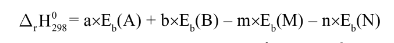

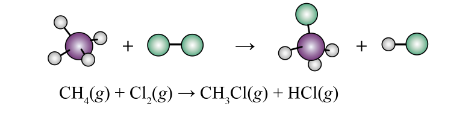
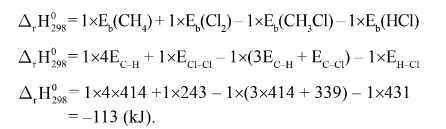








Danh sách bình luận