Bài 17. Nguyên tố và đơn chất halogen trang 99, 100, 101, 102, 103, 104, 105, 106, 107, 108 Hóa 10 Cánh diều
Tải vềVì sao nước chlorine được sử dụng phổ biến để khử trùng, sát khuẩn? Dựa vào xu hướng biến đổi tính chất của các đơn chất halogen trong bảng 17.3, hãy dự đoán về thể (trạng thái) của đơn chất astatine ở điều kiện thường. Giải thích Trong điều kiện thường, halogen nào ở thể rắn? Vì sao
CH tr 99 MĐ
| Vì sao nước chlorine được sử dụng phổ biến để khử trùng, sát khuẩn? |
Lời giải chi tiết:
- Nước chlorine có thành phần là HCl và HClO có tính oxi hóa mạnh
=> Nước chlorine có tính tẩy màu được dùng để khử trùng và sát khuẩn, tẩy trắng sợi, vải, giấy
CH tr 101 LT
|
1. Dựa vào xu hướng biến đổi tính chất của các đơn chất halogen trong bảng 17.3, hãy dự đoán về thể (trạng thái) của đơn chất astatine ở điều kiện thường. Giải thích |
Phương pháp giải:
Trong bảng 17.3, thể của các halogen ở điều kiện thường biến đổi từ khí → lỏng → rắn
Lời giải chi tiết:
- Theo bảng 17.3, xu hướng biến đổi trạng thái của các halogen ở điều kiện thường từ: khí → lỏng → rắn
- Mà astatine đứng dưới cùng trong nhóm halogen
=> Astatine tồn tại ở thể rắn trong điều kiện thường
- Giải thích: Do sự tăng khối lượng phân tử và sự tăng tương tác van dể Waals
CH tr 101 LT
| 2. Trong điều kiện thường, halogen nào ở thể rắn? Vì sao |
Phương pháp giải:
- Dựa vào thông tin bảng 17.3 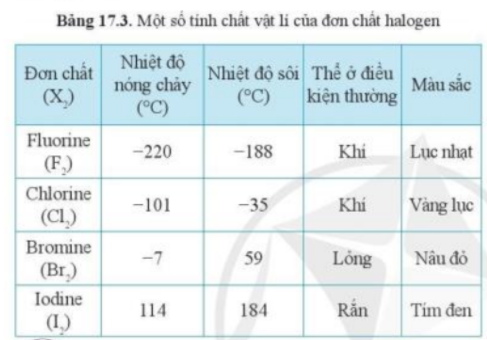
- Giải thích: Khối lượng phân tử, sự tăng tương tác van der Waals
Lời giải chi tiết:
- Quan sát Bảng 17.3, nhận thấy trong điều kiện thường có Iodine (I2) là ở thể rắn
- Giải thích:
+ Khối lượng phân tử cao
+ Lực tương tác van der Waals giữa phân tử iodine mạnh
CH tr 102 LT
| 3. Calcium và fluorine kết hợp thành phân tử calcium fluorine, CaF2. Trong đó, nguyên tử nào đã nhường và nhường bao nhiêu electron? Nguyên tử nào đã nhận và nhận bao nhiêu electron? |
Phương pháp giải:
- Các nguyên tố halogen có 7 electron ở lớp ngoài cùng
- Nguyên tố calcium có 2 electron ở lớp ngoài cùng
Lời giải chi tiết:
- Nguyên tử Fluorine có 7 electron ở lớp ngoài cùng => Nhận 1 electron từ nguyên tử Calcium để đạt cấu hình electron của khí hiếm
- Nguyên tử Calcium có 2 electron ở lớp ngoài cùng => Nhường 2 electron cho 2 nguyên tử Fluorine để đạt cấu hình electron của khí hiếm
CH tr 102 LT
| 4. Để hình thành phân tử phosphorus trichloride (PCl3) thì mỗi nguyên tử chlorine và phosphorus đã góp chung bao nhiêu electron hóa trị? Viết công thức Lewis của phân tử |
Phương pháp giải:
- Nguyên tử Phosphorus có 5 electron ở lớp ngoài cùng => Có xu hướng nhận thêm 3 electron
- Nguyên tử Chlorine có 7 electron ở lớp ngoài cùng => Có xu hướng nhận thêm 1 electron
Lời giải chi tiết:
- Trong phân tử phosphorus trichloride gồm 2 nguyên tố: P và Cl
+ Nguyên tử P có 5 electron ở lớp ngoài cùng => Góp chung 3 electron độc thân để hình thành 3 liên kết cộng hóa trị
+ Nguyên tử Cl có 7 electron ở lớp ngoài cùng => 3 nguyên tử Cl, mỗi nguyên tử góp chung 1 electron độc thân để hình thành 3 liên kết cộng hóa trị với P.
=> Khi đó, quanh P và Cl đều có 8 electron như khí hiếm Argon.
- Công thức Lewis của phân tử: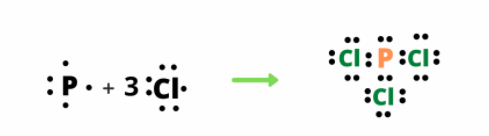
CH tr 103 LT
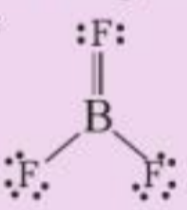
|
5. Theo độ âm điện, boron trifluoride là hợp chất ion, thực tế nó là hợp chất cộng hóa trị, với công thức Lewis như sau:
a) Viết phương trình hóa học tạo chất trên từ các đơn chất b) Phân tử BF3 có bao nhiêu liên kết σ và bao nhiêu liên kết п? |
Phương pháp giải:
a) Phương trình hóa học: B + F2 → ?
b) Liên kết đơn còn gọi là liên kết σ, liên kết đôi gồm 1 liên kết σ và 1 liên kết п
Lời giải chi tiết:
a) Phương trình hóa học: 2B + 3F2 → 2BF3
b) Trong phân tử BF3 có 2 liên kết đơn, 1 liên kết đôi (gồm 1 liên kết σ và 1 liên kết п)
=> Trong phân tử BF3 có 3 liên kết σ và 1 liên kết п
CH tr 104 TH
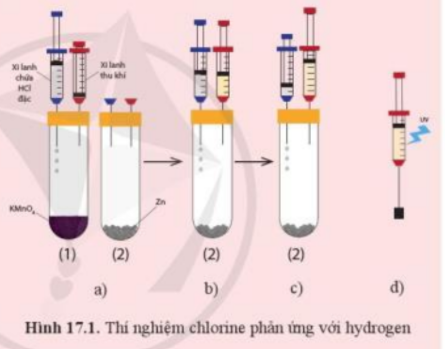
| Thí nghiệm chlorine phản ứng với hydrogen được mô tả như sau:
Bước 1: Chuẩn bị thí nghiệm như hình 17.1a với các ống nghiệm cùng đặt vào một giá thí nghiệm Bước 2: Bơm vài giọt dung dịch hydrochloric acid (HCl) đặc từ xi – lanh chứa acid vào ống nghiệm chứa tinh thể potassium permanganate (thuốc tím, KMnO4) - ống nghiệm (1) để tạo khí chlorine. Khi pit – tông nâng lên khoảng ½ chiều cao của xi – lanh thu khí thì ngừng bơm acid (hình 17.1b) Bước 3: Rút xi – lanh thu khí ra khỏi ống nghiệm (1), chuyển sang ghim vào ống nghiệm chứa kẽm - ống nghiệm (2) (hình 17.1c). Chuyển xi – lanh chứa dung dịch hydrochloric acid sang ống nghiệm (2) Bước 4: Bơm vào giọt dung dịch hydrochloric acid từ xi – lanh chứa acid vào ống nghiệm (2) để tạo khí hydrogen. Đến khí pit – tông được nâng lên khoảng 2/3 xi – lanh thu khí thì ngừng bơm acid Bước 5: Rút xi – lanh thu khí ra khỏi ống nghiệm (2). Ghim xi – lanh chứa hỗn hợp khí vào một nút cao su như hình 17.1d rồi kẹp vào giá thí nghiệm Bước 6: Dùng đèn tử ngoại chiếu vào xi – lanh chứa hỗn hợp khí (hoặc dùng ngọn lửa hơ nhẹ bên ngoài xi – lanh) + Quan sát và giải thích hiện tượng xảy ra khi dùng đèn tử ngoại chiếu vào xi – lanh chứa hỗn hợp khí (hoặc khi dùng ngọn lửa hơ nhẹ bên ngoài xi – lanh) + Nếu thay khí chlorine bằng hơi iodine thì phản ứng giữa hơi iodine và hydrogen có thể xảy ra hiện tượng như đã thấy trong thí nghiệm trên không? Giải thích |
Phương pháp giải:
- H2 tác dụng với Cl2 gây hiện tượng nổ khi đun nóng hoặc nổ ngay ở nhiệt độ thường khi được chiếu tia tử ngoại
- Không có hiện tượng như thí nghiệm trên
Lời giải chi tiết:
a)
- Ở Bước 2: Ta thu được khí chlorine
- Ở Bước 4: Ta thu được khí hydrogen
=> Trong xi – lanh là hỗn hợp kí chlorine và hydrogen
- Khi chiếu đèn tử ngoại vào xi – lanh hoặc dùng ngọn lửa hơ nhẹ bên ngoài xi - lanh chứa hỗn hợp khí chlorine và hydrogen sẽ gây ra hiện tượng nổ
- Phương trình hóa học: H2 + Cl2 → 2HCl
b) Nếu thay khí chlorine bằng hơi iodine thì phản ứng giữa hơi iodine và hydrogen không xảy ra hiện tượng như trên.
- Giải thích: Phản ứng giữa H2 và I2 cần đun nóng để phản ứng diễn ra, là phản ứng thuận nghịch, tạo hỗn hợp gồm HI sinh ra và lượng H2, I2 còn lại. Khả năng phản ứng kém nên không có hiện tượng nổ
H2 + I2 \( \rightleftharpoons \) 2HI
CH tr 105 TH
|
- Thí nghiệm 1: + Nhỏ vào ống nghiệm khoảng 2 mL dung dịch sodium bromide hoặc potassium bromide loãng. + Nhỏ tiếp vào ống nghiệm vài giọt nước chlorine và lắc nhẹ + Có thể tiếp tục nhỏ vào ống nghiệm khoảng 2 mL cyclohexane - Thí nghiệm 2: + Nhỏ vào ống nghiệm khoảng 2 mL dung dịch sodium iodide hoặc potassium iodide loãng + Nhỏ tiếp vào ống nghiệm vài giọt nước bromine loãng và lắc nhẹ. Có thể thêm tiếp vào ống nghiệm khoảng 2 mL cyclohexane + Thêm tiếp vào ống nghiệm vài giọt hồ tinh bột Giải thích các hiện tượng xảy ra và minh họa bằng phương trình hóa học |
Phương pháp giải:
Trong dung dịch, các halogen có tính oxi hóa mạnh hơn sẽ phản ứng với muối halide của halogen có tính oxi hóa yếu hơn để tạo ra các halogen có tính oxi hóa yếu hơn
Lời giải chi tiết:
- Thí nghiệm 1:
+ Khi cho nước chlorine màu vàng rất nhạt vào dung dịch sodium bromide không màu thì tạo ra dung dịch màu vàng nâu của bromine:
Cl2(aq) + 2NaBr(aq) → 2NaCl(aq) + Br2(aq)
+ Khi nhỏ 2 mL cyclohexane vào ống nghiệm, quan sát thấy màu vàng nâu của bromine nhạt dần do bromine tham gia phản ứng với cyclohexane:
Br2 + C6H12 → HBr + C6H11Br
- Thí nghiệm 2:
+ Khi cho nước bromine màu vàng vào dung dịch sodium iodine không màu thì tạo ra dung dịch màu vàng:
Br2(aq) + 2NaI(aq) → 2NaBr(aq) + I2(aq)
+ Khi cho thêm 2 mL cyclohexane thấy màu dung dịch nhạt dần do bromine tham gia phản ứng với cyclohexane:
Br2 + C6H12 → HBr + C6H11Br
+ Khi thêm tiếp vài giọt hồ tinh bột thì thấy dung dịch từ màu vàng chuyển sang màu xanh tím do iodine tác dụng với hồ tinh bột
CH tr 105 CH
| Giả sử có thí nghiệm sau: Nhỏ nhanh vài giọt bromine màu nâu đỏ vào ống nghiệm chứa nước, đậy kín, lắc đều. Trong dung dịch bromine có những chất nào? Vì sao? |
Phương pháp giải:
Phản ứng hóa học: Br2(aq) + H2O(l) \( \rightleftharpoons \) HBr(aq) + HBrO(aq)
Lời giải chi tiết:
Sau khi nhỏ nhanh vài giọt bromine vào ống nghiệm chứa nước, dung dịch bromine có những chất: Br2, H2O, HBr, HBrO.
Br2(aq) + H2O(l) \( \rightleftharpoons \) HBr(aq) + HBrO(aq)
- Vì phản ứng xảy ra thuận nghịch nên trong dung dịch có cả chất tham gia và chất sản phẩm
CH tr 106 TH
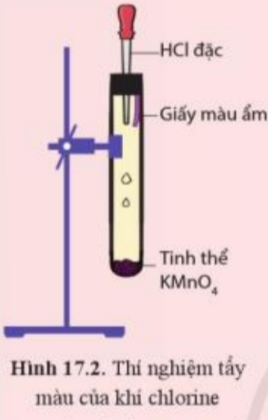
| Thí nghiệm tính tẩy màu của khí chlorine.
Chuẩn bị thí nghiệm như hình 17.2
Bóp nhẹ phần cao su của ống nhỏ giọt để dung dịch hydrochloric acid chảy xuống ống nghiệm. Quan sát các hiện tượng xảy ra và giải thích. |
Phương pháp giải:
- Phản ứng tạo ra khí chlorine, khí chlorine kết hợp với nước tạo ra dung dịch có tính tẩy màu
Lời giải chi tiết:
- Hiện tượng: Xuất hiện khí màu vàng và giấy màu ẩm bị nhạt màu dần rồi mất màu
- Giải thích:
+ Khi nhỏ HCl đặc vào tinh thể KMnO4, sản phẩm tạo thành có khí chlorine:
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2 + 8H2O
+ Khí chlorine tác dụng với nước ở giấy màu ẩm tạo thành hỗn hợp có tính tẩy màu: HCl và HClO
Cl2(aq) + H2O(l) \( \rightleftharpoons \) HCl(aq) + HClO(aq)
=> Dung dịch này còn được gọi là dung dịch nước chlorine, có tính tẩy màu, sát khuẩn
CH tr 106 VD
| Hãy giải thích vì sao các halogen không tồn tại tự do trong tự nhiên |
Phương pháp giải:
Halogen là những chất oxi hóa mạnh
Lời giải chi tiết:
- Halogen là những chất oxi hóa mạnh, dễ dàng tác dụng với các chất khác trong tự nhiên: tác dụng với nước, hydrogen,…
=> Trong tự nhiên, các halogen không tồn tại ở dạng đơn chất mà tồn tại ở dạng hợp chất
Bài tập 1
|
Bài 1. Hãy viết phương trình hóa học để chứng minh chlorine có tính oxi hóa mạnh hơn bromine |
Phương pháp giải:
Các halogen có tính oxi hóa mạnh hơn sẽ phản ứng với muối halide của halogen có tính oxi hóa yếu hơn để tạo ra các halogen có tính oxi hóa yếu hơn
Lời giải chi tiết:
Cl2 + 2NaBr → 2NaCl + Br2
=> Cl2 có tính oxi hóa mạnh hơn sẽ phản ứng với NaBr tạo thành halogen có tính oxi hóa yếu hơn là Br2
=> Chlorine có tính oxi hóa mạnh hơn bromine
Bài tập 2
|
Bài 2. Trong công nghiệp, dung dịch sodium chlorine được đem điện phân để có phản ứng theo phương trình hóa học sau: NaCl (aq) + H2O (l) → A (aq) + X (g) + Y (g) (*) Từ phản ứng giữa Y với dung dịch A sẽ sản xuất được hỗn hợp tẩy rửa phổ biến. Từ phản ứng kết hợp giữa X và Y sẽ sản xuất được hydrogen chlorine a) Hãy cho biết công thức hóa học của A, X, Y b) Hoàn thành phương trình hóa học (*) |
Phương pháp giải:
- Chất tẩy rửa phổ biến là nước Javel: NaCl và NaClO
- Để sản xuất được hydrogen chloride cần: Cl2 và H2
Lời giải chi tiết:
- Chất tẩy rửa phổ biến là nước Javel gồm có NaCl và NaClO
=> Hai chất tác dụng với nhau để tạo thành nước Javel là: NaOH và Cl2
- Vì A ở dạng dung dịch, Y ở dạng khí
=> A là dung dịch NaOH, Y là khí Cl2
- Để sản xuất được hydrogen chloride cần: Cl2 và H2
- Mà Y là khí Cl2
=> X là khí H2
a) Công thức hóa học của A, X, Y lần lượt là: NaOH, H2, Cl2
b) Phương trình hóa học
2NaCl (aq) + 2H2O (l) → 2NaOH (aq) + H2 (g) + Cl2 (g) (*)
Bài tập 3
|
Bài 3. Astatine là nguyên tố phóng xạ, được xếp dưới nguyên tố iodine trong nhóm VIIA. Thực tế, các nhà khoa học chỉ thu được đồng vị bền của astatine từ quá trình nghiên cứu về phóng xạ, đồng thời nó chỉ tồn tại khoảng 8 giờ Dựa vào xu hướng biến đổi một số tính chất của nhóm halogen, hãy dự đoán: a) Tính oxi hóa của nguyên tử astatine mạnh hơn hay yếu hơn so với nguyên tử iodine? b) Đơn chất astatine có màu đậm hơn hay nhạt hơn so với đơn chất iodine? |
Phương pháp giải:
- Trong nhóm halogen, đi từ F đến I, tính oxi hóa giảm dần
- Trong nhóm halogen, đi từ F đến I, màu sắc đậm dần
Lời giải chi tiết:
a) Trong nhóm halogen, đi từ F đến I có độ âm điện giảm dần
=> Tính oxi hóa giảm dần
=> Tính oxi hóa của nguyên tử astatine yếu hơn so với nguyên tử iodine
b) Trong nhóm halogen, đi từ F đến I có màu sắc của các đơn chất đậm dần
=> Đơn chất astatine có màu đậm hơn so với đơn chất iodine
Bài tập 4
|
Bài 4. Tra cứu các giá trị năng lượng liên kết ở phụ lục 2 a) Hãy tính biến thiên enthalpy chuẩn ∆rH0298 của 2 phản ứng dưới đây: F2(g) + H2(g) → 2HF (g) O2(g) + 2H2(g) → 2H2O(g) b) Ở hai phản ứng trên, fluorine và oxygen đều đóng vai trò là chất oxi hóa. Dựa vào giá trị ∆rH0298, cho biết phản ứng oxi hóa – khử nào thuận lợi hơn |
Phương pháp giải:
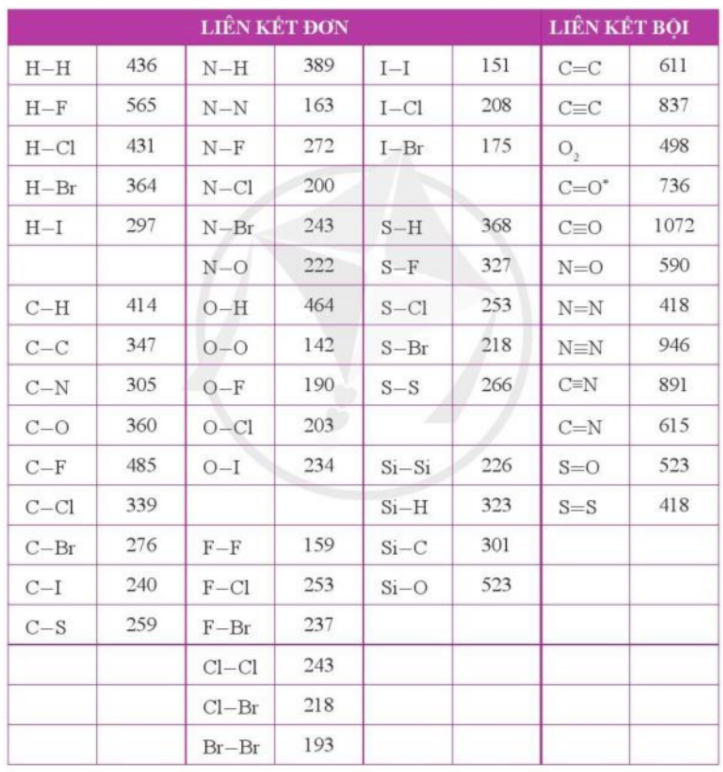
a)
∆rH0298 = Eb(F2) + Eb(H2) – 2xEb(HF)
∆rH0298 = Eb(O2) + 2xEb(H2) – 2x2xEb(OH)
b)
Giá trị biến thiên enthalpy nào âm hơn thì phản ứng đó diễn ra thuận lợi hơn
Lời giải chi tiết:
a)
- Xét phản ứng: F2(g) + H2(g) → 2HF (g)
+ Ta có: ∆rH0298 = Eb(F2) + Eb(H2) – 2xEb(HF) = 159 + 436 – 2x565 = -535 (kJ/mol)
- Xét phản ứng: O2(g) + 2H2(g) → 2H2O(g)
+ Ta có: ∆rH0298 = Eb(O2) + 2xEb(H2) – 2x2xEb(OH) = 142 + 2x436 – 2x2x464 = -842 (kJ/mol)
b)
Giá trị biến thiên enthalpy của phản ứng (2) âm hơn giá trị biến thiên enthalpy của phản ứng (1)
=> Phản ứng oxi hóa – khử (2) diễn ra thuận lợi hơn
Bài tập 5
|
Bài 5. Một trong những ứng dụng của chlorine trong đời sống là khử trùng nước sinh hoạt tại các nhà máy xử lí và cấp nước. Trong quá trình khử trùng, người ta phải cho một lượng chlorine dư vào nước sinh hoạt. Lượng chlorine dư trong nước sinh hoạt còn có tác dụng ngăn ngừa sự tái nhiễm của vi khuẩn trong quá trình phân phối trong đường ống dẫn nước và trữ nước tại nhà. Theo quy chuẩn kĩ thuật quốc gia (QCVN 01 – 1: 2018/BYT), hàm lượng chlorine tự do đối với nước sạch sử dụng cho mục đích sinh hoạt từ 0,2 – 1 mgL-1. Nếu hàm lượng chlorine nhỏ hơn 0,2 – 1 mgL-1 thì không tiêu diệt hết vi khuẩn và không xử lí được hết chất hữu cơ. Ngược lại, lượng chlorine trong nước lớn hơn 1,0 mgL-1 sẽ gây dị ứng Carbon trong than hoạt tính sẽ tương tác trực tiếp với chlorine, giúp loại bỏ chlorine và các hợp chất chlorine và các hợp chất chlorine bằng cơ chế hấp thụ bề mặt. Khi chiếu tia cực tím với cường độ cao vào nước cũng làm giảm lượng chlorine. Các máy lọc nước RO (reverse osmosis: thẩm thấu ngược) cũng có thể giúp loại bỏ lượng chlorine trong nước một cách hiệu quả Hãy trả lời các câu hỏi sau đây: a) Dấu hiệu nào cho thấy chlorine có trong nước sinh hoạt b) Vì sao người ta cần cho chlorine đến dư vào nước sinh hoạt c) Cho biết một số phương pháp có thể loại bỏ khí chlorine dư trong nước sinh hoạt |
Phương pháp giải:
a) Chlorine có mùi xốc
b) Ngăn ngừa sự tái nhiễm của vi khuẩn
c) Tham khảo phần cuối của đoạn văn trên
Lời giải chi tiết:
a) Chlorine có mùi xốc, nên khi sử dụng nước sinh có chlorine, chúng ta sẽ ngửi thấy mùi của nước chlorine
b) Trong quá trình khử trùng, người ta phải cho một lượng chlorine dư vào nước sinh hoạt. Lượng chlorine dư trong nước sinh hoạt còn có tác dụng ngăn ngừa sự tái nhiễm của vi khuẩn trong quá trình phân phối trong đường ống dẫn nước và trữ nước tại nhà
c) Một số phương pháp để loại bỏ khí chlorine dư trong nước sinh hoạt:
- Sử dụng máy lọc nước than hoạt tính
- Phơi chậu nước ra ngoài ánh nắng mặt trời => Tia cực tím với cường độ cao vào nước cùng làm giảm lượng chlorine
- Sử dụng máy lọc nước RO (thẩm thấu ngược) cũng có thể giúp loại bỏ lượng chlorine trong nước













Danh sách bình luận