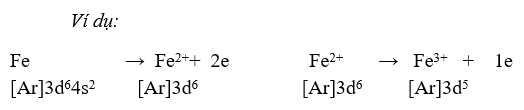
1. Số oxi hoá của nguyên tử kim loại chuyển tiếp dãy thứ nhất trong hợp chất
Do có nhiều electron hoá trị (ở phân lớp 4s và 3d) nên các nguyên tố chuyển tiếp dãy thứ nhất có khả năng tạo ra các hợp chất với nhiều trạng thái oxi hoá khác nhau.
|
Nguyên tử |
Cr |
Mn |
Fe |
Cu |
|
Số oxi hoá |
+3 (Cr2O3) +6 (K2CrO4, K2Cr2O7) |
+2 (MnO) +4 (MnO2) +7 (KMnO4) |
+2 (FeO) +3 (Fe2O3) |
+2 (CuO) +1 (Cu2O) |
Khi tham gia phản ứng hoá học, nguyên tử kim loại chuyển tiếp dãy thứ nhất ưu tiên nhường electron ở phân lớp 4s trước rồi đến electron ở phân lớp 3d, tạo thành các cation tương ứng.
2. Màu sắc của các ion kim loại chuyển tiếp dãy thứ nhất
Đặc tính có màu của một số ion kim loại chuyển tiếp.
Một số hợp chất của kim loại chuyển tiếp có màu là do chuyển dịch electron d -d, chuyển phổ điện tích (trường hợp MnO4-, Cr2O72-,..) hoặc do phân cực hoá (AgCl, AgBr, AgI,…). Hợp chất có màu sắc là do hấp thụ bước sóng trong vùng ánh sáng nhìn thấy (bước sóng 380 nm – 740 nm). Tần số của ánh sáng bị hấp thụ phụ thuộc phối tử, số oxi hoá của kim loại chuyển tiếp và kích thước của ion kim loại. Nhiều ion nguyên tố chuyển tiếp khi electron của phân lớp d đầy đủ hoặc không có electron ở phân lớp d thường tạo hợp chất không có màu (ví dụ Zn2+, Sc3+,…)
3. Chuyển dịch electron d-d
Ví dụ giải thích màu sắc của dung dịch Ti3+ (3d1)
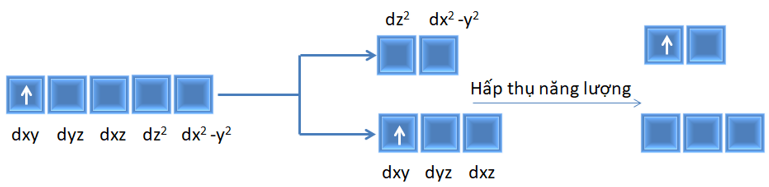
Electron độc thân hấp thụ năng lượng ánh sáng chuyển dịch từ mức năng lượng thấp đến mức năng lượng cao.
4. Chuyển phổ điện tích
Ví dụ trường hợp Cu2O, KMnO4, K2Cr2O7, K2CrO4,… có cấu hình của ion trung tâm d0 và d10 được giải thích thông qua chuyển phổ điện tích từ ion trung tâm đến phối tử (Cu2O) hoặc từ phối tử đến ion trung tâm (MnO4-, Cr2O72-, …)
5. Phân cực hoá
Ví dụ trường hợp AgCl, AgBr, AgI có thể giải thích do kích thước của anion, sự phân cực của halide.


6. Thí nghiệm xác định hàm lượng muối Fe(II) bằng dung dịch thuốc tím
a) Nguyên tắc: Sử dụng dung dịch chuẩn KMnO4 để xác định nồng độ Fe2+ trong dung dịch trong môi trường acid: MnO4- + 5Fe2+ + 8H+ → 5Fe3+ + Mn2+ + 4H2O
Tỉ lệ số mol MnO4-: Fe2+ là 1 : 5.
b) Các bước tiến hành
Bước 1: Cho V mL dung dịch Fe2+ vào bình nón (bình Erlenmeyer), acid hoá bằng dung dịch H2SO4 loãng.
Bước 2: Cho dung dịch chuẩn KMnO4 vào burette, điều chỉnh thể tích đến vạch định mức của burette. Xác nhận vạch thể tích ban đầu.
Bước 3: Tiến hành chuẩn độ dung dịch Fe2+ trong bình nón. Dừng chuẩn độ khi dung dịch xuất hiện màu hơi hồng do giọt KMnO4 dư đầu tiên. Xác nhận thể tích kết thúc chuẩn độ ở burette.
Bước 4: Tiến hành lặp lại chuẩn độ nhiều lần, độ chênh lệch thể tích giữa những lần chuẩn độ không quá lớn.
7. Thí nghiệm kiểm tra sự có mặt từng ion riêng biệt: Cu2+, Fe3+
Khi nồng độ Cu2+, Fe3+ rất thấp trong dung dịch thì có thể sử dụng các phương pháp phân tích phổ như tạo phức chất có màu để phân tích trắc quang, sử dụng phổ hấp thụ nguyên tử, … có độ nhạy cao và giới hạn phát hiện thấp. Khi nồng độ Cu2+, Fe3+ cao có thể sử dụng một số dấu hiệu như tạo kết tủa, đổi màu của phản ứng tạo phức, phản ứng oxi hoá – khử, phản ứng tạo kết tủa hydroxide, …
8. Thí nghiệm tạo kết tủa
Dựa vào độ tan thấp của hydroxide
|
Na+, K+, Ba2+ |
Mg2+ |
Al3+ |
Zn2+ |
Cu2+ |
Fe2+ |
Fe3+ |
|
khó kết tủa hydroxide |
Mg(OH)2↓ trắng |
Al(OH)3↓ trắng |
Zn(OH)2↓ trắng |
Cu(OH)2↓ xanh |
Fe(OH)2↓ lục nhạt |
Fe(OH)3↓ nâu đỏ |
Lưu ý: Al(OH)3, Zn(OH)2 dễ tan trong OH- dư của dung dịch kiềm mạnh.
9. Thí nghiệm oxi hoá – khử
Khi cho muối I- vào dung dịch Cu2+ thu được kết tủa (sử dụng để phân tích định lượng Cu2+ trong dung dịch): 2Cu2+ + 4I- → 2CuI + I2
Muối I- cũng có phản ứng oxi hoá – khử với dung dịch Fe3+ (sử dụng hồ tinh bột để nhận ra I2 trong dung dịch): 2Fe3+ + 2I- → 2Fe2+ + I2
Ngoài ra, một số muối sulfur tan (S2-) tạo kết tủa màu đen với Cu2+, xảy ra phản ứng oxi hoá khử với Fe3+.
10. Thí nghiệm tạo phức
Trong môi trường acid, Fe3+ tạo kết tủa keo xanh phổ (Prussian blue) khi sử dụng thuốc thử K4[Fe(CN)6]: Fe3+ + [Fe(CN)6]4- → Fe4[Fe(CN)6]3
Cu2+ tạo phức đỏ thẫm: Cu2+ + [Fe(CN)6]4- → Cu2[Fe(CN)6]
Thuốc thử KSCN tạo phức màu đỏ máu với Fe3+:
Fe3+ + SCN- → Fe(SCN)2+
Trong dung dịch, khi bỏ qua liên kết phối trí với nước, chỉ xét phối tử SCN- có tồn tại khoảng 6 loại sau: [Fe(SCN)]2+; [Fe(SCN)2]+; [Fe(SCN)3]; [Fe(SCN)4]-; [Fe(SCN)5]2-; [Fe(SCN)6]3-. Xét cân bằng chủ yếu tạo phức Fe(SCN)2+.
Trong một số thí nghiệm, cho KSCN vào dung dịch CuSO4 thu được kết tủa đen.
Dung dịch NH3 dư tạo phức xanh thẫm với Cu2+ và tạo kết tủa nâu đỏ với Fe3+.

 Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức ch..
Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức ch.. 






Danh sách bình luận