1. Phản ứng thuận nghịch là gì?
Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong cùng điều kiện
\(aA + bB \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} cC + dD\)
2. Trạng thái cân bằng là gì?
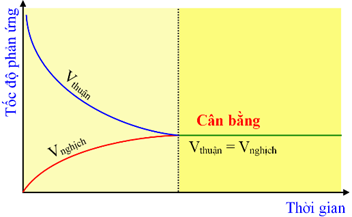
Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch (vt = vn)
- Cân bằng hoá học là một cân bằng động: Tại trạng thái cân bằng phản ứng thuận và phản ứng nghịch vẫn xảy ra với tốc độ bằng nhau. Nồng độ các chất tại trạng thái cân bằng không đổi.
3. Biểu thức của hằng số cân bằng
Xét phản ứng thuận nghịch tổng quát: \(aA + bB \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} cC + dD\)
Ở trạng thái cân bằng, hằng số cân bằng (KC) tính theo công thức: \({K_C} = \frac{{{{{\rm{[}}C{\rm{]}}}^c}.{{{\rm{[}}D{\rm{]}}}^d}}}{{{{{\rm{[}}A]}^a}.{{{\rm{[}}B{\rm{]}}}^b}}}\)
Trong đó: + [A], [B], [C], [D] là nồng độ các chất ở trạng thái cân bằng.
+ a, b, c, d là hệ số tỉ lượng trong phương trình
+ Đối với phản ứng có chất rắn tham gia, không biểu diễn nồng độ chất rắn trong biểu thức tính hằng số cân bằng.
- KC chỉ phụ thuộc vào nhiệt độ và bản chất của phản ứng, đối với chất rắn xem như nồng độ bằng 1.
4. Ý nghĩa của hằng số cân bằng
KC càng lớn thì phản ứng thuận càng chiếm ưu thế hơn và ngược lại. KC càng nhỏ thì phản ứng nghịch càng chiếm ưu thế
Tại thời điểm cân bằng hoá học thì:
- Phản ứng vẫn diễn ra với tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
- Nồng độ các chất không đổi, chứ không có bằng nhau.

 Cân bằng hoá học - Từ điển Hoá 11
Cân bằng hoá học - Từ điển Hoá 11 






Danh sách bình luận