1. Dạng 1: Tính hằng số cân bằng KC
Dạng 1: Tính hằng số cân bằng KC
Xét bài toán tổng quát với [A]; [B] ban đầu lần lượt là x và y
Xét phản ứng thuận nghịch:
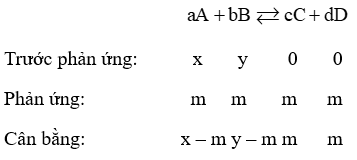
[A]; [B] tại thời điểm cân bằng lần lượt là: x – m và y – m
[C]; [D] tại thời điểm cân bằng là m
\({K_C} = \frac{{{{{\rm{[}}C{\rm{]}}}^c}.{{{\rm{[}}D{\rm{]}}}^d}}}{{{{{\rm{[}}A]}^a}.{{{\rm{[}}B{\rm{]}}}^b}}}\)= \(\frac{{{m^c}.{m^d}}}{{{{(x - m)}^a}.{{(y - m)}^b}}}\)
Xét phản ứng: H2 + I2 \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) 2HI
KC = \(\frac{{{{(0,786)}^2}}}{{0,107.0,107}} = 53,96\)
2. Dạng 2: Tính nồng độ các chất ở trạng thái cân bằng dựa vào KC của phản ứng
Đây là bài toán ngược so với dạng 1, để làm bài toán này, thông thường sẽ xét 3 bước của phản ứng: trước phản ứng; phản ứng và cân bằng. Sau đó sẽ đặt ẩn [A] hoặc [B] khi phản ứng từ đó viết biểu thức KC và giải ẩn đã đặt.
Ví dụ: Cho 5,6 gam CO và 5,4 gam H2O vào một bình kín dung tích không đổi 10 lít. Nung nóng bình một thời gian ở 8300C để hệ đạt đến trạng thái cân bằng: CO (g) + H2O (g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) CO2 (g) + H2 (g) (hằng số cân bằng KC = 1). Nồng độ cân bằng của CO, H2O lần lượt là bao nhiêu?
Bước 1: Tính số mol CO và H2O
n CO = 5,6 : 28 = 0,2 mol; n H2O = 5,4 : 18 = 0,3 mol
Bước 2: Tính nồng độ CO và H2O
[CO] = 0,2 : 10 = 0,02M; [H2O] = 0,3 : 10 = 0,03M
Bước 3: Đặt [CO] phản ứng = aM
Xét phản ứng thuận nghịch:

Bước 4: Xét biểu thức hằng số cân bằng KC, giải phương trình tìm ẩn a.
KC = \(\frac{{{\rm{[}}C{O_2}{\rm{]}}.{\rm{[}}{H_2}{\rm{]}}}}{{{\rm{[}}CO].{\rm{[}}{H_2}O]}} = \frac{{a.a}}{{(0,02 - a).(0,03 - a)}} = 1\)→ a = 0,012M
Tại thời điểm cân bằng: [CO] = 0,02 – 0,012 = 0,008M; [H2O] = 0,03 – 0,012 = 0,018M

 Cân bằng hoá học - Từ điển Hoá 11
Cân bằng hoá học - Từ điển Hoá 11 






Danh sách bình luận