1. Hình dạng Orbital nguyên tử
Dựa vào sự khác nhau về hình dạng, sự định hướng của orbital trong nguyên tử đề phân loại thành các orbital sau:
|
Loại AO |
Hình dạng |
|
AO s |
Hình cầu |
|
AO p |
Hình số 8 nổi được phân bố theo các trục của hệ toạ độ Descartes (Đề - các) |
|
AO pX (Vị trí AO p phân bố trên trục Ox) |
|
|
AO py (Vị trí AO p phân bố trên trục Oy) |
|
|
AO pz (Vị trí AO p phân bố trên trục Oz) |
|
|
AO d ,f |
Có hình dạng phức tạp. |
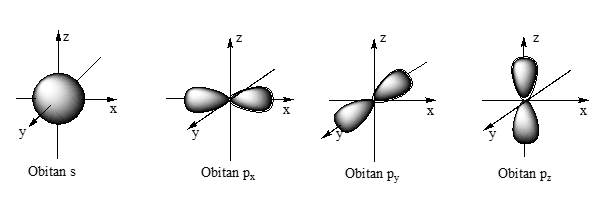
Hình dạng của orbital s và p
2. Ô orbital
Một AO được biểu diễn bằng một ô vuông, gọi là ô orbital
Một AO chứa tối đa 2 electron 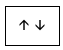 => 2 electron này gọi là cặp electron ghép đôi.
=> 2 electron này gọi là cặp electron ghép đôi.
Nếu AO chứa 1 electron 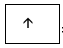 => 1 electron này gọi là electron độc thân.
=> 1 electron này gọi là electron độc thân.
Nếu AO không chứa electron nào  => gọi là AO trống.
=> gọi là AO trống.

 Cấu tạo nguyên tử - Từ điển Hoá 10
Cấu tạo nguyên tử - Từ điển Hoá 10 






Danh sách bình luận