1. Cấu hình electron của nguyên tử
Cấu hình electron của nguyên tử biểu diễn sự phân bố electron vào lớp vỏ nguyên tử theo các lớp và phân lớp.
2. Cách viết cấu hình electron
|
Trước tiên xác định số e (Z) cần viết |
|
|
*Z ≤ 20 : viết 1 dòng Điền các e theo thứ tự: 1s2s2p3s3p4s ( trước phân lớp cuối thì điền s2, p6 , phân lớp cuối còn lại bao nhiêu e thì điền bấy nhiêu e). |
*Z > 20 : viết 2 dòng Năng lượng: 1s2s2p3s3p4s3d4p5s.... Cấu hình e: 1s2s2p3s3p3d4s4p5s.... Lưu ý: - d4 → d5 (bán bão hoà sớm) lấy 1e của 4s - d9 → d10 ( bão hoà sớm) lấy 1e của 4s |
3. Biểu diễn cấu hình electron theo ô orbital
- Viết cấu hình electron nguyên tử.
- Biểu diễn mỗi AO là một ô vuông, các AO cùng một phân lớp viết liền nhau, các AO khác phân lớp viết tách nhau.
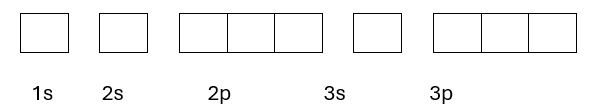
- Mỗi một e biểu diễn bằng một mũi tên và điền từ trái sang phải và theo yêu cầu:
+ Trong 1AO e đầu tiên biểu diễn bằng mũi tên quay lên.
+ 1 AO chứa tối đa 2 electron có chiều ngược nhau (Nguyên lí Pauli).
+ Trong mỗi phân lớp e được phân bố sao cho số e độc thân là tối đa (Quy tắc Hund).
4. Đặc điểm lớp electron ngoài cùng
|
Số e lớp ngoài cùng |
1,2,3 e |
4e |
5,6,7 e |
8e (He 2e) |
|
Loại nguyên tố |
KL(-H, He, B). |
KL hoặc PK |
PK |
Khí hiếm |

 Cấu tạo nguyên tử - Từ điển Hoá 10
Cấu tạo nguyên tử - Từ điển Hoá 10 






Danh sách bình luận