1. Lớp electron
Các electron trên cùng một lớp có năng lượng gần bằng nhau.
Kể từ phía hạt nhân ra có các lớp e sau:
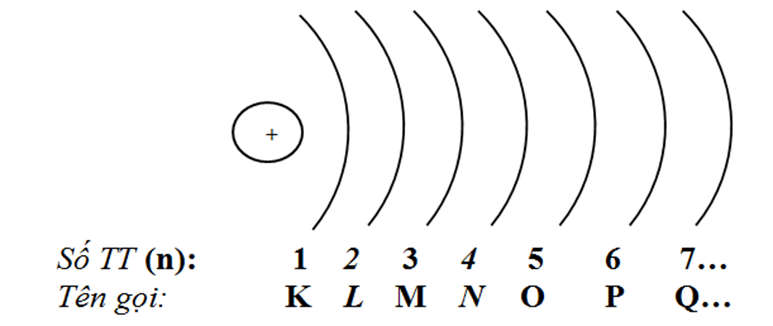
→ Lớp e càng gần hạt nhân có năng lượng càng thấp => lớp K có năng lượng thấp nhất (e ở lớp này bị giữ chặt nhất).
2. Phân lớp electron
Trên mỗi lớp e lại được chia thành các phân lớp: các e trên cùng phân lớp có năng lượng bằng nhau.
- Các phân lớp được kí hiệu bằng chữ cái thường: s, p, d, f (theo tứ tự năng lượng: s<p<d<f).
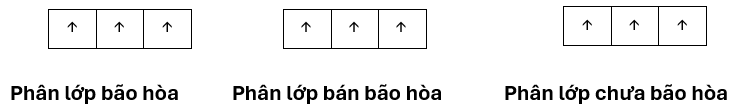
- Số e tối đa trên mỗi phân lớp: s2, p6,d10, f14 => phân lớp bão hoà.
* Phân lớp chứa một nửa số electron tối đa: s1, p3,d5, f7 => phân lớp bán bão hoà.
* Phân lớp chứa chưa đủ số electron tối đa: p4,d7, f10....=> phân lớp chưa bão hoà.
- Lớp thứ n thì có n phân lớp và kí hiệu là ns, np, nd, nf...
Phân lớp s có 1 AO : 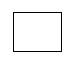
Phân lớp p có 3AO : 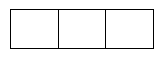
Phân lớp d có 5AO: 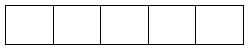
Phân lớp f có 7AO: 
* Tổng kết số AO, số e tối đa trên lớp và phân lớp:
|
Lớp (n) |
K(n=1) |
L (n=2) |
M(n=3) |
N(n=4) |
|
Số phân lớp |
1( 1s) |
2(2s2p) |
3(3s3p3d) |
4(4s4p4d4f) |
|
Số AO = n2 (n\( \le \) 4) |
1 |
4 |
9 |
16 |
|
Số e tối đa = 2n2(n\( \le \) 4) |
2 |
8 |
18 |
32 |

 Cấu tạo nguyên tử - Từ điển Hoá 10
Cấu tạo nguyên tử - Từ điển Hoá 10 






Danh sách bình luận