1. Sodium chloride
- Ứng dụng:
+ Trong đời sống: gia vị, bảo quản và chế biến thực phẩm,…
+ Trong y học: nước muối sinh lí, chất điện giải,…
+ Trong công nghiệp hoá chất: sản xuất chlorine - kiềm, nước Javel, soda…
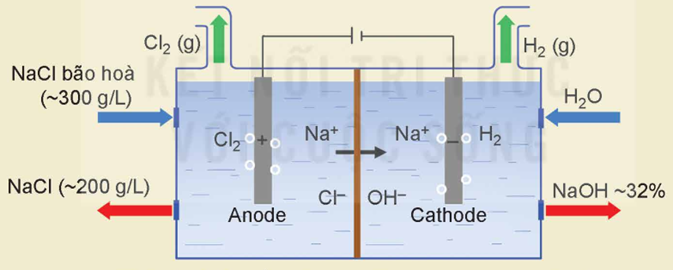
- Quá trình điện phân dung dịch NaCl:
+ Ở cực âm (cathode) xảy ra quá trình khử: 2H2O + 2e → H2 + 2OH-
+ Ở cực dương (anode) xảy ra quá trình oxi hoá: 2Cl- → Cl2 + 2e
+ Phương trình hoá học của phản ứng điện phân:
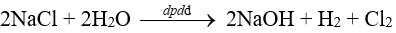
- Trong công nghiệp chlorine - kiềm, quá trình điện phân dung dịch NaCl bão hoà có màng ngăn điện cực được ứng dụng để sản xuất xút công nghiệp (NaOH), khí chlorine (Cl2).
- Điện phân dung dịch NaCl bão hoà không có màng ngăn điện cực được ứng dụng để sản xuất nước Javel (chứa NaClO).
2. Tìm hiểu các sản phẩm cơ bản của công nghiệp chlorine – kiềm
+ Sodium hydroxide còn gọi là “xút” được sử dụng trong sản xuất dược phẩm, hoá chất, dệt và nhuộm màu; công nghiệp sản xuất giấy; sản xuất tơ nhân tạo, chất giặt tẩy; chế biển thực phẩm; dầu khí; xử lí nước,...
+ Chlorine thường dùng trong khử trùng nước sinh hoạt, hồ bơi, tẩy trắng vải, sợi, bột giấy, điều chế nhựa PVC, chất dẻo, cao su, chất màu, sản xuất chất chống nấm mốc, diệt côn trùng, sản xuất dược phẩm, ...
+ Hydrogen sử dụng như một nhiên liệu hay hoá chất để tổng hợp ammonia, methanol, hydrochloric acid,...
3. Sodium hydrogencarbonate
- Công thức: NaHCO3: sodium bicarbonate = baking soda
- Tính chất
+ Là chất rắn màu trắng, bền ở nhiệt độ thường, bị phân huỷ khi đun nóng.
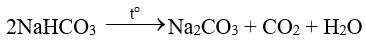
+ NaHCO3 có thể tác dụng được với dung dịch acid và dung dịch kiềm:
NaHCO3 + HCl → NaCl + H2O + CO2
NaHCO3 + NaOH → Na2CO3 + H2O
- Ứng dụng
+ Trong thực phẩm: bột nở.
+ Sản xuất thuỷ tinh,...
+ Trong y học: NaHCO3 được sử dụng để làm giảm chứng đau dạ dày do dư acid, điều trị các triệu chứng viêm loét dạ dày hoặc tá tràng.
4. Sodium carbonate
- Công thức: Na2CO3: soda
- Tính chất:
+ Là chất rắn màu trắng, dễ tan trong nước, bền với nhiệt.
+ Na2CO3, bị thuỷ phân trong dung dịch cho môi trường kiểm:
\(N{a_2}C{O_3} \to 2N{a^ + } + CO_3^{2 - }\)
\(CO_3^{2 - }\)+ H2O \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)\(O{H^ - }\) + \(HCO_3^ - \)
+ Tác dụng với acid, muối, base sau phản ứng phải có chất khí hoặc kết tủa.
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
Na2CO3 + Ba(OH)2 → BaCO3 ↓ + 2NaOH
Na2CO3 + CaCl2 → CaCO3 + 2NaCl
Na2CO3 + 2FeCl3 + 3H2O → Fe(OH)3 + 3CO2 + 6NaCl
- Ứng dụng:
+ Nguyên liệu sản xuất thuỷ tinh, xà phòng, bột giặt, giấy, sợi, chất tẩy rửa,…
+ Xử lí, làm mềm nước cứng, điều chế các muối khác,…
+ Tác nhân tẩy sạch vết dầu mỡ trên các chi tiết máy trước khi sơn, hàn, mạ điện,…
5. Phương pháp Solvay
Phương pháp Solvay (mang tên nhà hoá học Ernest Solvay) sử dụng nguồn nguyên liệu dễ tìm trong tự nhiên là muối ăn (NaCl), đá vôi (CaCO3) và ammonia (NH3).
Quá trình cụ thể:
(1) Hoà tan NaCl vào dung dịch NH3 đặc đến bão hoà.
(2) Nung CaCO3 rồi dẫn khí thoát ra vào dung dịch bão hoà của NaCl trong NH3:
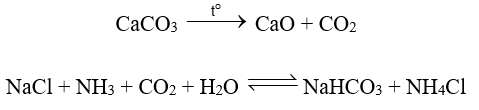
(3) Do NaHCO3 ít tan hơn các muối khác nên kết tinh trước. Tách NaHCO3 khỏi dung dịch, nung ở nhiệt độ cao, thu được soda:
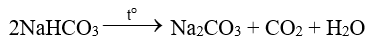
(4) Sản phẩm NH4Cl được chế hoá với vôi tôi, thu khí NH3:
2NH4Cl + Ca(OH)2 \( \to \) CaCl2 + 2NH3 + 2H2O
Các khí CO2, NH3 được đưa vào sử dụng lại. NH3 được tuần hoàn trong quá trình sản xuất, phương pháp này còn gọi là phương pháp tuần hoàn ammonia.
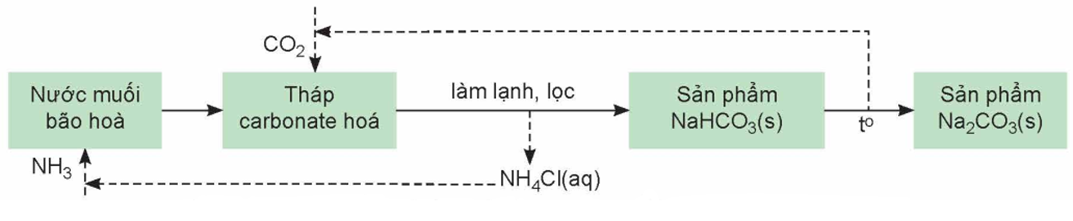
Sơ đồ quá trình Solvay để sản xuất NaHCO3 và Na2CO3

 Nguyên tố nhóm IA và nhóm IIA - Từ điển Hoá 12
Nguyên tố nhóm IA và nhóm IIA - Từ điển Hoá 12 






Danh sách bình luận