Lý thuyết bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
phản ứng tỏa nhiệt, phản ứng thu nhiệt, nhiệt tạo thành, biến thiên enthalpy, ý nghĩa của dấu và giá trị biến thiên enthalpy chuẩn
Lý thuyết: Biến thiên enthalpy trong các phản ứng hóa học
I. Phản ứng tỏa nhiệt
- Phản ứng tỏa nhiệt là phản ứng hóa học trong đó có sự giải phóng nhiệt năng ra môi trường
Ví dụ: Phương pháp nhiệt nhôm được dùng để hàn đường ray, phản ứng nhiệt nhôm tỏa nhiệt rất lớn
+ Ngoài ứng dụng là hàn đường ray, phản ứng nhiệt nhôm còn dùng để hàn nối các thanh kim loại đồng và hàn thép không gỉ, gang
II. Phản ứng thu nhiệt
- Phản ứng thu nhiệt là phản ứng hóa học trong đó có sự hấp thụ nhiệt năng từ môi trường
Ví dụ: Thả viên vitamin C sủi vào cốc nước, thấy cốc nước mát hơn

III. Biến thiên enthalpy chuẩn của phản ứng
1. Tìm hiểu về biến thiên enthalpy của phản ứng
- Biên thiên enthalpy của phản ứng (hay nhiệt phản ứng) được kí hiệu ∆rH, thường tính theo đơn vị kJ hoặc kcal
- Biến thiên enthalpy của phản ứng là lượng nhiệt tỏa ra hay thu vào của một phản ứng hóa học trong quá trình đẳng áp (áp suất không đổi)
- Biến thiên enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của một phản ứng hóa học, được kí hiệu là \({\Delta _r}H_{298}^o\), là nhiệt kèm theo phản ứng đó trong điều kiện chuẩn
- Điều kiện chuẩn: áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và ở nhiệt độ không đổi, thường chọn nhiệt độ 25oC (298 K)
2. Tìm hiểu về phương trình nhiệt hóa học
- Phản ứng thu nhiệt (hệ nhận nhiệt của môi trường) thì \({\Delta _r}H_{298}^o\) > 0
- Phản ứng tỏa nhiệt (hệ tỏa nhiệt ra môi trường) thì \({\Delta _r}H_{298}^o\) < 0
- Phương trình nhiệt hóa học là phương trình phản ứng hóa học có kèm theo nhiệt phản ứng và trạng thái của các chất đầu (cđ) và sản phẩm (sp)
IV. Enthalpy tạo thành (nhiệt tạo thành)
- Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất
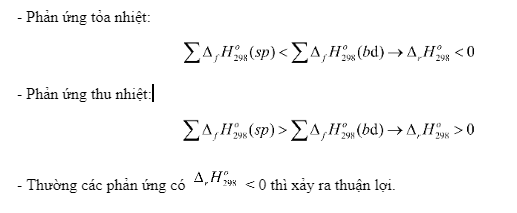

Luyện Bài Tập Trắc nghiệm Hóa 10 - Chân trời sáng tạo - Xem ngay
Các bài khác cùng chuyên mục
- Lý thuyết bài 18: Hydrogen halide và một số phản ứng của ion Halide
- Lý thuyết bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
- Lý thuyết bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
- Lý thuyết bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
- Lý thuyết bài 14: Tính biến thiên enthalpy của phản ứng hóa học
- Lý thuyết bài 18: Hydrogen halide và một số phản ứng của ion Halide
- Lý thuyết bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
- Lý thuyết bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
- Lý thuyết bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
- Lý thuyết bài 14: Tính biến thiên enthalpy của phản ứng hóa học













Danh sách bình luận