Lý thuyết bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Trạng thái tự nhiên, nhiệt độ sôi, nhiệt độ nóng chảy của halogen Tính chất hóa học, ứng dụng, điều chế
Lý thuyết: Nhóm Halogen
I. Vị trí của nhóm halogen trong bảng tuần hoàn
- Nhóm VIIA (nhóm halogen)
+ Fluorine: F
+ Chlorine: Cl
+ Bromine: Br
+ Iodine: I
+ Astatine: At
+ Tennessine: Ts
- 4 nguyên tố F, Cl, Br, I tồn tại trong tự nhiên còn At và Ts là nguyên tố phóng xạ
II. Trạng thái tự nhiên của các halogen
- Trong tự nhiên, halogen chỉ tồn tại ở dạng hợp chất, phần lớn ở dạng muối halide
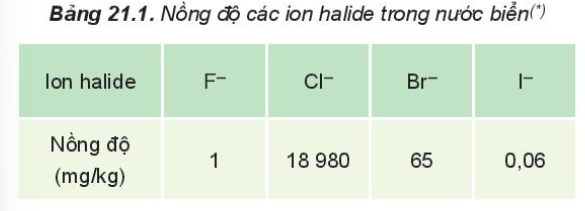
III. Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen. Đặc điểm cấu tạo phân tử halogen
- Lớp ngoài cùng của nguyên tử các nguyên tố halogen đều có 7 electron
+ Phân lớp s có 2 electron
+ Phân lớp p có 5 electron
=> Ở trạng thái tự do, 2 nguyên tử halogen góp chung 1 cặp electron để hình thành phân tử X2 với công thức câu tạo X – X
=> Đây là liên kết cộng hóa trị không phân cực
IV. Tính chất vật lí của các halogen
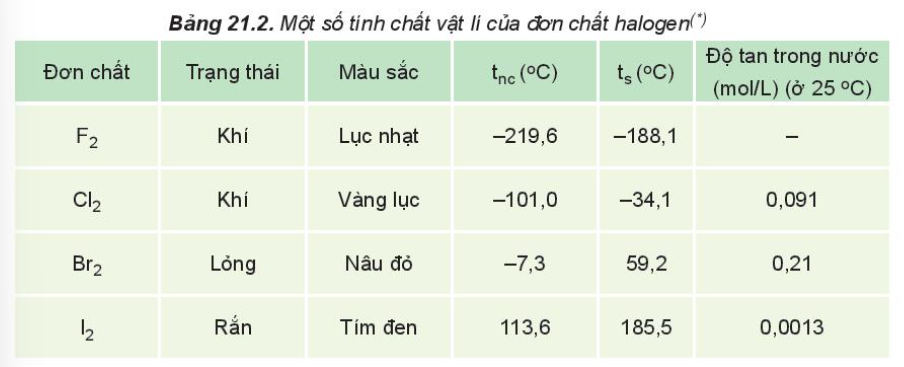
- Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do
+ Tương tác van der Waals giữa các phân tử tăng.
+ Khối lượng phân tử tăng
- Halogen tan ít trong nước nhưng tan nhiều trong dung môi hữu cơ
+ Trong y học, dung dịch iodine loãng trong ethanol được dùng làm thuốc sát trùng
- Bromine gây bỏng sâu khi tiếp xúc với da
- Hít thở không khí có chứa halogen làm tổn hại niêm mạc tế bào đường hô hấp
IV. Tính chất hóa học
- Halogen là phi kim điển hình, có tính oxi hóa mạnh, giảm dần từ F2 đến I2
1. Halogen + Kim loại → Muối halide
2Na + Cl2 \(\xrightarrow{{{t^o}C}}\) 2NaCl
2Fe + 3Cl2 \(\xrightarrow{{{t^o}C}}\) 2FeCl3

2. X2 + H2 → 2HX

- Mức độ phản ứng của halogen với H2 giảm dần khi đi từ F2 đến I2
3. Tác dụng với H2O
- F2 phản ứng mạnh với H2O ở điều kiện thường
2F2 + 2H2O → 4HF + O2
- Cl2 khi tan vào nước, 1 phần tác dụng với H2O
Cl2 + H2O ↔ HCl + HClO
=> HClO có tính oxi hóa mạnh nên Chlorine trong nước có khả năng diệt khuẩn, tẩy màu và được ứng dụng trong khử trùng nước sinh hoạt
4. Tác dụng với dung dịch kiềm
- Ở nhiệt độ thường:
Cl2 + 2NaOH → NaCl + NaClO + H2O
=> Nước Javel (chứa NaClO, NaCl và 1 phần NaOH dư) được làm chất tẩy rửa, khử trùng
- Khi đun nóng
3Cl2 + 6KOH \(\xrightarrow{{{t^o}C}}\) 5KCl + KClO3 + 3H2O
=> KClO3 là chất oxi hóa mạnh, được dùng để chế tạo thuốc nổ, hỗn hợp đầu que diêm…
5. Tác dụng với dung dịch halide
- Halogen có tính oxi hóa mạnh hơn sẽ đẩy X- ra khỏi muối
Ví dụ:
Cl2 + 2NaBr → 2NaCl + Br2
Br2 + 2NaI → 2NaBr + I2
- Trong công nghiệp, phản ứng giữa Cl2 và Br- đưuọc dùng để điều chế Br2 từ nước biển
V. Điều chế Cl2
1. Trong phòng thí nghiệm
- Từ MnO2 và HCl đặc
MnO2 + 4HCl (đặc) \(\xrightarrow{{{t^o}C}}\) MnCl2 + Cl2 + 2H2O
- Từ KMnO4 + HCl đặc
2KMnO4 + 16HCl(đặc) → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
2. Trong công nghiệp
- Điện phân dung dịch muối ăn có màng ngăn xốp

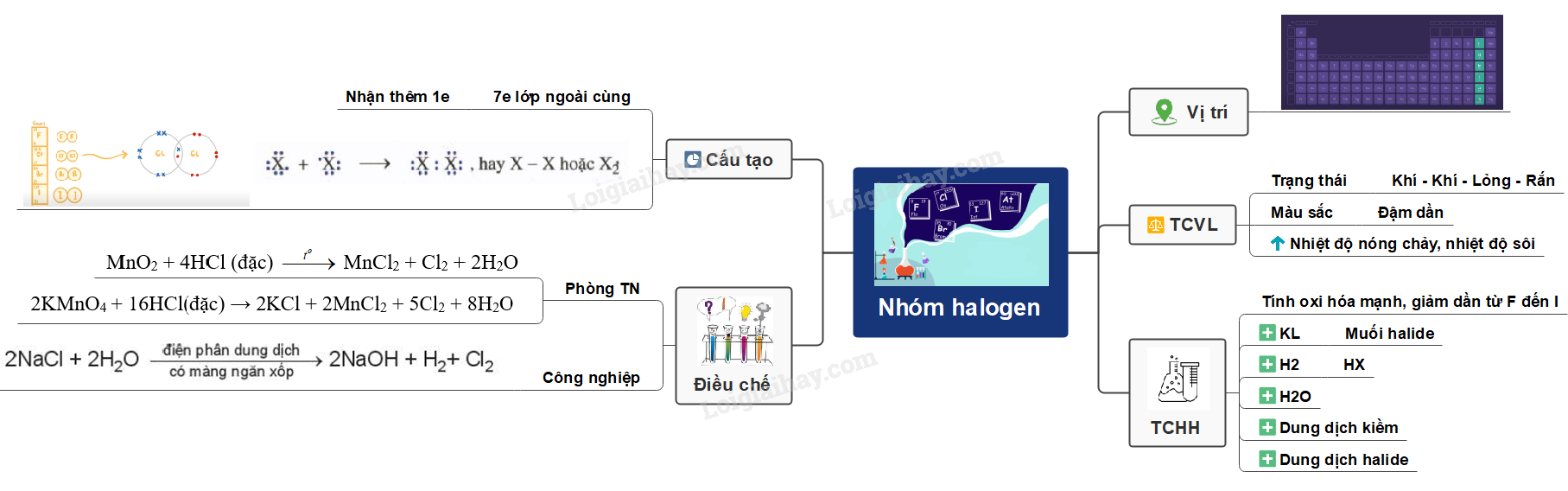
Sơ đồ tư duy:
Luyện Bài Tập Trắc nghiệm Hóa 10 - Chân trời sáng tạo - Xem ngay
Các bài khác cùng chuyên mục
- Lý thuyết bài 18: Hydrogen halide và một số phản ứng của ion Halide
- Lý thuyết bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
- Lý thuyết bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
- Lý thuyết bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
- Lý thuyết bài 14: Tính biến thiên enthalpy của phản ứng hóa học
- Lý thuyết bài 18: Hydrogen halide và một số phản ứng của ion Halide
- Lý thuyết bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
- Lý thuyết bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
- Lý thuyết bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
- Lý thuyết bài 14: Tính biến thiên enthalpy của phản ứng hóa học












Danh sách bình luận