Bài Ôn tập chương 7. Nguyên tố nhóm IA và IIA trang 121, 122 SBT Hóa 12 Chân trời sáng tạo
Cho dãy các kim loại: Li, Na, Al, Ca, K và Rb.
OT 7.1
Cho dãy các kim loại: Li, Na, Al, Ca, K và Rb. Số kim loại kiềm trong dãy là
A. 1 B. 2 C. 3 D. 4
Phương pháp giải:
Dựa vào vị trí của các nguyên tố trong bảng tuần hoàn.
Lời giải chi tiết:
Li, Na, K, Rb là các kim loại nhóm IA.
Đáp án D
OT 7.2
Cho các phát biểu sau:
(a) Tất cả các kim loại kiềm thổ đều tan trong nước.
(b) Các kim loại kiềm có thể đẩy được kim loại yếu hơn ra khỏi dung dịch muối của chúng.
(c) Các ion Na+, Mg2+, Al3+ có cùng cấu hình electron ở trạng thái cơ bản và đều có tính oxi hóa yếu.
(d) Các kim loại kiềm K, Rb, Cs tự bốc cháy khi tiếp xúc với nước.
(e) Kim loại magnesium có cấu trúc mạng tinh thể lục phương.
Trong các phát biểu trên số phát biểu đúng là
A. 2 B. 3 C. 4 D. 5
Phương pháp giải:
Dựa vào tính chất vật lí của kim loai IA, IIA.
Lời giải chi tiết:
(a) sai, vì Be không tan trong nước.
(b) sai, vì kim loại kiềm tan tốt trong nước nên không có tính chất này.
(c) đúng
(d) đúng
(e) đúng
Đáp án B
OT 7.3
Cho dãy chuyển hóa sau: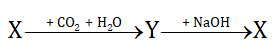 . Công thức của Y có thể là
. Công thức của Y có thể là
A. CaO B. Ca(OH)2 C. CaCO3 D. Ca(HCO3)2
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại IIA.
Lời giải chi tiết:
CaCO3 + CO2 + H2O → Ca(HCO3)2
Ca(HCO3)2 + 2NaOH → CaCO3 + 2NaHCO3 + H2O
hoặc Ca(HCO3)2 + 2NaOH → CaCO3 + Na2CO3 + 2H2O
Vậy Y là Ca(HCO3)2
Đáp án D
OT 7.4
Cách nào sau đây không thu được NaOH sau phản ứng?
A. Điện phân dung dịch NaCl không có màng ngăn xốp.
B. Cho kim loại Na tác dụng với nước.
C. Điện phân dung dịch NaCl có màng ngăn xốp, điện cực trơ.
D. Cho dung dịch Ca(OH)2 tác dụng với dung dịch Na2CO3.
Phương pháp giải:
Dựa vào Phương pháp điều chế kim loại.
Lời giải chi tiết:
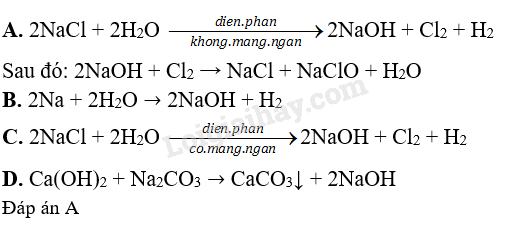
OT 7.5
Kim loại không phản ứng với nước ở nhiệt độ thường là
A. Be B. Ca C. Li D. K
Phương pháp giải:
Dựa vào tính chất hóa học của nguyên tố IA, IIA.
Lời giải chi tiết:
Be không phản ứng với nước ở nhiệt độ thường.
Đáp án A
OT 7.6
Để xử lí chất thải có tính acid người ta thường dùng
A. nước vôi B. phèn chua C. giấm ăn D. Muối ăn
Phương pháp giải:
Dựa vào ứng dụng của hợp chất IA, IIA.
Lời giải chi tiết:
Để xử lí chất thải có tính acid người ta thường dùng nước vôi có môi trường base để trung hòa lượng acid.
Đáp án A
OT 7.7
Hợp chất của calcium nào sau đây không gặp trong tự nhiên?
A. CaCO3 B. CaSO4 C. Ca(HCO3)2 D. CaO
Phương pháp giải:
Dựa vào hợp chất nhóm IIA.
Lời giải chi tiết:
CaO không gặp trong tự nhiên vì dễ phản ứng với CO2 trong không khí.
Đáp án D
OT 7.8
Trong các kim loại sau, kim loại nào có tính khử mạnh nhất?
A. K B. Al C. Mg D. Na
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại IA, IIA.
Lời giải chi tiết:
K là kim loại có tính khử mạnh nhất.
Đáp án A
OT 7.9
Phát biểu nào sau đây không đúng?
A. Đun sôi nước cứng chỉ làm mềm nước cứng tạm thời.
B. Dung dịch Na2CO3 làm mềm nước cứng tạm thời, nước cứng vĩnh cửu.
C. Dung dịch NH4Cl làm mềm nước cứng.
D. Cho dung dịch Ca(OH)2 vừa đủ làm mềm nước cứng tạm thời.
Phương pháp giải:
Dựa vào các biện pháp làm mềm nước cứng.
Lời giải chi tiết:
Dung dịch NH4Cl không làm mềm nước cứng vì không loại bỏ được ion Ca2+ và Mg2+
Đáp án C
OT 7.10
Cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 sẽ
A. có kết tủa trắng.
B. có bọt khí thoát ra
C. có kết tủa trắng và có bọt khí
D. không có hiện tượng gì
Phương pháp giải:
Dựa vào tính chất hóa học của hợp chất IIA.
Lời giải chi tiết:
Ca(OH)2 + Ca(HCO3)2 → 2CaCO3↓ + 2H2O
Hiện tượng: Có kết tủa trắng
Đáp án A
OT 7.11
Nguyên tắc làm mềm nước cứng là làm giảm nồng độ của
|
A. ion Ca2+, Mg2+. |
B. ion HCO3—. |
C. ion Cl—, SO42—. |
D. ion Ca2+. |
Phương pháp giải:
Dựa vào các biện pháp làm mềm nước cứng.
Lời giải chi tiết:
Nguyên tắc làm mềm nước cứng là làm giảm nồng độ của ion Ca2+ và Mg2+.
Đáp án A
OT 7.12
Chất nào sau đây không bị phân huỷ khi đun nóng?
A. Mg(NO3)2 B. CaCO3 C. NaNO3 D. Mg(OH)2
Phương pháp giải:
Dựa vào tính chất hóa học của hợp chất IIA.
Lời giải chi tiết:
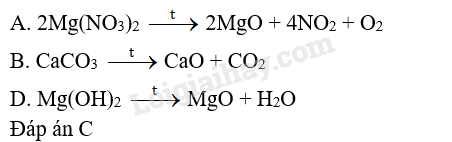
OT 7.13
Trường hợp nào không xảy ra phản ứng đối với dung dịch Ca(HCO3)2 khi
A. đun nóng
B. trộn với dung dịch Ca(OH)2
C. trộn với dung dịch HCl.
D. cho NaCl vào
Phương pháp giải:
Dựa vào tính chất hóa học của hợp chất IIA.
Lời giải chi tiết:
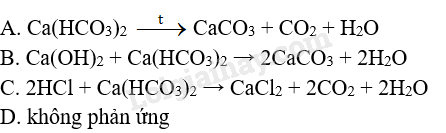
OT 7.14
Kim loại nhóm IIA có nhiệt độ nóng chảy, nhiệt độ sôi, khối lượng riêng biến đổi không theo quy luật như kim loại kiềm, do các kim loại nhóm IIA có
A. điện tích hạt nhân khác nhau.
B. cấu hình electron khác nhau.
C. Bán kính nguyên tử khác nhau
D. kiểu mạng tinh thể khác nhau.
Phương pháp giải:
Dựa vào tính chất vật lí của kim loại IIA.
Lời giải chi tiết:
Do các kim loại nhóm IIA có kiỂu mạng tinh thể khác nhau.
Đáp án D
OT 7.15
Để xác định thành phần của kim loại Al trong hợp kim Al - Mg, một bạn học sinh thực hiện thí nghiệm sau: Lấy một mẩu hợp kim chia thành 2 phần bằng nhau.
- Phần 1 cho hoà tan hoàn toàn trong dung dịch HCl, sau phản ứng thu được 9,916 lít khí H2 (đkc).
- Phần 2 cho tác dụng với dung dịch NaOH dư, sau phản ứng thu được 7,437 lít khí H2 (đkc).
Xác định thành phần phần trăm theo khối lượng của Al trong hợp kim trên.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại.
Lời giải chi tiết:
Ta có: nH2(P1) = \(\frac{{{\rm{9,916}}}}{{{\rm{24,79}}}}{\rm{ = 0,4 mol}}\); nH2(P2) = \(\frac{{{\rm{7,437}}}}{{{\rm{24,79}}}}{\rm{ = 0,3 mol}}\).
Gọi x, y lần lượt là số mol của Al và Mg
- Phần 1
\(\begin{array}{l}{\rm{2Al + 6HCl }} \to {\rm{ 2AlC}}{{\rm{l}}_{\rm{3}}}{\rm{ + 3}}{{\rm{H}}_{\rm{2}}}\\{\rm{ x }}\frac{{\rm{3}}}{{\rm{2}}}{\rm{x}}\\{\rm{Mg + 2HCl }} \to {\rm{ MgC}}{{\rm{l}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}\\{\rm{y y}}\end{array}\)
Ta có: \(\frac{{\rm{3}}}{{\rm{2}}}{\rm{x + y = 0,4 (1)}}\)
- Phần 2: \(\begin{array}{l}{\rm{Al + NaOH + }}{{\rm{H}}_{\rm{2}}}{\rm{O }} \to {\rm{ NaAl}}{{\rm{O}}_2}{\rm{ + }}\frac{{\rm{3}}}{2}{{\rm{H}}_{\rm{2}}}\\{\rm{x }}\frac{{\rm{3}}}{{\rm{2}}}{\rm{x}}\end{array}\)
Ta có: \(\frac{{\rm{3}}}{{\rm{2}}}{\rm{x = 0,3 (2)}}\)
Qua (1) và (2) => x = 0,2 và y = 0,1
Thành phần phần trăm theo khối của Al trong hợp kim trên:
\({\rm{\% }}{{\rm{m}}_{{\rm{Al}}}}{\rm{ = }}\frac{{0,2.27}}{{0,2.27 + 0,1.24}}.100\% = 69,23\% \)
OT 7.16
Để xác định công thức muối sulfate của một kim loại nhóm IIA, một bạn học sinh thực hiện thí nghiệm như sau:
Bước 1: Cân chính xác 1,8 g muối trên hoà tan trong nước, rồi thêm nước cho đủ thu được 50 mL dung dịch.
Bước 2: Lấy 10 mL dung dịch ở trên cho tác dụng từ từ với dung dịch BaCl2 0,15 M cho đến khi lượng kết tủa không tăng thêm nữa thì vừa hết 20 mL.
Xác định công thức hoá học của muối sulfate trên.
Phương pháp giải:
Dựa vào tính chất hóa học của hợp chất IIA.
Lời giải chi tiết:
PTHH: MSO4 + BaCl2 → BaSO4↓ + MCl2
Ta có: nBaCl2 = 0,003 mol => nMSO4(phản ứng) = 0,003 mol => nMSO4(ban đầu) = 0,005.50/10 = 0,045 mol
Phân tử khối của muối: \({{\rm{M}}_{{\rm{MS}}{{\rm{O}}_{\rm{4}}}}}{\rm{ = }}\frac{{{\rm{1,8}}}}{{{\rm{0,045}}}}{\rm{ = 120 = > M = 24(magnesium,Mg)}}\)
Công thức hóa học của muối sulfate là MgSO4.
OT 7.17
Thực hiện thí nghiệm sau: Cho từ từ 50 mL dung dịch Ba(OH)2 1 M vào 15 mL dung dịch Al2(SO4)3 chưa biết nồng độ. Sau khi các phản ứng kết thúc thu được 12,045 g kết tủa. Xác định nồng độ của dung dịch Al2(SO4)3.
Phương pháp giải:
Dựa vào tính chất hóa học của hợp chất IIA.
Lời giải chi tiết:
Ta có: nBa(OH)2 = 0,05 mol
PTHH: 3Ba(OH)2 + Al2(SO4)3 → 3BaSO4 + 2Al(OH)3 (1)
Giả sử, nếu Ba(OH)2 hết thì theo PTHH ta có:
nBaSO4 = nBa(OH)2 = 0,05 mol
nAl(OH)3 = \(\frac{{\rm{2}}}{{\rm{3}}}{{\rm{n}}_{{\rm{Ba(OH}}{{\rm{)}}_{\rm{2}}}}}{\rm{ = 0,075 mol}}\)
=> m↓ = mBaSO4 + mAl(OH)3 = 0,05.233 + 0,075.78 = 14,25 (g) > 12,045 (g)
Vậy chứng tỏ Ba(OH)2 dư và Al(OH)3 bị hòa tan một phần.
Gọi số mol Ba(OH)2 đã phản ứng ở (1) là x.
Theo (1) ta có: \({{\rm{n}}_{{\rm{Al(OH}}{{\rm{)}}_{\rm{3}}}}}{\rm{ = }}\frac{{\rm{2}}}{{\rm{3}}}{\rm{x; }}{{\rm{n}}_{{\rm{Ba(OH}}{{\rm{)}}_{\rm{2}}}}}{\rm{(du) = 0,05 - x}}\)
Phản ứng: \[\begin{array}{l}{\rm{2Al}}{\left( {{\rm{OH}}} \right)_{\rm{3}}}{\rm{ + Ba}}{\left( {{\rm{OH}}} \right)_{\rm{2}}}{\rm{ }} \to {\rm{ Ba}}{\left( {{\rm{Al}}{{\rm{O}}_{\rm{2}}}} \right)_{\rm{2}}}{\rm{ + 4}}{{\rm{H}}_{\rm{2}}}{\rm{O }}\left( {\rm{2}} \right)\\{\rm{ 0,1 - 2x }} \leftarrow {\rm{ 0,05 - x (mol)}}\end{array}\]
Vậy m↓ = mBaSO4 + mAl(OH)3(còn lại) = 233.x + [\(\frac{2}{3}\)x – (0,1 – 2x)].78 = 12,045 => x = 0,045 => \({{\rm{n}}_{{\rm{A}}{{\rm{l}}_{\rm{2}}}{{{\rm{(S}}{{\rm{O}}_{\rm{4}}}{\rm{)}}}_{\rm{3}}}}}{\rm{ = }}\frac{{\rm{1}}}{{\rm{3}}}{{\rm{n}}_{{\rm{Ba(OH}}{{\rm{)}}_{\rm{2}}}}}{\rm{ = 0,015(mol)}}\)
Nồng độ dung dịch Al2(SO4)3: CM = \(\frac{{{\rm{0,015}}}}{{{\rm{0,015}}}}{\rm{ = 1M}}\)
OT 7.18
Hợp chất của kim loại kiềm có nhiều ứng dụng trong thực tiễn. Em hãy cho biết các phát biểu sau đúng hay sai bằng cách đánh dấu V vào bảng theo mẫu sau:
|
Phát biểu |
Đúng |
Sai |
|
a) Sodium carbonate khan (Na2CO3, còn gọi là soda) được dùng trong công nghiệp thuỷ tinh, đồ gốm, bột giặt, ... |
? |
? |
|
b) Sodium hydrocarbonate (NaHCO3) được dùng trong công nghiệp thực phẩm. NaHCO3 còn được dùng làm thuốc giảm triệu chứng đau dạ dày. |
? |
? |
|
c) Dung dịch NaCl có nồng độ 0,9% dùng để vệ sinh, sát khuẩn. |
? |
? |
|
d) Chất được gọi là xút ăn da là KOH. |
? |
? |
Phương pháp giải:
Dựa vào ứng dụng của hợp chất IIA.
Lời giải chi tiết:
a) đúng
b) đúng
c) đúng
d) sai, xút ăn da là NaOH.
OT 7.19
Cho các loại nước được đánh dấu X, Y, Z, T có chứa các ion theo bảng sau:
|
X |
Y |
Z |
T |
|
Ca2+, Mg2+ (nhiều) Cl—, SO42— |
Ca2+, Mg2+ (nhiều), HCO3— |
Na+, K+, HCO3— |
Ca2+, Mg2+ (nhiều), Cl—, SO42—, HCO3— |
Em hãy cho biết các phát biểu sau đúng hay sai bằng cách đánh dấu V vào bảng theo mẫu sau:
|
Phát biểu |
Đúng |
Sai |
|
a) Nước X và Y đều là nước có tính cứng vĩnh cửu. |
? |
? |
|
b) Có thể loại bỏ tính cứng của nước T bằng cách đun nóng. |
? |
? |
|
c) Có thể loại bỏ tính cứng của nước Y bằng dung dịch Na2CO3 dư. |
? |
? |
|
d) Có thể phân biệt X, Y, Z và T bằng cách đun nóng nhẹ và dung dịch NaOH. |
? |
? |
Phương pháp giải:
Dựa vào các biện pháp làm mềm nước cứng.
Lời giải chi tiết:
a) sai vì Y là nước cứng tạm thời
b) sai vì T là nước cứng toàn phần nên không thể loại bỏ hết ion Ca2+ và Mg2+ bằng Phương pháp đun nóng
c) đúng
d) đúng
OT 7.20
Hợp chất của kim loại calcium có nhiều ứng dụng trong thực tiễn. Em hãy cho biết các phát biểu sau đúng hay sai bằng cách đánh dấu V vào bảng theo mẫu sau:
|
Phát biểu |
Đúng |
Sai |
|
a) Hợp chất nào của calcium được dùng để đúc tượng, bó bột khi gãy xương là thạch cao nung (CaSO4.H2O). |
? |
? |
|
b) Vôi sống được dùng để khử chua cho đất |
? |
? |
|
c) Phương trình hoá học của phản ứng tạo thạch nhũ trong các hang động đá vôi là: CaCO3 + CO2 + H2O → Ca(HCO3)2 |
? |
? |
|
d) Thành phần chính của vỏ các loài ốc, sò, hến là CaCO3. |
? |
? |
Phương pháp giải:
Dựa vào ứng dụng của hợp chất IIA.
Lời giải chi tiết:
a) đúng
b) đúng
c) sai vì Phương trình hoá học của phản ứng tạo thạch nhũ trong các hang động đá vôi là: Ca(HCO3)2 → CaCO3 + CO2 + H2O
d) đúng
OT 7.21
Cho các phản ứng xảy ra theo sơ đồ sau:

Em hãy cho biết các phát biểu sau đúng hay sai bằng cách đánh dấu V vào bảng theo mẫu sau:
|
Phát biểu |
Đúng |
Sai |
|
a) X2 là KOH. |
? |
? |
|
b) X3 là khí có màu lục nhạt. |
? |
? |
|
c) X4 là muối acid. |
? |
? |
|
d) Đun nóng dung dịch X4 thu được kết tủa trắng. |
? |
? |
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại IA, IIA.
Lời giải chi tiết:
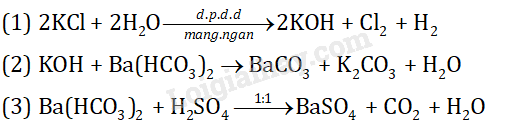
a) đúng
b) sai, X3 là Cl2
c) đúng
d) đúng
OT 7.22
Điện phân nóng chảy hoàn toàn 14,9 g muối chloride của kim loại kiềm R, thu được 2,479 lít khí (đkc) ở anode. Xác định khối lượng nguyên tử của kim loại R.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại kiềm.
Lời giải chi tiết:
Ta có: \({{\rm{n}}_{{\rm{C}}{{\rm{l}}_{\rm{2}}}}}{\rm{ = }}\frac{{{\rm{2,479}}}}{{{\rm{24,79}}}}{\rm{ = 0,1(mol)}}\)
PTHH:
Ta có: \({{\rm{M}}_{{\rm{RCl}}}}{\rm{ = }}\frac{{{\rm{14,9}}}}{{{\rm{0,2}}}}{\rm{ = 74,5 = > R = 39}}\)
Vậy R là K, có khối lượng nguyên tử 39 (amu)
OT 7.23
Trong công nghiệp, người ta sản xuất NaOH (xút) từ muối ăn bằng Phương pháp điện phân dung dịch có màng ngăn. Tính khối lượng NaCI cần dùng để sản xuất 15 tấn NaOH (với hiệu suất là 80%).
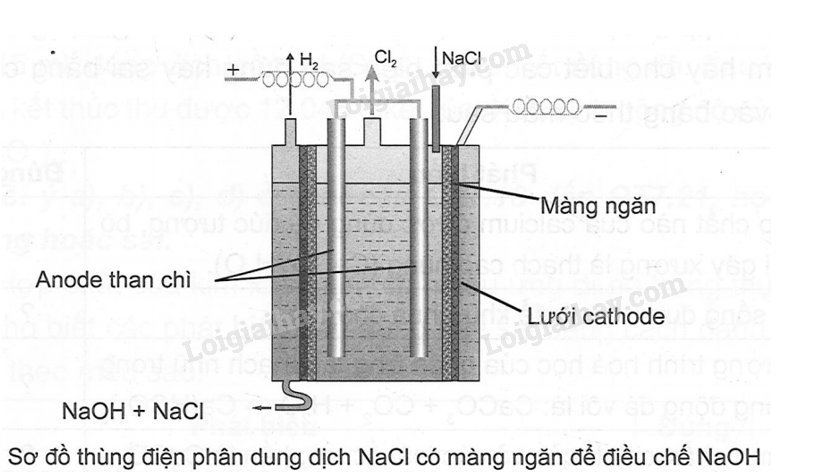
Phương pháp giải:
Dựa vào Phương pháp điện phân dung dịch.
Lời giải chi tiết:
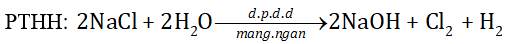
Khối lượng NaCl cần để sản xuất 15 tấn NaOH
mNaCl(lý thuyết) = \(\frac{{15}}{{40}}.58,5 = 21,94\)(tấn)
mNaCl(thực tế) = \(\frac{{21,94}}{{80\% }} = 27,56\)(tấn)
OT 7.24
Cho 1 gam sodium phản ứng với oxygen thu được 1,383 g sodium oxide và sodium peroxide. Tính thành phần phần trăm của sodium peroxide.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại kiềm.
Lời giải chi tiết:
Phương trình hóa học của phản ứng:
\(\begin{array}{l}{\rm{4Na + }}{{\rm{O}}_{\rm{2}}}{\rm{ }} \to {\rm{2N}}{{\rm{a}}_{\rm{2}}}{\rm{O}}\\{\rm{ x }}\frac{{\rm{x}}}{{\rm{2}}}{\rm{ (mol)}}\\{\rm{2Na + }}{{\rm{O}}_{\rm{2}}}{\rm{ }} \to {\rm{N}}{{\rm{a}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}}\\{\rm{ y }}\frac{{\rm{y}}}{{\rm{2}}}{\rm{ (mol)}}\end{array}\)
Ta có: \(\left\{ \begin{array}{l}{\rm{x + y = }}\frac{{\rm{1}}}{{{\rm{23}}}}\\{\rm{62}}{\rm{.}}\frac{{\rm{x}}}{{\rm{2}}}{\rm{ + 78}}{\rm{.}}\frac{{\rm{y}}}{{\rm{2}}}{\rm{ = 1,383}}\end{array} \right.{\rm{ = > }}\left\{ \begin{array}{l}{\rm{x = 0,039}}\\{\rm{y = 0,0044}}\end{array} \right.\)
Vậy: \({\rm{\% }}{{\rm{m}}_{{\rm{Na2O2}}}}{\rm{ = }}\frac{{{\rm{0,0022}}{\rm{.78}}}}{{{\rm{1,383}}}}{\rm{.100\% = 12,41\% }}\)
OT 7.25
Để xác định kim loại X thuộc nhóm IIA trong lọ bị mất nhãn, một bạn học sinh đã thực hiện thí nghiệm như hình bên dưới. Cân 0,36 g kim loại X cho vào bình tam giác chứa lượng dư dung dịch HCl 20%, phía trên đậy kín bằng nút cao su có ống nhọn nối với một ống tiêm có vạch chia độ để đo thể tích khí thoát ra. Sau khi phản ứng xảy ra hoàn toàn, khí thoát ra ở điều kiện chuẩn. Piston của ống tiêm di chuyển đến vị trí 0,37 dm3. Xác định khối lượng nguyên tử của kim loại X.
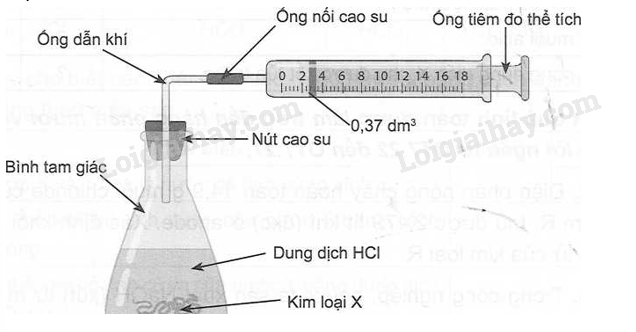
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại IIA.
Lời giải chi tiết:
Ta có: \({{\rm{n}}_{{{\rm{H}}_{\rm{2}}}}}{\rm{ = }}\frac{{{\rm{0,37}}}}{{{\rm{24,79}}}}{\rm{ }} \approx {\rm{0,015 (mol)}}\)
PTHH: \(\begin{array}{l}{\rm{ 2X + 2nHCl}} \to {\rm{2XC}}{{\rm{l}}_{\rm{n}}}{\rm{ + n}}{{\rm{H}}_{\rm{2}}}\\\frac{{{\rm{0,030}}}}{{\rm{n}}}{\rm{ 0,015 (mol)}}\end{array}\)
Ta có: \({{\rm{n}}_{\rm{X}}}{\rm{.}}{{\rm{M}}_{\rm{X}}}{\rm{ = 0,36 }} \Leftrightarrow {\rm{ }}\frac{{{\rm{0,030}}}}{{\rm{n}}}{\rm{.}}{{\rm{M}}_{\rm{X}}}{\rm{ = 0,36 = > }}{{\rm{M}}_{\rm{X}}}{\rm{ = 12n}}\)
Lập bảng:
|
n |
I |
II |
III |
|
MX |
12 (carbon, loại) |
24 (magnesium) |
36 (loại) |
Vậy X là Mg, có khối lượng nguyên tử 24 amu.
OT 7.26
Muối ammonium bicarbonate (NH4HCO3) được sử dụng làm bột nở, giúp cho bánh nở to, xốp và mềm thông qua phản ứng theo phương trình hoá học sau:

Cho giá trị nhiệt tạo thành của các chất theo bảng sau:
|
Chất |
NH4HCO3(s) |
NH3(g) |
CO2(g) |
H2O(g) |
|
∆fH298o (kJ/mol) |
-849,40 |
-45,90 |
-393,50 |
-241,82 |
Xác định biến thiên enthalpy của phản ứng trên.
Phương pháp giải:
Dựa vào công thức tính biến thiên enthalpy của phản ứng.
Lời giải chi tiết:
\(\begin{array}{l}{{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}{\rm{ = }}{{\rm{\Delta }}_{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}{\rm{(}}{{\rm{H}}_{\rm{2}}}{\rm{O) + }}{{\rm{\Delta }}_{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}{\rm{(C}}{{\rm{O}}_{\rm{2}}}{\rm{) + }}{{\rm{\Delta }}_{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}{\rm{(N}}{{\rm{H}}_{\rm{3}}}{\rm{) - }}{{\rm{\Delta }}_{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}{\rm{(N}}{{\rm{H}}_{\rm{4}}}{\rm{HC}}{{\rm{O}}_{\rm{3}}}{\rm{)}}\\{\rm{ = - 241,82 + ( - 393,50) + ( - 45,90) - ( - 849,40) = 168,18 (kJ)}}\end{array}\)
OT 7.27
Khi điện phân 500 mL dung dịch NaCI với điện cực trơ, có màng ngăn xốp đến khi khối lượng dung dịch giảm 5,475 g thì ngừng điện phân, thu được dung dịch X. Xác định giá trị pH của dung dịch X.
Phương pháp giải:
Dựa vào Phương pháp điện phân dung dịch.
Lời giải chi tiết:
Gọi x là số mol NaCl đã phản ứng.
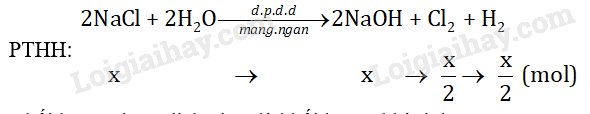
Khối lượng dung dịch giảm là khối lượng khí sinh ra.
Ta có: mCl2 + mH2 = \(\frac{{\rm{x}}}{{\rm{2}}}{\rm{.71 + }}\frac{{\rm{x}}}{{\rm{2}}}{\rm{.2 = 5,475 = > x = 0,15}}\)
=> nNaOH = 0,15 mol => [OH—] = \(\frac{{{\rm{0,15}}}}{{{\rm{0,5}}}}{\rm{ = 0,3 (M)}}\) => pH = 13,48
Luyện Bài Tập Trắc nghiệm Hóa 12 - Chân trời sáng tạo - Xem ngay
Các bài khác cùng chuyên mục
- Bài Ôn tập chương 8. Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức chất trang 136, 137 SBT Hóa 12 Chân trời sáng tạo
- Bài 20. Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch trang 132, 133, 134 SBT Hóa 12 Chân trời sáng tạo
- Bài 19. Đại cương về kim loại chuyển tiếp thứ nhất trang 128, 129, 130 SBT Hóa 12 Chấn trời sáng tạo
- Bài Ôn tập chương 7. Nguyên tố nhóm IA và IIA trang 121, 122 SBT Hóa 12 Chân trời sáng tạo
- Bài 18. Nguyên tố nhóm IIA trang 114, 115, 116 SBT Hóa 12 Chân trời sáng tạo
- Bài Ôn tập chương 8. Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức chất trang 136, 137 SBT Hóa 12 Chân trời sáng tạo
- Bài 20. Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch trang 132, 133, 134 SBT Hóa 12 Chân trời sáng tạo
- Bài 19. Đại cương về kim loại chuyển tiếp thứ nhất trang 128, 129, 130 SBT Hóa 12 Chấn trời sáng tạo
- Bài Ôn tập chương 7. Nguyên tố nhóm IA và IIA trang 121, 122 SBT Hóa 12 Chân trời sáng tạo
- Bài 18. Nguyên tố nhóm IIA trang 114, 115, 116 SBT Hóa 12 Chân trời sáng tạo













Danh sách bình luận