Bài 13. Điện phân trang 87, 88, 89 SBT Hóa 12 Chân trời sáng tạo
Nhận xét nào sau đây đúng về quá trình điện phân ở hai điện cực?
13.1
Nhận xét nào sau đây đúng về quá trình điện phân ở hai điện cực?
A. Cation nhường electron ở cathode B. Anion nhận electron ở anode
C. Sự oxi hóa xảy ra ở anion D. Sự oxi hóa xảy ra ở cathode.
Phương pháp giải:
Dựa vào nguyên tắc điện phân dung dịch.
Lời giải chi tiết:
Ở anode xảy ra quá trình oxi hóa
Ở cathode xảy ra quá trình khử.
Đáp án C
13.2
Khi điện phân NaCl nóng chảy (điện cực trơ), ở cathode xảy ra?
A. Sự khử ion Cl-. B. Sự oxi hóa ion Cl-.
C. Sự oxi hóa ion Na+. D. Sự khử ion Na+.
Phương pháp giải:
Dựa vào nguyên tắc điện phân dung dịch.
Lời giải chi tiết:
Khi điện phân NaCl nóng chảy, ở cathode xảy ra sự khử ion Na+
Đáp án D
13.3
Khi điện phân nóng chảy CaCl2 nóng chảy (điện cực trơ), ở anode xảy ra
A. Sự khử ion Cl-. B. Sự khử ion Ca2+.
C. Sự oxi hóa ion Ca2+. D. Sự oxi hóa ion Cl-.
Phương pháp giải:
Dựa vào nguyên tắc điện phân dung dịch.
Lời giải chi tiết:
|
Ở cực âm (cathode) xảy ra quá trình khử ion Ca2+ Ca2+ + 2e →Ca |
Ở cực dương (anode) xảy ra quá trình oxi hoá ion Cl-: 2Cl- → Cl2 + 2e. |
13.4
Trong quá trình điện phân dung dịch NaCl (điện cực trơ), ở cathode xảy ra
A. Sự oxi hóa cation Na+. B. Sự oxi hóa phân tử H2O.
C. Sự khử phân tử H2O. D. Sự khử cation Na+.
Phương pháp giải:
Dựa vào nguyên tắc điện phân dung dịch.
Lời giải chi tiết:
A. Sai vì ở cathode chỉ xảy ra sự khử.
B. Sai vì Cl sẽ điện phân trước.
C. Đúng.
D. Sai vì H2O đúng trước Na nên ưu tiên nước điện phân trước.
13.5
Khi điện phân dung dịch NaCl (điện cực trơ) thì
A. Ở cực âm xảy ra quá trình oxi hóa H2O và ở cực dương xảy ra quá trình khử ion Cl-
B. Ở cực dương xảy ra quá trình oxi hóa ion Na+ và ở cực âm xảy ra quá trình khử ion Cl-.
C. Ở cực âm xảy ra quá trình khử H2O và ở cực dương xảy ra quá trình oxi hóa ion Cl-. D. Ở cực âm xảy ra quá trình khử ion Na+ và ở cực dương xảy ra quá trình oxi hóa ion Cl-.
Phương pháp giải:
Dựa vào nguyên tắc điện phân dung dịch.
Lời giải chi tiết:
Khi điện phân dung dịch NaCl (điện cực trơ) thì ở cực âm xảy ra quá trình khử H2O và cực dương xảy ra quá trình oxi hóa ion Cl-
Đáp án C
13.6
Khi điện phân NaCl nóng chảy (điện cực trơ), ở cathode thu được chất nào sau đây?
A. HCl B. Cl2 C. Na D. NaOH
Phương pháp giải:
Dựa vào các quá trình xảy ra ở 2 cực.
Lời giải chi tiết:
|
Ở cực âm (cathode) xảy ra quá trình khử ion Na+ Na+ + 1e →Na |
Ở cực dương (anode) xảy ra quá trình oxi hoá ion Cl-: 2Cl- → Cl2 + 2e |
Đáp án C
13.7
Sản phẩm thu được khi điện phân dung dịch KCl (điện cực trơ, có mang ngăn) gồm
A. K và Cl2 B. K, H2 và Cl2
C. KOH, H2 và Cl2 D. KOH, O2 và HCl
Phương pháp giải:
Dựa vào các quá trình xảy ra ở 2 cực.
Lời giải chi tiết:
|
Ở cathode xảy ra quá trình khử H2O \(2{H_2}O + 2e \to 2O{H^ - } + {H_2}\) |
Ở anode xảy ra quá trình oxi hoá ion Cl-: 2Cl- → Cl2 + 2e |
|
Phương trình: \(2KCl + 2{H_2}O \to 2KOH + C{l_2} + {H_2}\) Đáp án C |
|
13.8
Điện phân dung dịch nào sau đây sẽ có khí thoát ra ở 3 điện cực (ngay lúc bắt đầu điện phân)?
A. Cu(NO3)2 B. FeCl2 C. K2SO4 D. FeSO4
Phương pháp giải:
Dựa vào thứ tự điện phân dung dịch.
Lời giải chi tiết:
A. Sai vì ở cathode xảy ra khử ion Cu2+.
B. Sai vì ở cathode xảy ra khử ion Fe2+.
C. Đúng.
D. Sai vì ở cathode xảy ra khử ion Fe2+.
13.9
Khi điện phân dung dịch nào sau đây, tại anode xảy ra quá trình oxi hóa nước?
A. dung dịch ZnCl2 B. Dung dịch CuCl2
C. Dung dịch AgNO3 D. Dung dịch MgCl2
Phương pháp giải:
Dựa vào thứ tự điện phân dung dịch.
Lời giải chi tiết:
A. Sai vì ở anode xảy ra oxi hóa ion Cl-.
B. Sai vì ở anode xảy ra oxi hóa ion Cl-.
C. Đúng.
D. Sai vì ở anode xảy ra oxi hóa ion Cl-.
13.10
Điều khẳng định nào sau đây là đúng khi điện phân hỗn hợp dung dịch Cu(NO3)2, AgNO3
A. Tại cathode xảy ra quá trình khử Cu2+ trước .
B. Khối lượng dung dịch giảm là khối lượng của kim loại thoát ra bám vào cathode
C. Ngay từ đầu đã có khí thoát ra ở cathode
D. Tại anode xảy ra quá trình oxi hóa H2O
Phương pháp giải:
Dựa vào thứ tự điện phân của dung dịch.
Lời giải chi tiết:
A. Sai vì ở cạtode xảy ra khử ion Ag+ trước.
B. Sai vì khối lượng dung dịch giảm = khí thoát ra + kim loại sinh ra
C. Sai vì ở cạtode xảy ra khử ion Ag+ , Cu2+ trước
D. Đúng.
13.11
Tiến hành điện phân dung dịch NaCl bằng điện cực trơ, thu được một khí Y duy nhất. Điều khẳng định nào sau đây là đúng?
A. Y là khí oxygen B. Y là khí chlorine
C. Y là khí hydrogen D. Có dùng màng ngăn
Phương pháp giải:
Dựa vào thứ tự điện phân của dung dịch.
Lời giải chi tiết:
|
Ở cathode xảy ra quá trình khử H2O \(2{H_2}O + 2e \to 2O{H^ - } + {H_2}\) |
Ở anode xảy ra quá trình oxi hoá ion Cl-: 2Cl- → Cl2 + 2e |
|
Phương trình: \(2NaCl + 2{H_2}O \to 2NaOH + C{l_2} + {H_2}\) Vì không có màng ngăn nên NaOH và Cl2 tiếp tục phản ứng \(2NaOH + C{l_2} \to NaCl + NaClO + {H_2}O\) Đáp án B |
|
13.12
Điện phân dung dịch gồm NaCl và HCl (điện cực trơ, có màng ngăn). Trong quá trình điện phân, giá trị pH của dung dịch thu được so với dung dịch ban đầu là ?
A. Không thay đổi B. Giảm xuống
C. Tăng lên sau đó giảm xuống D. Tăng lên
Phương pháp giải:
Dựa vào sản phẩm của điện phân dung dịch.
Lời giải chi tiết:
|
Ở cathode xảy ra quá trình khử H2O \(2{H_2}O + 2e \to 2O{H^ - } + {H_2}\) |
Ở anode xảy ra quá trình oxi hoá ion Cl-: 2Cl- → Cl2 + 2e |
|
Phương trình: \(2NaCl + 2{H_2}O \to 2NaOH + C{l_2} + {H_2}\) Vì có màng ngăn lên NaOH không phản ứng với Cl2 Đáp án D |
|
13.13
Khi điện phân dung dịch (có màng ngăn) gồm NaCl, HCl, CuCl2 và phenolphthalein. Màu dung dịch biến đổi như thế nào khi điện phân đến hết NaCl
A. Đỏ → không màu → xanh.
B. Xanh → không màu → đỏ.
C. Xanh → không màu → hồng.
D. Hồng → không màu → xanh.
Phương pháp giải:
Dựa vào thứ tự điện phân dung dịch.
Lời giải chi tiết:
Thứ tự điện phân: CuCl2 (xanh) → HCl (không màu) → NaCl (điện phân có màng ngăn tạo ra NaOH làm phenolphthalein chuyển hồng)
|
Ở cathode xảy ra quá trình khử H2O \(2{H_2}O + 2e \to 2O{H^ - } + {H_2}\) |
Ở anode xảy ra quá trình oxi hoá ion Cl-: 2Cl- → Cl2 + 2e |
|
Phương trình: \(2NaCl + 2{H_2}O \to 2NaOH + C{l_2} + {H_2}\) Đáp án C |
|
13.14
Điện phân dung dịch CuCl2 với điện cực trơ. Nồng độ của CuCl2 trong dung dịch
A. Giảm dần B. Tăng dần C. Không thay đổi D. Tăng lên rồi giảm xuống
Phương pháp giải:
Dựa vào quá trình xảy ra ở hai điện cực.
Lời giải chi tiết:
|
Ở cathode xảy ra quá trình khử ion Cu2+ Cu2+ + 2e g Cu
|
Ở anode xảy ra quá trình oxi hoá ion Cl-: 2Cl- → Cl2 + 2e |
|
Phương trình: CuCl2 → Cu + Cl2 |
|
Đáp án A
13.15
Điện phân dung dịch CuSO4 với hai điện cực trơ. Sau một thời gian, màu xanh của dung dịch nhạt dần do
A. Khí H2 sinh ra đã khử màu của dung dịch.
B. Dung dịch bị pha loãng dần nên màu xanh nhạt dần.
C. Ion Cu2+ bị khử dần thành đồng kim loại.
D. Ion Cu2+ được tạo thêm.
Phương pháp giải:
Dựa vào thứ tự điện phân của dung dịch.
Lời giải chi tiết:
Ion Cu2+ bị khử dần thành đồng kim loại.
Đáp án C
13.16
Điện phân điện cực trơ, có màng ngăn một dung dịch chứa các ion: Fe2+, Fe3+, Cu2+, Cl- . Thứ tự điện phân xảy ra ở cathode là
A. Fe2+, Fe3+, Cu2+ B. Fe2+, Cu2+, Fe3+
C. Fe3+, Cu2+, Fe2+ D. Fe3+, Fe2+, Cu2+
Phương pháp giải:
Các ion có tính oxi hóa mạnh hơn bị khử trước tại cathode.
Lời giải chi tiết:
Đáp án C
13.17
Dung dịch X chứa hỗn hợp các muối: NaCl, CuCl2, FeCl3 và ZnCl2. Kim loại tách ra đầu tiên ở cathode khi điện phân dung dịch là:
A. Fe B. Cu C. Zn D. Na
Phương pháp giải:
Dựa vào thứ tự điện phân dung dịch.
Lời giải chi tiết:
Thứ tự điện phân: FeCl3 → CuCl2 → FeCl2 → ZnCl2 → NaCl → H2O
Đáp án A
13.18
Điện phân dung dịch CuSO4 với anode bằng đồng (anode tan) và điện phân dung dịch CuSO4 với anode bằng graphite (điện cực trơ) đều có đặc điểm chung là
A. Ở cathode xảy ra sự oxi hóa: \(2{H_2}O + 2e \to 2O{H^ - } + {H_2}\)
B. Ở anode xảy ra sự khử: \(2{H_2}O \to \;{O_2} + {\rm{ 4}}{H^ + } + {\rm{ 4}}e\)
C. Ở anode xảy ra sự oxi hóa: \(Cu \to C{u^{2 + }} + 2e\)
D. Ở cathode xảy ra sự khử: \(C{u^{2 + }} + 2e \to Cu\)
Phương pháp giải:
Dựa vào quá trình xảy ra ở 2 điện cực.
Lời giải chi tiết:
Ở anode xảy ra sự oxi hóa: \(Cu \to C{u^{2 + }} + 2e\)
Đáp án C
13.19
Khi điện phân hỗn hợp gồm các dung dịch: FeCl3, CuCl2, HCl. Quá trình nào xảy ra ở cathode và theo đúng thứ tự
1. \(C{u^{2 + }} + 2e \to Cu\)
2. \(F{e^{3 + }} + 3e \to Fe\)
3. \(F{e^{3 + }} + 1e \to F{e^{2 + }}\)
4. \(F{e^{2 + }} + 2e \to Fe\)
5. \(2{H^ + } + 2e \to {H_2}\)
A. \((4) \to (5) \to (1) \to (3)\) B. \((2) \to (1) \to (5) \to (3)\)
C. \((3) \to (1) \to (5) \to (4)\) D. \((1) \to (3) \to (5) \to (4)\)
Phương pháp giải:
Dựa vào thứ tự của điện phân.
Lời giải chi tiết:
Fe3+ có tính oxi hóa mạnh hơn nên bị khử trước sau đó đến Cu2+, H+ và Fe2+
Đáp án C
13.20
Điện phân với điện cực trơ, có màng ngăn các dung dịch sau: KCl, CuSO4,AgNO3, CuCl2, MgCl2, NiSO4, ZnCl2. Số dung dịch sau điện phân có pH
A. 2 B. 3 C. 4 D. 5
Phương pháp giải:
Dựa vào ứng dụng của điện phân dung dịch.
Lời giải chi tiết:
CuSO4, AgNO3, NiSO4 có môi trường pH < 7 sau điện phân vì có sinh ra ion H+.
Đáp án B
13.21
Điện phân với điện cực trơ, có màng ngăn giữa 2 điện cực các dung dịch sau: NaCl, AgNO3, KNO3, CuCl2, CuSO4, ZnCl2. Số dung dịch sau điện phân hoàn toàn có khả năng hòa tan Al2O3 là
A. 2 B. 3 C. 4 D. 5
Phương pháp giải:
Al2O3 là oxide lưỡng tính nên có thể phản ứng được với dung dịch acid và dung dịch base.
Lời giải chi tiết:
\(\begin{array}{l}2NaCl{ + _2}{H_2}{\rm{O}} \to 2NaOH + {H_2} + C{l_2}\\2CuS{O_4} + 2{H_2}{\rm{O}} \to 2Cu + 2{H_2}{\rm{S}}{O_4} + {O_2}\\2AgN{O_3} + {H_2}{\rm{O}} \to 2Ag + 2HN{O_3} + \frac{1}{2}{O_2}\\CuC{l_2} \to Cu + C{l_2}\\ZnC{l_2} \to Zn + C{l_2}\\KN{O_3} + {H_2}{\rm{O}} \to X\end{array}\)
=> CuSO4, NaCl, AgNO3
Đáp án B
13.22
Cách nào sau đây không được dùng để điều chế NaOH?
A. Điện phân dung dịch NaCl có màng ngăn xốp, điện cực trơ
B. Cho dung dịch Ca(OH)2 tác dụng với dung dịch Na2CO3
C. Cho Na2O tác dụng với nước.
D. Dẫn khí NH3 vào dung dịch Na2CO3
Phương pháp giải:
Dựa vào ứng dụng của điện phân
Lời giải chi tiết:
Dẫn khí NH3 vào dung dịch Na2CO3 không có phản ứng.
Đáp án D
13.23
Điện phân với điện cực trơ, có màng ngăn những dung dịch sau: NaCl, CuSO4, K2SO4, AgNO3, CuCl2. Dung dịch sau điện phân có pH
Phương pháp giải:
Dựa vào quá trình xảy ra ở 2 điện cực.
Lời giải chi tiết:
Các dung dịch có pH4, AgNO3
\(2CuS{O_4} + 2{H_2}O \to 2Cu + {O_2} + 2{H_2}S{O_4}\) \(2CuS{O_4} + 2{H_2}O \to 2Cu + {O_2} + 2{H_2}S{O_4}\)
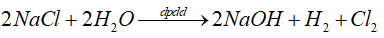
13.24
So sánh thể tích hydrogen sinh ra khi điện phân dung dịch chứa cùng một lượng NaCl có màng ngăn và không có màng ngăn
Phương pháp giải:
Dựa vào thứ tự điện phân dung dịch.
Lời giải chi tiết:
* Có màng ngăn
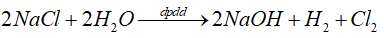
* Không có màng ngăn
- Ban đầu: 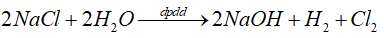
- Tiếp tục phản ứng\(2NaOH + C{l_2} \to NaCl + NaClO + {H_2}O\)
NaCl tạo thành tiếp tục điện phân tạo khí hydrogen . Do đó lượng khí hydrogen tạo thành tăng gấp đôi so với khí điện phân có màng ngăn.
13.25
Hãy trình bày cách mạ bạc cho một chiếc nhẫn đồng bằng phương pháp điện phân
Phương pháp giải:
Dựa vào ứng dụng của phương pháp điện phân dung dịch.
Lời giải chi tiết:
Bước 1: Chiếc nhẫn được nối với cực âm của nguồn điện với điện cực trơ
Bước 2: Điện phân dung dịch AgNO3.
13.26
Ở điều kiện thường, hydrogen chloride là một chất khí, dễ tan trong nước, khi hòa tan vào nước thu được dung dịch hydrochloric acid. Cho sơ đồ điện phân dung dịch hydrochloric acid, điện cực trơ như hình bên dưới:
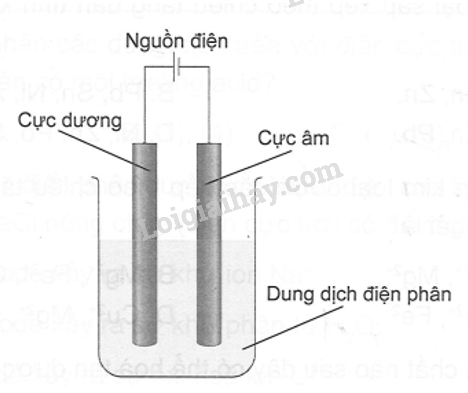
Hoàn thành các yêu cầu sau:
a, Gọi tên chất điện phân
b, Xác định các ion có trong chất điện phân và xác định chúng sẽ di chuyển về phía điện cực nào
c, Nêu hiện tượng xảy ra ở cực âm
d, Trình bày phương pháp hóa học để nhận biết sản phẩm sinh ra ở cực âm
e, Nêu hiện tượng xảy ra ở cực dương
g, Trình bày phương pháp hóa học để nhận biết sản phẩm sinh ra ở cực dương
Phương pháp giải:
Dựa vào ứng dụng của phương pháp điện phân dung dịch.
Lời giải chi tiết:
a, Chất điện phân là dung dịch hydrochloric acid
b, Ion H+ di chuyển về cực âm còn ion Cl- di chuyển về cực dương
c, Có khí không màu thoát ra ở cực âm (hydrogen)
d, Đưa que đóm đang cháy vào ống nghiệm chứa khí thoát ra ở cực dương, nghe tiếng bổ lốp bốp nhẹ
e, có khí màu vàng lục sinh ra (chlorine)
g, Đưa quỳ tím ẩm lại gần điện cực, sau một thời gian giấy quỳ bị tẩy màu
13.27
Có thể điều chế kim loại Na bằng cách điện phân dung dịch Na2SO4 trong nước có độ pH gần bằng 7 được không? Giải thích?
Phương pháp giải:
Dựa vào thứ tự điện phân dung dịch.
Lời giải chi tiết:
Không, vì: Trong quá trình điện phân tại cathode, nước dễ bị khử hơn ion Na+
13.28
Để sản xuất cùng một lượng kim loại: nhôm từ Al(NO3)3, vàng từ Au(NO3)3, kẽm từ Zn(NO3)2 thi chi phí sản xuất kim loại nào tốn kém nhất nếu chỉ xem xét về chi phí sử dụng điện?
Phương pháp giải:
Dựa vào ứng dụng của phương pháp điện phân.
Lời giải chi tiết:
Tốn kém nhất là chi phí sản xuất nhôm vì Al3+/Al có thế điện cực chuẩn nhỏ nhất nên tính oxi hóa yêu nhất, do đó cần năng lượng điện nhiều hơn để khử Al3+
Luyện Bài Tập Trắc nghiệm Hóa 12 - Chân trời sáng tạo - Xem ngay
Các bài khác cùng chuyên mục
- Bài Ôn tập chương 8. Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức chất trang 136, 137 SBT Hóa 12 Chân trời sáng tạo
- Bài 20. Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch trang 132, 133, 134 SBT Hóa 12 Chân trời sáng tạo
- Bài 19. Đại cương về kim loại chuyển tiếp thứ nhất trang 128, 129, 130 SBT Hóa 12 Chấn trời sáng tạo
- Bài Ôn tập chương 7. Nguyên tố nhóm IA và IIA trang 121, 122 SBT Hóa 12 Chân trời sáng tạo
- Bài 18. Nguyên tố nhóm IIA trang 114, 115, 116 SBT Hóa 12 Chân trời sáng tạo
- Bài Ôn tập chương 8. Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức chất trang 136, 137 SBT Hóa 12 Chân trời sáng tạo
- Bài 20. Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch trang 132, 133, 134 SBT Hóa 12 Chân trời sáng tạo
- Bài 19. Đại cương về kim loại chuyển tiếp thứ nhất trang 128, 129, 130 SBT Hóa 12 Chấn trời sáng tạo
- Bài Ôn tập chương 7. Nguyên tố nhóm IA và IIA trang 121, 122 SBT Hóa 12 Chân trời sáng tạo
- Bài 18. Nguyên tố nhóm IIA trang 114, 115, 116 SBT Hóa 12 Chân trời sáng tạo













Danh sách bình luận