Bài 17. Nguyên tố nhóm IA trang 108, 109, 110 SBT Hóa 12 Chân trời sáng tạo
Nguyên tử của các nguyên tố nhóm IA khác nhau về
17.1
Nguyên tử của các nguyên tố nhóm IA khác nhau về
A. số electron lớp ngoài cùng của nguyên tử
B. cấu hình electron nguyên tử
C. số oxi hóa của nguyên tử trong hợp chất
D. kiểu mạng tinh thể của đơn chất
Phương pháp giải:
Dựa vào cấu hình của nguyên tố nhóm IA.
Lời giải chi tiết:
Nguyên tử các nguyên tố nhóm IA khác nhau về cấu hình electron nguyên tử vì mỗi nguyên tố nằm ở 1 chu kì khác nhau.
Đáp án B
17.2
Theo chiều tăng dần của điện tích hạt nhân nguyên tử, sự biến đổi tính chất của các nguyên tố nhóm IA nào sau đây đúng?
A. Bánh kính nguyên tử giảm dần.
B. Nhiệt độ nóng chảy tăng dần.
C. Độ cứng giảm dần.
D. Khối lượng riêng của đơn chất giảm dần.
Phương pháp giải:
Dựa vào biến đổi tính chất vật lí của nhóm IA.
Lời giải chi tiết:
Độ cứng của nguyên tố nhóm IA giảm dần.
Đáp án C
17.3
Công thức chung của oxide kim loại nguyên tố nhóm IA là
A. R2O3 B. RO2
C. R2O D. RO
Phương pháp giải:
Nguyên tố nhóm IA có hóa trị I.
Lời giải chi tiết:
Vì nguyên tố nhóm IA có hóa trị I nên công thức chung của oxide là: R2O.
Đáp án C
17.4
Cation M+ có cấu hình electron lớp ngoài cùng là 2s22p6. Biết Li (Z=7); Na (Z=11); K (Z=19). Cation M+ là
A. Rb+ B. Na+
C. Li+ D. K+
Phương pháp giải:
Dựa vào cấu hình electron của nguyên tố nhóm IA.
Lời giải chi tiết:
Cấu hình của M là 1s2 2s22p6 3s1 vậy M là Na
Đáp án B
17.5
Cho các dãy kim loại sau: Fe, Na, K, Cu và Li. Số kim loại trong dãy tác dụng được với nước ở nhiệt độ thường là
A. 1 B. 2 C. 3 D. 4
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại nhóm IA.
Lời giải chi tiết:
Na, K, Li có thể tác dụng được với nước ở nhiệt độ thường.
Đáp án C
17.6
Nước Javel là sản phẩm của quá trình
A. sục khí chlorine vào vôi sữa
B. cho dung dịch NaOH loãng tác dụng với khí chlorine
C. điện phân dung dịch NaOH có màng ngăn giữa hai điện cực
D. điện phân nóng chảy NaOH không có màng ngăn
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại nhóm IA
Lời giải chi tiết:
Nước Javel là sản phẩm của quá trình điện phân dung dịch NaOH loãng tác dụng với khí chlorine để thu được hỗn hợp muối NaCl và NaClO.
Đáp án B
17.7
Phương pháp điều chế NaOH trong công nghiệp là
A. Cho kim loại Na tác dụng với nước: 2Na + 2H2O → 2NaOH + H2↑
B. Cho Na2O tác dụng với nước: Na2O + H2O → 2NaOH
C. Điện phân dung dịch NaCl bão hòa có màng ngăn: 2NaCl + 2H2O 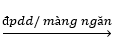 2NaOH + H2↑ + Cl2↑
2NaOH + H2↑ + Cl2↑
D. Điện phân dung dịch NaCl 20% không có màng ngăn: 2NaCl + 2H2O 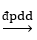 2NaOH + H2↑ + Cl2↑
2NaOH + H2↑ + Cl2↑
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại nhóm IA.
Lời giải chi tiết:
Để điều chế NaOH trong công nghiệp người ta điện phân dung dịch NaCl bão hòa có màng ngăn:
2NaCl + 2H2O 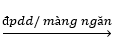 2NaOH + H2↑ + Cl2↑
2NaOH + H2↑ + Cl2↑
Đáp án C
17.8
Cho sơ đồ phản ứng: NaCl → X → NaHCO3 → Y → NaNO3
Chất X và Y phù hợp có thể là
A. NaOH và Na2CO3
B. NaOH và NaClO
C. Na2CO3 và NaClO
D. NaClO3 và Na2CO3
Phương pháp giải:
Dựa vào tính chất hóa học của các hợp chất thông dụng nhóm IA.
Lời giải chi tiết:
Đáp án A
Chất X, Y phù hợp tương ứng là NaOH và Na2CO3
2NaCl + 2H2O 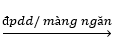 2NaOH + H2 + Cl2
2NaOH + H2 + Cl2
NaOH + CO2 → NaHCO3
NaHCO3 + NaOH → Na2CO3 + H2O
Na2CO3 + Ca(NO3)2 → 2NaNO3 + CaCO3
17.9
Cho a mol CO2 vào dung dịch chứa b mol NaOH, dung dịch thu được chứa muối Na2CO3 và NaHCO3. Giá trị của a và b trong trường hợp nào sau đây là đúng?
A. a > b B. a < b < 2a C. b > 2a D. a = b
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại nhóm IA.
Lời giải chi tiết:
Phương trình hóa học của phản ứng
CO2 + NaOH → NaHCO3 (1)
CO2 + 2NaOH → Na2CO3 + H2O (2)
Theo phương trình (1), khi số mol CO2 bằng mol NaOH, tạo muối NaHCO3
Theo phương trình (2), khi số mol CO2 bằng ½ mol NaOH, tạo muối Na2CO3
Để dung dịch thu được cả 2 muối Na2CO3 và NaHCO3 thì a < b < 2a
17.10
Cho 0,53 gam muối carbonate của kim loại nhóm IA tác dụng với dung dịch HCl, thu được 1223,95 mL khí CO2 (đkc). Công thức của muối là
A. Na2CO3 B. NaHCO3 C. KHCO3 D. K2CO3
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại nhóm IA.
Lời giải chi tiết:
Đáp án: A
Phương trình hóa học: M2CO3 + 2HCl → 2MCl + CO2 + H2O
Ta có: n CO2 = \(\frac{{1213,95}}{{24,79}} = 0,005mol\)
Theo phương trình hóa học: n M2CO3 = n CO2 = 0,005 mol
\( \to \)MM2CO3 = \(\frac{{0,53}}{{0,005}} = 106 \to {M_M} = 23\)
Vậy M là Na; Công thức của muối là Na2CO3.
17.11
Để xác định 3 hợp chất X, Y, Z đều là muối của Na (khi bị đốt cháy cho ngọn lửa màu vàng đặc trưng), tiến hành các thí nghiệm sau:
Thí nghiệm 1: Cho các mẫu thử tác dụng với dung dịch Ba(NO3)2, chỉ có X tạo kết tủa.
Thí nghiệm 2: Cho các mẫu thử tác dụng với dung dịch H2SO4 thì Y và Z tạo ra chất khí.
Thí nghiệm 3. Cho các mẫu thử tác dụng với dung dịch KMnO4 trong H2SO4, chỉ có làm nhạt màu dung dịch KMnO4.
Xác định X, Y, Z. Viết các phương trình hóa học xảy ra.
Phương pháp giải:
Dựa vào tính chất hóa học nhóm IA.
Lời giải chi tiết:
Hợp chất X, Y, Z lần lượt là NaHSO4; NaHSO3; NaHCO3.
Các phương trình hóa học:
NaHSO4 + Ba(NO3)2 → BaSO4 + NaNO3 + HNO3
2NaHSO3 + H2SO4 → Na2SO4 + 2H2O + 2SO2
2NaHCO3 + H2SO4 → Na2SO4 + 2H2O + 2CO2
2NaHSO4 + Ba(OH)2 → BaSO4 + Na2SO4 + 2H2O
2NaHSO3 + Ba(OH)2 → BaSO3 + Na2SO3 + 2H2O
2NaHCO3 + Ba(OH)2 → BaCO3 + Na2CO3 + 2H2O
10NaHSO3 + 4KMnO4 + H2SO4 → 5Na2SO4 + 2K2SO4 + 4MnSO4 + 6H2O
17.12
Viết phương trình hóa học dạng ion của các phản ứng trong thí nghiệm sau (các phản ứng xảy ra hoàn toàn): Đun nóng dung dịch NaHCO3, để nguội rồi đem tác dụng lần lượt với dung dịch Ba(NO3)2, dung dịch AlCl3.
Phương pháp giải:
Dựa vào tính chất hóa học nhóm IA
Lời giải chi tiết:
Phương trình hóa học:
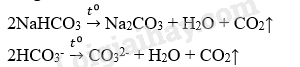
Dung dịch thu được tác dụng với dung dịch Ba(NO3)2
Ba2+ + CO32- → BaCO3↓
Dung dịch thu được tác dụng với AlCl3
2Al3+ + 3CO32- + 3H2O → Al(OH)3↓ + 3CO2↑
17.13
Dựa vào đồ thị về độ tan của các chất rắn trong nước ở hình bên, hãy cho biết độ tan của các muối NaNO3, KBr, KNO3, NaCl, Na2SO4 ở nhiệt độ 100C và 600C.
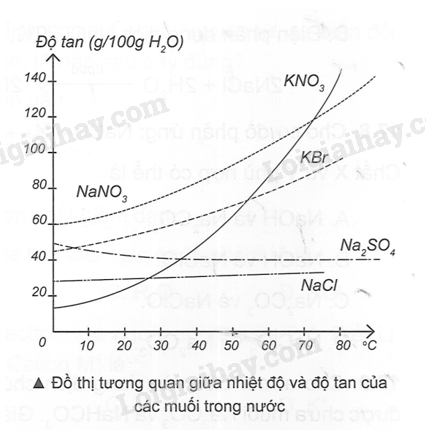
Phương pháp giải:
Dựa vào đồ thị tương quan giữa nhiệt độ và độ tan của các muối trong nước.
Lời giải chi tiết:
Từ điểm nhiệt độ 100C và 600C, kẻ những đường thẳng song song với trục tan (trục đứng), tại giao điểm của những đường thẳng này với các đồ thị, kẻ những đoạn thẳng song song với nhiệt độ (trục ngang) để đọc độ tan của các chất.
|
Chất |
Độ tan ở 100C/ 100 g H2O |
Độ tan ở 600C/ 100 g H2O |
|
NaNO3 |
80 gam |
130 gam |
|
KBr |
60 gam |
95 gam |
|
KNO3 |
20 gam |
110 gam |
|
NaCl |
35 gam |
38 gam |
|
Na2SO4 |
60 gam |
45 gam |
17.14
Viết phương trình hóa học cho các trường hợp phản ứng sau:
a. Sodium oxide tác dụng với nước.
b. Potassium hydroxide tác dụng với acetic acid.
c. Potassium superoxide tác dụng với nước.
d. Điện phân KBr nóng chảy.
e. Điện phân dung dịch NaCl có màng ngăn.
g. NaOH + SO2.
h. Na + (CH3)2CHOH
i. KOH + CO2
k. H2C2O4 + CsOH
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại IA.
Lời giải chi tiết:
a. Na2O + H2O → 2NaOH
b. KOH + CH3COOH → CH3COOK + H2O
c. 2KO2 + 2H2O → 2KOH + O2 + H2O2
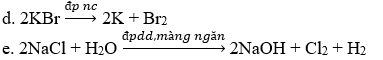
g. NaOH + SO2 → Na2SO3 + H2O
h. Na + (CH3)2CHOH → (CH3)2CHONa + ½ H2
i. KOH + CO2 → K2CO3 + H2O
k. H2C2O4 + CsOH → (COOCs)2 + 2H2O
17.15
Cho giá trị độ tan trong nước ở 298 K của một số chất trong bảng sau:
|
Chất |
Li2CO3 |
LiI |
Na2CO3 |
NaOH |
Cs2CO3 |
KNO3 |
|
Độ tan (g/100 g H2O) |
1,33 |
165 |
21,5 |
109 |
234 |
31,6 |
a. Hợp chất nào sau đây tan ít nhất trong nước ở 298 K: Li2CO3, LiI, Na2CO3, NaOH, Cs2CO3, KNO3?
b. Hợp chất nào sau đây xảy ra phản ứng khi thêm vào nước ở 298 K: RbOH, NaNO3, Na2O, Li2SO4, K2CO3, LiF?
Phương pháp giải:
Dựa vào tính chất vật lí của kim loại IA.
Lời giải chi tiết:
a. Dựa vào bảng độ tan, ta thấy chất ít tan trong nước nhất là Li2CO3.
b. Chất tác dụng với H2O là Na2O: Na2O + H2O → 2NaOH
17.16
Sơ đồ dưới đây mô tả quá trình Solvay để điều chế Na2CO3 trong công nghiệp.
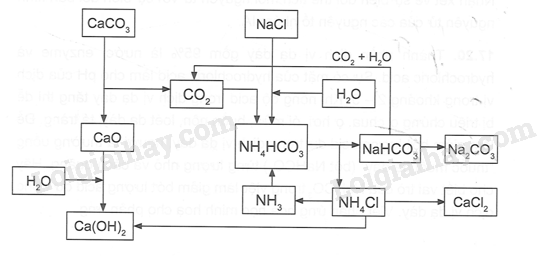
Dựa vào sơ đồ trên, hãy:
a. Viết phương trình của phản ứng tổng quát tạo Na2CO3.
b. Viết phương trình cân bằng của cặp muối NaCl/ NH4HCO3.
c. Viết phương trình hình thành NH4HCO3.
d. Nêu vai trò của Ca(OH)2 trong quá trình và viết phương trình phản ứng.
Phương pháp giải:
Dựa vào điều chế các hợp chất của nhóm IA.
Lời giải chi tiết:
a. Phương trình hóa học tổng quát tạo Na2CO3
- Nung CaCO3 ở 950 – 11000C, dẫn khí thoát ra vào dung dịch bão hòa NaCl trong NH3
CaCO3 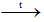 CaO + CO2
CaO + CO2
NaCl + NH3 + CO2 + H2O → NaHCO3 + NH4Cl
Tách NaHCO3 ra khỏi dung dịch, nung ở nhiệt độ 4500C – 5000C thu được soda
2NaHCO3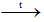 Na2CO3 + CO2 + H2O
Na2CO3 + CO2 + H2O
b. Phương trình cân bằng của cặp muối NaCl/ NH4HCO3
NaCl + NH4HCO3 \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)NaHCO3 + NH4Cl
c. Viết phương trình tạo thành NH4HCO3
2NH3 + CO2 + H2O → (NH4)2CO3
(NH4)2CO3 + CO2 + H2O → 2NH4HCO3
d. Sản phẩm NH4Cl chế hóa với vôi tôi thu khí NH3
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O
Các khí CO2, NH3 được đưa vào sử dụng lại. NH3 được tuần hoàn trong quá trình sản xuất, do đó phương pháp Solvay còn được gọi là phương pháp tuần hoàn ammonia.
17.17
a. Có ba dung dịch NaCl, LiCl, KCl trong các lọ bị mất nhãn. Hãy nêu các phương pháp dùng để nhận biết các dung dịch trên.
b. Chỉ dùng quì tím, hãy nhận biết các dung dịch sau: Na2CO3, NaOH, HCl, NaNO3.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại IA.
Lời giải chi tiết:
a. Trích mẫu thử ba dung dịch NaCl, LiCl, KCl. Dùng phương pháp thử màu ngọn lửa để nhận biết ion kim loại kiềm:
- Muối Li+ cháy cho ngọn lửa màu đỏ tía.
- Muối Na+ cháy cho ngọn lửa màu vàng.
- Muối K+ cháy cho ngọn lửa màu tím nhạt.
b. Dùng quì tím thử các mẫu
- Quỳ đỏ: dd HCl
- Quỳ xanh: dd Na2CO3, NaOH
- Quỳ không đổi màu: dd NaNO3
Lấy dung dịch HCl cho vào hai mẫu quì xanh, mẫu thoát khí là Na2CO3, còn lại là NaOH;
Phương trình hóa học:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
NaOH + HCl → NaCl + H2O
17.18
Hãy giải thích ứng dụng của Na2CO3 trong các trường hợp sau:
a. Bên cạnh việc phải lọc nước thường xuyên thì cần sử dụng hóa chất Na2CO3 trong xử lí nước bể bơi để đảm bảo được chất lượng loại bỏ vi khuẩn, giúp xử lí nước hồ bơi hiệu quả và nhanh chóng.
b. Soda chiếm 13% - 15% nguyên liệu sản xuất thủy tinh.
Phương pháp giải:
Dựa vào ứng dụng của hợp chất nhóm IA.
Lời giải chi tiết:
a. Na2CO3 là hóa chất có tác dụng làm tăng độ pH của nước bể bơi. Với một lượng vừa đủ, Na2CO3 giúp cân bằng chỉ số pH cho nước. Ưu điểm của chất này là mang lại hiệu quả nhanh, và không gây độc hại.
b. Soda chiếm 13-15% trong nguyên liệu sản xuất thủy tinh. Thường thủy tinh được tạo thành từ: cát trắng mịn, soda, thủy tinh tái chế, và các loại chất phụ gia khác. Nguyên liệu Na2CO3 được thêm vào có tác dụng làm hạ thấp nhiệt độ đến mức cần thiết và phù hợp nhất để có thể chế ra được thủy tinh.
17.19
Dựa vào Bảng 17.12 về khối lượng riêng của các kim loại nhóm IA trong SGK để tính thể tích mol nguyên tử của chúng ở trạng thái rắn. Nhận xét về sự biến đổi thể tích mol nguyên tử với sự biến đổi bán kính nguyên tử của các nguyên tố nhóm IA.
Phương pháp giải:
Dựa vào Bảng 17.12 SGK
Lời giải chi tiết:
Từ công thức V=M/d, ta có bảng số liệu sau:
|
Kim loại |
Li |
Na |
K |
Rb |
Cs |
|
Khối lượng mol nguyên tử M (g) |
7 |
23 |
39 |
85 |
133 |
|
Khối lượng riêng d (g/cm3) |
0,53 |
0,97 |
0,86 |
1,53 |
1,90 |
|
Thể tích mol nguyên tử V (cm3) |
13,21 |
23,71 |
45,35 |
55,56 |
70,00 |
|
Bán kính nguyên tử (pm) |
152 |
186 |
248 |
248 |
265 |
Ta thấy: Bánh kính và thể tích mol nguyên tử tăng dần từ Li đến Cs theo chiều tăng của điện tích hạt nhân nguyên tử.
17.20
Thành phần của dịch dạ dày gồm 95% là nước, enzyme và hydrochloric acid. Sự có mặt của hydrochloric acid làm cho pH của dịch vị trong khoảng 2 – 3. Khi nồng độ acid trong dịch vị dạ dày tăng thì dễ bị triệu chứng ợ chua, ợ hơi, ói mửa, buồn nôn, loét dạ dày, tá tràng. Đề làm giảm bớt lượng acid dư trong dịch vị dạ dày, người ta thường uống “thuốc muối dạ dày” (bột NaHCO3) từng lượng nhỏ và cách quãng. Hãy cho biết vai trò của NaHCO3 trong việc làm giảm bớt lượng acid dư trong dịch vị dạ dày. Viết phương trình hóa học minh họa cho phản ứng.
Phương pháp giải:
Dựa vào ứng dụng của hợp chất nhóm IA.
Lời giải chi tiết:
Việc sử dụng NaHCO3 với từng lượng nhỏ, cách quãng có tác dụng làm pH của dịch vị tăng dần từ từ và khí carbon dioxide thoát ra chậm rãi. Nếu sử dụng không đúng chỉ định, lượng khí carbon dioxide thoát ra nhiều và nhanh sẽ làm giãn các cơ quan tiêu hóa, gây nguy hiểm cho người bệnh.
Phương trình hóa học: NaHCO3 + HCl → NaCl + H2O + CO2↑
17.21
Sodium sulfate (Na2SO4) được ứng dụng trong sản xuất giấy, thủy tinh, chất tẩy rửa. Trong công nghiệp, Na2SO4 được sản xuất bằng cách đun H2SO4 với NaCl. Người ta dùng một lượng H2SO4 vừa đủ, nồng độ 75% đun với NaCl. Sau phản ứng thu được sản phẩm có tỉ lệ như sau: 91,48% Na2SO4; 4,79% NaHSO4; 1,98% NaCl; 1,35% H2O; 0,40% HCl.
a. Viết các phản ứng hóa học xảy ra. Tính tỉ lệ % NaCl đã chuyển hóa thành Na2SO4.
b. Tính khối lượng hỗn hợp rắn thu được nếu dùng một tấn NaCl.
c. Tính thành phần % khối lượng mỗi khí và hơi thoát ra khi sản xuất được 1 tấn hỗn hợp rắn.
Phương pháp giải:
Dựa vào tính chất hóa học nhóm IA.
Lời giải chi tiết:
a. Phương trình hóa học:
H2SO4 + 2NaCl → Na2SO4 + 2HCl
H2SO4 + NaCl → NaHSO4 + HCl
Giả sử có 100g khối lượng sản phẩm
Bảo toàn nguyên tố Na ta có: nNaCl (ban đầu) =\(2.\frac{{91,48}}{{142}} + \frac{{4,79}}{{120}} + \frac{{1,98}}{{58,5}} = 1,36mol\)
mNaCl (ban đầu) = 1,36.58,5 = 79,69 gam
Tỉ lệ % NaCl đã chuyển hóa thành Na2SO4 là: \(\frac{{2.{n_{Na2SO4}}}}{{{n_{NaCl}}}}\)=\(\frac{{2.\frac{{91,48}}{{142}}}}{{1.36}}.100 = 94,58\% \)
b. Ta có: tỉ lệ 79,69 gam NaCl tạo ra 91,48 gam Na2SO4
Vậy 1 tấn NaCl sẽ tạo ra 1,148 tấn Na2SO4
c. Theo bài ra, ta có % hỗn hợp rắn là
100% - % H2O - % HCl = 100 – 1,35 – 0,4 = 98,25%
Khi sản xuất được 1 tấn hỗn hợp rắn thì trong đó:
mH2O = 1,35 : 98,25 = 0,0137 tấn
mHCl = 0,4 : 98,25 = 0,0041 tấn
Tổng khối lượng khí và hơi thoát ra là: mH2O + mHCl = 0,0178 tấn
%mH2O = (0,0137 : 0,0178 ) x 100 = 76,97%
%mHCl = (0,0041 : 0,0178) x 100 = 23,03%
17.22
a. Vì sao các kim loại nhóm IA rất dễ nóng chảy? Hãy nếu thêm hai xu hướng biến đổi có tính quy luật về tính chất vật lí khác của nhóm IA.
b. Một giá trị đo ở Bảng 17.2 trong SGK không phù hợp với xu hướng biến đổi có tính quy luật. Hãy nêu xu hướng không phù hợp đó.
Phương pháp giải:
Dựa vào Bảng 17.2 SGK
Lời giải chi tiết:
a. Kích thước nguyên tử của các kim loại trong nhóm IA lớn nhất trong các chu kì tương ứng của chúng, và có cấu hình electron hóa trị là ns1. Do chỉ có 1 electron hóa trị và nằm tương đối xa hạt nhân nên kim loại nhóm IA có liên kết kim loại yếu, nhiệt độ nóng chảy thấp. Hai xu hướng biến đổi có tính quy luật về tính chất vật lí khác của nhóm IA là độ cứng và nhiệt độ sôi.
b. Khối lượng riêng của Na (0,97 g/cm3) lớn hơn khối lượng riêng của K (0,86 g/cm3), không phù hợp với xu hướng biến đổi có tính quy luật là khối lượng riêng tăng dần từ Li đến Cs.
17.23
Tiến hành điện phân với điện cực trơ có màng ngăn 200 mL dung dịch NaCl cho tới khi cathode thoát ra 0,2479 L khí (đkc) thì ngừng điện phân. Tính pH của dung dịch sau điện phân.
Phương pháp giải:
Dựa vào phương pháp điện phân dung dịch.
Lời giải chi tiết:
Phương trình điện phân: 2NaCl + 2H2O 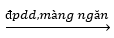 2NaOH + Cl2 + H2
2NaOH + Cl2 + H2
Ở cực âm (cathode) thu được H2 và NaOH:
2H2O + 2e → H2 + 2OH-
nH2 = 0,01 → nOH- = 0,02 → [OH]- = 0,02/0,2 = 0,1M → pH = 13.
Luyện Bài Tập Trắc nghiệm Hóa 12 - Chân trời sáng tạo - Xem ngay
Các bài khác cùng chuyên mục
- Bài Ôn tập chương 8. Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức chất trang 136, 137 SBT Hóa 12 Chân trời sáng tạo
- Bài 20. Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch trang 132, 133, 134 SBT Hóa 12 Chân trời sáng tạo
- Bài 19. Đại cương về kim loại chuyển tiếp thứ nhất trang 128, 129, 130 SBT Hóa 12 Chấn trời sáng tạo
- Bài Ôn tập chương 7. Nguyên tố nhóm IA và IIA trang 121, 122 SBT Hóa 12 Chân trời sáng tạo
- Bài 18. Nguyên tố nhóm IIA trang 114, 115, 116 SBT Hóa 12 Chân trời sáng tạo
- Bài Ôn tập chương 8. Sơ lược về dãy kim loại chuyển tiếp thứ nhất và phức chất trang 136, 137 SBT Hóa 12 Chân trời sáng tạo
- Bài 20. Sơ lược về phức chất và sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch trang 132, 133, 134 SBT Hóa 12 Chân trời sáng tạo
- Bài 19. Đại cương về kim loại chuyển tiếp thứ nhất trang 128, 129, 130 SBT Hóa 12 Chấn trời sáng tạo
- Bài Ôn tập chương 7. Nguyên tố nhóm IA và IIA trang 121, 122 SBT Hóa 12 Chân trời sáng tạo
- Bài 18. Nguyên tố nhóm IIA trang 114, 115, 116 SBT Hóa 12 Chân trời sáng tạo













Danh sách bình luận