Câu hỏi
Hỗn hợp X gồm N2 và H2 có dX/H2 = 3,6. Sau khi tiến hành tổng hợp NH3 thu được hỗn hợp Y có dY/H2 = 4. Hiệu suất tổng hợp NH3 là
- A 20%
- B 25%
- C 30%
- D 32%
Lời giải chi tiết:
\({{\overline{M}}_{X}}=3,6.2=7,2;\,\,\,\,\,\,\,\,\,\,\,\,{{\overline{M}}_{Y}}=4.2=8\)
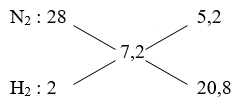
→ \(\frac{{{n}_{{{N}_{2}}}}}{{{n}_{{{H}_{2}}}}}=\frac{5,2}{20,6}=\frac{1}{4}\)
Giả sử có 1 mol N2 và 4 mol H2
N2 + 3H2 \(\overset {{t^o},xt,p} \leftrightarrows \) 2NH3
Ban đầu: 1 4 (Ta thấy: 1/1 < 4/3 nên hiệu suất tính theo N2)
Phản ứng: x → 3x → 2x
Sau: 1-x 4-3x 2x
→ n sau = 1 - x + 4 - 3x + 2x = 5 - 2x (mol)
Ở nhiệt độ không đổi thì:\(\frac{{{n}_{\text{truoc}}}}{{{n}_{\text{sau}}}}=\frac{{{\overline{M}}_{sau}}}{{{\overline{M}}_{\text{truoc}}}}\to \frac{5}{5-2x}=\frac{8}{7,2}\to x=0,25\)
\(\% H = \frac{{{n_{{N_2}pu}}}}{{{n_{{N_2}bd}}}}.100\% = \frac{{0,25}}{1}.100\% = 25\% \)
Đáp án B







