1. Ăn mòn kim loại là gì?
Ăn mòn kim loại là sự phá huỷ kim loại hoặc hợp kim do tác dụng của các chất trong môi trường trong đó kim loại bị oxi hoá : M\( \to \) Mn+ + ne.
2. Ăn mòn hoá học là gì?
Ăn mòn hoá học: là quá trình oxi hoá – khử, trong đó các electron được chuyển trực tiếp đến các chất trong môi trường.
3. Thí nghiệm về ăn mòn điện hoá
Nhúng thanh Zn và Cu (không tiếp xúc với nhau) vào cốc đựng dung dịch H2SO4 loãng.
Nối thanh Zn và Cu bằng dây dẫn cho đi qua một điện kế.
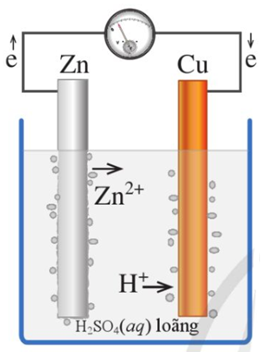
Thí nghiệm về sự ăn mòn điện hoá học
* Hiện tượng:
- Khi chưa nối dây dân, phần thanh kẽm trong dung dịch bị hoà tan và bọt khí hydrogen thoát ra ở bề mặt thanh kẽm.
- Khi nối dây dẫn, kim vôn ke bị lệch, bọt khí hydrogen thoát ra ở cả thanh đồng, phần thanh kẽm trong dung dịch bị ăn mòn nhanh.
* Giải thích:
- Khi chưa nối dây dẫn, có bọt khí hydrogen thoát ra ở bề mặt thanh kẽm do kim loại này bị ăn mòn hoá học theo phản ứng sau:
Zn(s) + H2SO4 (aq) \( \to \)ZnSO4(aq) + H2(g)
- Khi nối dây dẫn, một pin điện hoá đã được hình thành với kẽm là điện cực âm, đồng là điện cực dương.
+ Điện cực âm (anode), Zn bị ăn mòn.
Zn(s) \( \to \)Zn2+(aq) + 2e
Ion Zn2+ đi vào dung dịch, còn electron theo dây dẫn sang điện cực đồng.
+ Điện cực dương (cathode): ion H+ của dung dịch H2SO4 bị khử (nhận electron từ Zn chuyển sang) tạo H2.
2H+(aq) +2e\( \to \)H2(g)
=> Kết quả: Thanh Zn bị ăn mòn điện hoá và tạo thành dòng điện.
4. Ăn mòn điện hoá học là gì?
Ăn mòn điện hoá học: là quá trình ăn mòn kim loại do sự tạo thành pin điện hoá.
=> quá trình oxi hoá – khử, trong đó kim loại bị ăn mòn do tác dụng của dung dịch chất điện li và tạo nên dòng điện (electron chuyển từ cực dương sang cực âm).
5. Ăn mòn điện hoá gang, thép trong không khí ẩm
- Trong không khí ẩm trên bề mặt của gang luôn có một lớp nước rất mỏng đã hoà tan O2 và khí CO2, tạo thành dung dịch chất điện li.
- Gang là hợp kim (Fe - C) cùng tiếp xúc với dung dịch đó tạo nên vô số các pin nhỏ mà sắt là anotde và carbon là cathode.
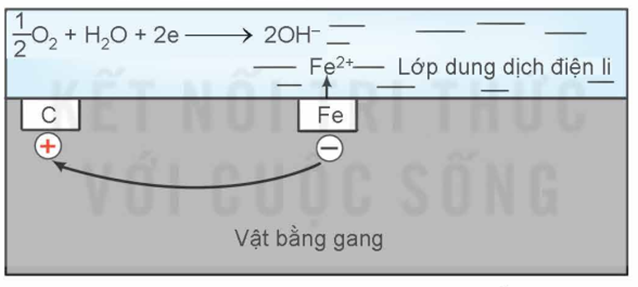
Tại anode: xảy ra quá trình oxi hoá: Fe(s) \( \to \)Fe2+(aq) + 2e => các electron được chuyển đến cathode.
Tại cathode: khí oxygen hoà tan trong nước bị khử thành ion \({\rm{O}}{{\rm{H}}^ - }\).
\(\frac{1}{2}\)O2(g) + H2O(l) +2e\( \to \)2\({\rm{O}}{{\rm{H}}^ - }\)(aq)
Ion Fe2+ tiếp tục bị oxi hoá bởi O2 trong không khí khi có mặt ion \({\rm{O}}{{\rm{H}}^ - }\)tạo ra gỉ sắt màu nâu đỏ (có thành phần chủ yếu là Fe2O3.nH2O.
6. So sánh giữa ăn mòn hoá học và ăn mòn điện hoá học
|
|
Ăn mòn hoá học |
Ăn mòn điện hoá học |
|
Giống |
Đều là phản ứng oxi hoá khử. |
|
|
Khác |
Không có phát sinh dòng điện. |
Có phát sinh dòng điện. |
|
Nhận biết |
Trong phản ứng chỉ có 1 kim loaij Vd: Fe + 2HCl→FeCl2 +H2 =>chỉ có 1 kim loại là Fe |
Trong pứ có 2 kim loại Fe+CuSO4→FeSO4+Cu =>Có 2 kim loại: Fe và Cu |
|
Điều kiện xảy ra ăn mòn điện hoá học: đủ 3 điều kiện sau - 2 kim loại khác nhau (hoặc kim loại – phi kim = gang, thép (Fe-C)). - 2 kim loại tiếp xúc trực tiếp hoặc gián tiếp. - 2 kim loại cùng tiếp xúc trong môi trường điện li: dung dịch acid, base, muối, không khí ẩm. |
||

 Đại cương về kim loại - Từ điển Hoá 12
Đại cương về kim loại - Từ điển Hoá 12 






Danh sách bình luận