1. Cách làm dạng bài tính chất hết, chất dư
Ghi nhớ: Luôn tính theo lượng chất sinh ra nếu có.
- Khi có số mol của các chất tham gia thì cần xét chất hết chất dư theo cách làm sau:
Ví dụ: Cho 5,6 gam sắt tác dụng với 100ml dung dịch HCl 0,2M thu được V lít khí H2 (đkc) và muối iron(II) chloride. Tính V?
Bước 1: Tính số mol của các chất nếu có
n Fe = \(\frac{m}{M} = \frac{{5,6}}{{56}} = 0,1mol\); n HCl = \({C_M}.V = 0,1.0,2 = 0,02mol\)
Bước 2: Viết phương trình hoá học
Fe + 2HCl → FeCl2 + H2
Bước 3: Xét chất hết chất dư theo công thức:
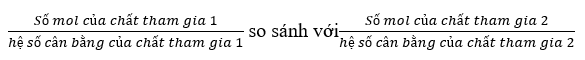
=> Nếu phân số nào nhỏ hơn thì chất tham gia đó hết và luôn tính theo chất hết.
Xét: \(\frac{{{n_{Fe}}}}{1}\)và \(\frac{{{n_{HCl}}}}{2}\)ta có: \(\frac{{0,1}}{1} > \frac{{0,02}}{2}\)=> HCl phản ứng hết, Fe phản ứng dư
Bước 4: Theo tỉ lệ cân bằng để tìm ra số mol của chất cần tìm
Theo phương trình: n H2 = \(\frac{1}{2}{n_{HCl}} = \frac{1}{2}.0,02 = 0,01mol\)
Bước 5: Tính lượng chất yêu cầu theo đề bài
V H2 = 0,01.24,79 = 0,2479L

 Phản ứng hoá học - Từ điển Khoa học tự nhiên 8
Phản ứng hoá học - Từ điển Khoa học tự nhiên 8 





