1. Hiệu suất phản ứng là gì?
Hiệu suất phản ứng cho biết phản ứng có xảy ra hoàn toàn hay không.
Với hiệu suất phản ứng nhỏ hơn 100%, khi đó:
- Lượng chất phản ứng dùng trên thực tế sẽ lớn hơn lượng tính theo phương trình hoá học (theo lí thuyết).
- Lượng sản phẩm thu được trên thực tế sẽ nhỏ hơn lượng tính theo phương trình hoá học.
2. Cách làm dạng bài tính hiệu suất phản ứng
Xét phản ứng trong trường hợp tổng quát: Chất phản ứng → Sản phẩm
Theo lí thuyết, phản ứng trên thu được m gam một chất sản phẩm. Nhưng thực tế thu được m’ gam chất đó (m’ ≤ m).
Hiệu suất phản ứng được tính theo công thức: H = \(\frac{{m'}}{m}.100\% \)
Nếu lượng chất theo só ôml thì hiệu suất được tính theo công thức H = \(\frac{{n'}}{n}.100\% \)
Trong đó: n là số mol chất sản phẩm tính theo lí thuyết, n’ là số mol chất sản phẩm thu được theo thực tế.
Ví dụ: Cho 8 gam iron(III) oxide tác dụng với khí hydrogen dư ở nhiệt độ cao, thu được 4,2 gam iron.
Phản ứng xảy ra như sau: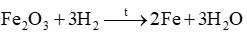 . Tính hiệu suất phản ứng.
. Tính hiệu suất phản ứng.
Bước 1: Tính số mol các chất nếu có thể.
n Fe2O3 = \(\frac{m}{M} = \frac{8}{{160}} = 0,05mol\)
n Fe = \(\frac{m}{M} = \frac{{4,2}}{{56}} = 0,075mol\)
Bước 2: Tính số mol các chất theo tỉ lệ số mol (Lưu ý: luôn tính theo lượng chất sản phẩm)
Theo phương trình: n Fe2O3 = \(\frac{1}{2}{n_{Fe}} = \frac{1}{2}.0,075 = 0,0375mol\)
Bước 3: Tính hiệu suất phản ứng (có thể tính theo khối lượng hoặc số mol)
H% = \(\frac{{{n_{F{e_2}{O_3}TT}}}}{{{n_{F{e_2}{O_3}LT}}}}.100\% = \frac{{0,0375}}{{0,05}}.100\% = 75\% \)

 Phản ứng hoá học - Từ điển Khoa học tự nhiên 8
Phản ứng hoá học - Từ điển Khoa học tự nhiên 8 






Danh sách bình luận